

- 必修1 第一章 第二节 离子反应(1) 学案 学案 24 次下载
- 必修1 第一章 第二节 离子反应(1)同步练习 学案 19 次下载
- 必修1 第一章 第二节 离子反应(2)同步练习 学案 20 次下载
- 必修1 第一章 第三节 氧化还原反应(1)同步练习 学案 15 次下载
- 必修1 第一章 第三节 氧化还原反应(1) 学案 学案 27 次下载
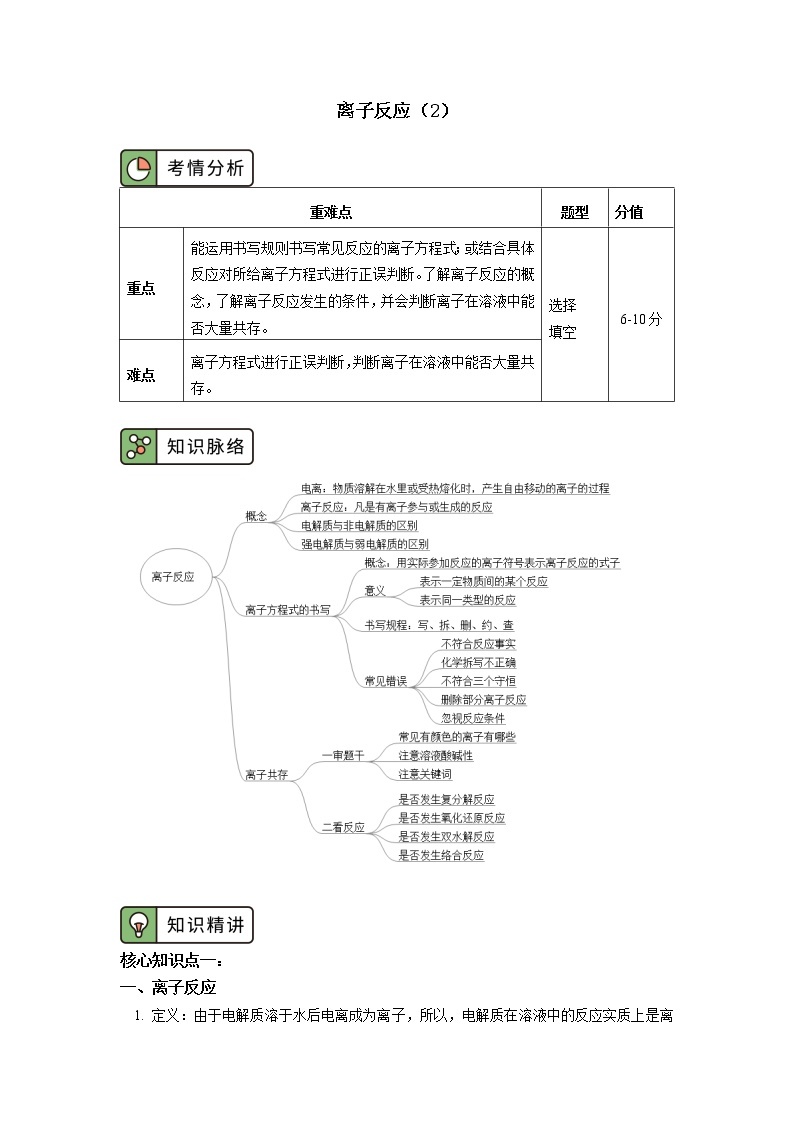
高中化学人教版 (2019)必修 第一册第二节 离子反应优秀学案
展开核心知识点一:
一、离子反应
1. 定义:由于电解质溶于水后电离成为离子,所以,电解质在溶液中的反应实质上是离子之间的反应,像这样,有离子参加的反应,就叫做离子反应。
2. 本质:反应物中的某些离子的浓度减小。
3. 发生条件:
①生成难溶(或微溶)的物质,如Al(OH)3、BaSO4、Ag2SO4、CaSO4、Ca(OH)2等。
②生成难电离的物质,如弱酸、弱碱、水等。
③生成挥发性的物质,如CO2、SO2、NH3等。
④发生氧化还原反应:如Zn与硫酸铜溶液:Zn+Cu2+=Zn2+ +Cu
二、离子方程式
1. 概念:用实际参加反应的离子符号表示离子反应的式子。
2. 书写离子方程式的四个步骤(以碳酸钙和盐酸的反应为例):
“一写”:首先以客观事实为依据写出反应的化学方程式:
CaCO3+2HCl==CaCl2+CO2↑+H2O
“二改”(或拆):把易溶于水且易电离的物质改写成离子形式(最关键的一步):
CaCO3+2H++2Cl―==Ca2++2Cl―+CO2↑+H2O
注意:
(1)书写离子方程式时,反应物或生成物中易溶的强电解质(强酸、强碱和可溶性盐)必须写成阴、阳离子的形式。难溶的强电解质、弱电解质、非电解质和单质则必须保留化学式。
(2)对于微溶性的强电解质:①在反应物中视情况而定。如澄清石灰水中Ca(OH)2以Ca2+、OH―存在,可以拆成离子的形式;石灰乳中主要以不溶的Ca(OH)2固体形式存在,不能拆成离子形式。②在生成物中,一般不能拆,以化学式形式表示。
(3)可溶性多元弱酸酸式盐的酸式根一律保留酸式根形式。如在水溶液中HCO3―写成H++CO32―是不对的。
“三删”:删去方程式两边未参加反应的离子:
CaCO3+2H+==Ca2++CO2↑+H2O
“四查”:检查离子方程式两边各元素的原子个数和电荷总数是否相等。
3. 离子方程式的意义:
化学方程式只表示某一个具体反应,而离子方程式表示的是某一类反应,并且它只写参与反应的离子,更能体现反应本质。例如:离子方程式CO32―+2H+==CO2↑+H2O表示可溶性碳酸盐和强酸在溶液中的反应,如Na2CO3和盐酸的反应。
三、离子方程式的正误判断
一个离子方程式是否正确,关键要看它能否反映溶液中离子反应的真实情况。我们可以从以下几个方面进行判断:
1. 是否符合客观事实:
如Fe和稀盐酸反应的离子方程式写成是错误的,和稀盐酸反应生成。
2. 化学式拆写是否正确
这是书写时最关键的一步,应注意以下几点:
①易溶于水的强电解质均拆写成离子形式,如强酸、强碱和大多数盐。其他物质均用化学式表示,如单质、氧化物、弱电解质(弱酸、弱碱、水)、非电解质及难溶性盐。
②微溶物写法。一般来说,澄清溶液(如石灰水)写出离子形式,浑浊或沉淀写出化学式。
③可溶性多元弱酸的酸式酸根一律写成酸式酸根的形式(如)。
④非溶液状态下的反应,一般不用离子方程式表示。如实验室中制备氨气的反应,虽然是离子互换的复分解反应,但不能用离子方程式表示。
3. 符号使用是否正确:要注意“”“”“”“”“”等符号的正确使用。
4. 是否遵循质量守恒、电荷守恒和得失电子守恒:如是错误的。
5. 是否漏掉离子反应:如溶液与溶液反应,既要注意与反应生成沉淀,也不能漏掉与反应生成沉淀。
6. 反应物或产物的配比是否正确:如稀硫酸与溶液反应不能写成,
应写成。
核心知识点二:
一、判断溶液中离子是否能大量共存
离子不能共存的原因主要由以下几个方面:
1. 复分解反应
(1)在溶液中某此离子间能互相反应生成难溶性物质时,这些离子就不能大量共存。
如SO42-与Ba2+、Pb2+、Ag+;
OH-与Cu2+、Fe3+、Mg2+、Al3+、Zn2+;
Ag+与Cl-、Br-、I-、CO32-、SO32-、S2-;
Mg2+、Ca2+、Ba2+与CO32-、SO32-、PO43-;S2-与Cu2+、Pb2+等
(2)离子间能结合生成难电离的物质时,则这些离子不能大量共存。
如H+与OH-、ClO-、CH3COO-、HPO42-、H2PO4-、F―、S2―
OH-与HCO3-、HS-、HSO3-、H2PO4-、HPO42-、H+等不能大量共存。
(3)离子间能结合生成挥发性物质时,则这些离子不能大量共存。
如:H+与CO32-、SO32-、S2-、HCO3-、HSO3-、HS-
OH―与NH4+等不能大量共存。
小结:强酸与弱酸的阴离子和弱酸的酸式酸根离子不能大量共存。
强碱与弱碱的阳离子和弱酸的酸式酸根离子不能大量共存。
注意题目是否给出附加条件,例如酸碱性,在酸性溶液中除题给离子外,还应有大量H+,在碱性溶液中除题给离子外,还应有大量OH―;是否给定溶液无色,若给定无色时则应排除:Cu2+(蓝色)、Fe3+(黄棕色)、Fe2+(浅绿色)、MnO4-(紫色)
2. 离子不能共存的类型
①离子结合成沉淀不能共存,微溶物不能大量共存
CO32-与Ca2+、Ba2+、Mg2+、Ag+、
SO42-与 Ba2+、Pb2+、Ag+、Ca2+;
OH-与 Fe2+、Fe3+、Mg2+、Cu2+等;
Ag+与OH-、Cl-、Br-、I-、SO42-、PO43-
②离子反应生成弱酸、弱碱、水不能共存
H+:只与Cl-、SO42-、NO3-、ClO4-、Br-、I-共存
OH-:只与K+、Na+、Ca2+、Ba2+共存
③相互发生氧化还原反应的离子不能共存
强氧化性:MnO4-、NO3-(H+)、Fe3+
强还原性:S2-、I-、Fe2+
3. 判断离子共存的隐含条件
①有H+——酸性溶液,石蕊变红,与金属产生气体
②有OH-——碱性溶液,石蕊变蓝,酚酞变红
③无色溶液——有颜色的离子不能存在
Fe3+:黄色 Fe2+:浅绿色 Cu2+:蓝色 MnO4-:紫红色
4. 过量少量反应的离子方程式;
(1)NaHCO3分别与盐酸和NaOH反应
HCO3- + H+= H2O+ CO2↑
HCO3- +OH- = H2O+ CO32-
弱酸酸式盐与酸反应生成弱酸,与碱反应生成正盐和水,强酸酸式盐只与碱反应
(2)澄清石灰水分别通入少量和过量CO2
少量:CO2+Ca2++2OH-=CaCO3↓+H2O
过量:CO2+OH-=HCO3-
正盐不溶,酸式盐溶;正盐溶,酸式盐溶解度变小;
酸性氧化物与碱反应少量成正盐,过量成酸式盐
(3)NaHCO3分别与少量、等量、过量的Ba(OH)2反应
少量:2HCO3-+ Ba2++ 2OH-=BaCO3↓+2H2O+CO32-
等量:HCO3-+ Ba2++ OH-= BaCO3↓+ H2O
过量:HCO3-+ Ba2++ OH-= BaCO3↓+ H2O
关键:将少量反应完的反应物系数定为1
(4)Ca(HCO3)2分别与少量、等量、过量的 NaOH反应
少量:Ca2+ + HCO3- + OH- = CaCO3↓+H20
等量:Ca2+ + HCO3- + OH- = CaCO3↓+H20
过量:Ca2+ + 2HCO3- +2OH- =CaCO3↓+2H20+CO32-
(5)NaHCO3 与 Ca(OH)2 的过量、少量反应
少量:2HCO3-+ Ca2++ 2OH-=CaCO3↓+2H2O+CO32-
过量:HCO3-+ Ca2++ OH-= CaCO3↓+ H2O
核心知识点一:
下列离子方程式中,不正确的是 (填序号)①大理石跟盐酸反应:CO32-+2H+=CO2↑+H2O ②硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
③把金属铁放入稀硝酸中:Fe+2H+=Fe2++H2↑
④铜片插入硝酸银溶液:Cu+Ag+=Cu2++Ag
⑤碳酸钙跟盐酸反应:CaCO3+2HCl=Ca2++2Cl-+H2O+CO2↑
⑥氢氧化钡溶液跟硫酸反应;Ba2++SO42-+OH-+H+=H2O+BaSO4↓
【考点】做这类题的一般方法是先写化学方程式,然后再改写成离子方程式,最后核对题中的选项是否正确。
【答案】①②③④⑤⑥
【解析】本题考查离子方程式的书写。①中大理石的主要成分碳酸钙难溶于水,所以不能拆;②中是同时发生了两个离子反应:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓;③中铁放入稀硝酸中生成Fe3+和NO气体;④中不满足电荷守恒;⑤中盐酸没有拆, ⑥中不能将其中的中和反应局部约分,应为:Ba2++SO42-+2OH-+2H+=2H2O+BaSO4↓。
【总结】判断离子方程式正误的方法是“五查”“三看”。“五查”:一查化学式是否需改写或改写是否正确;二查“==”或“”使用是否恰当;三查两个守恒:质量守恒和电荷守恒;四查电子得失是否相等(对氧化还原反应);五查反应是否符合客观事实。“三看”:一看反应环境,到底是酸性介质还是碱性介质;二看物质的溶解性;三看反应的可能性,即反应是否能发生,或者反应过程中的过量与不足的讨论。
能正确解释下列反应原理的离子方程式是( )
A. 用食醋除去暖水瓶中的水垢:2CH3COOH + CaCO3 ═ Ca2+ + 2CH3COO- + CO2↑+ H2O
B. 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C. 用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++ Cu=Fe2++ Cu2+
D. 碳酸氢钠溶液中加入少量石灰水:HCO3-+Ca2+ + OH-=CaCO3↓+ H2O
【答案】A
【解析】B项,小苏打为NaHCO3,离子方程式应为:HCO3-+H+=CO2↑+H2O;C项,电荷不守恒,应为:2Fe3++ Cu=2Fe2++ Cu2+;D项,注意石灰水少量,应为:2HCO3-+ Ca2+ +2 OH- = CaCO3↓+2 H2O+ CO32―
核心知识点二
在溶液中能大量共存,加入强碱溶液有沉淀析出,加入强酸有气体放出的是( )
A. Na+、Cu2+、Cl﹣、SO42﹣
B. Fe3+、K+、SO42﹣、NO3﹣
C. K+、Ba2+、Cl﹣、CO32﹣
D. Na+、Ca2+、Cl﹣、HCO3﹣
【考点】根据离子之间不能结合生成水、气体、沉淀等,则离子大量共存,并加入强碱溶液有沉淀析出,加入强酸有气体放出,以此来解答。
【答案】D
【解析】A. 该组离子之间不反应,能大量共存,且加碱生成氢氧化铜沉淀,但加酸没有气体,故A不选;
B. 该组离子之间不反应,能大量共存,且加碱生成氢氧化铁沉淀,但加酸没有气体,故B不选;
C. 因Ba2+、CO32﹣反应生成沉淀,不能大量共存,故C错误;
D. 该组离子之间不反应,能大量共存,且加碱生成碳酸钙沉淀,加酸生成二氧化碳,故D选;
【总结升华】本题考查离子的共存,侧重信息抽取和离子反应的考查。
在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是( )
A. Na+、K+、OH-、Cl-
B. Na+、Cu2+、SO42﹣、NO3﹣
C. Mg2+、Na+、SO42﹣、Cl-
D. K+、Na+、NO3﹣、CO32-
【答案】C
【解析】A项,H+与OH-反应;B项,Cu2+有颜色;D项,H+与CO32-反应。
排除干扰,确定离子
(答题时间:25分钟)
1. 某中性的溶液中含有Na+、NH4+、Fe2+、Br﹣、CO32﹣、I﹣、SO32﹣七种离子中的某几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定存在的离子是( )
A. NH4+、Br﹣、CO32﹣
B. Na+、Br﹣、CO32﹣
C. Na+、I﹣、SO32﹣
D. NH4+、CO32﹣、I﹣
2. 下列离子能大量共存的是( )
A. OH-、SO42-、Ba2+、Na+
B. H+、Na+、Al3+、C1-
C. OH-、NH4+、NO3-、K+
D. Fe2+、H+、NO3-、K+
3. 某溶液中含有大量的下列离子:Mg2+、NO3-、K+和M离子,经测定Mg2+、NO3-、K+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是( )
A. Cl- B. SO42- C. OH- D. Na+
4. 下列离子方程式中,正确的是( )
A. 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 氯气与氯化亚铁溶液反应:2FeCl2+Cl2=2FeCl3
C. 氯化铁溶液与铁反应:Fe3++Fe=2Fe2+
D. 氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH﹣=Fe(OH)3↓
5. 下列离子方程式正确的是( )
A. 石灰水与过量碳酸氢钠溶液反应:HCO3﹣+Ca2++OH﹣=CaCO3↓+H2O
B. 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O
C. 氧化铜与稀硫酸反应:2H++O2﹣=H2O
D. 碳酸氢钠溶液中加入盐酸:CO32﹣+2H+=CO2↑+H2O
6. 下列离子方程式正确的是( )
A. 铁跟盐酸反应:2Fe +6H+ =2Fe3++3H2↑
B. 氯气与水反应:Cl2 + H2O = 2H++Cl+ClO-
C. 硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+ H2O
D. 金属钠与水反应:2Na +2H2O =2Na++2OH-+H2↑
7. 有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等物质组成,为鉴定成分,做了如下实验:
(1)将混合物溶于水,得无色澄清溶液;
(2)向此溶液中滴加BaCl2溶液,有白色沉淀产生
(3)过滤后,在白色沉淀中加足量稀HNO3,沉淀完全溶解。
由此推断:混合物中肯定有_____________,肯定没有_____________,可能有___________________。若想进一步确定可能有的物质是否存在,可在(1)溶液中加_______________________溶液的方法来检验。
1. 【答案】A
【解析】解:①在原溶液中滴加足量的饱和氯水后,有气泡生成,说明溶液中含有CO32﹣,则一定不存在Fe2+,溶液呈橙黄色,说明可能生成I2或Br2;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明不含SO32﹣;③橙黄色溶液不能使淀粉溶液变蓝色,说明不含I﹣。所以溶液中一定不存在Fe2+、I﹣、SO32,一定存在Br﹣、CO32﹣,阳离子只有Na+、NH4+,若只有Na+,溶液一定显示碱性,而现在溶液显中性,所以溶液中一定含有铵离子,故选:A。
2.【答案】B
【解析】正确答案:B
A. SO42-+Ba2+=BaSO4↓
B. 共存
C. OH-+NH4+ =NH3·H2O
D. 3Fe2++4H++2 NO3-=3Fe3++2NO+2H2O
【点评】根据离子之间不能结合生成水、气体、沉淀,不能发生氧化 还原反应等,则离子能大量共存,以此来解答。
3 .【答案】A
【解析】Mg2+、NO3-、K+和M离子的物质的量之比为2∶4∶1∶1,根据电荷守恒可得,2n(Mg2+)+n(K+)>n(NO3-),阴离子电荷少,所以M离子应带有负电荷,根据电荷守恒可知M带一个负电荷,而OH-与Mg2+反应生成氢氧化镁沉淀,不能大量共存,所以M离子可能是氯离子,故答案为:A。
4.【答案】D
【解析】A. 铁与盐酸反应生成了亚铁离子和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,故A错误;
B. 氯气与氯化亚铁溶液反应,亚铁离子被氯气氧化,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl﹣,故B错误;
C. 铁离子与铁反应生成了亚铁离子,离子方程式两边电荷不相等,正确的离子方程式为:2Fe3++Fe=3Fe2+,故C错误;
D. 氯化铁溶液与氢氧化钠溶液反应,生成了氢氧化铁沉淀,反应的离子方程式为:Fe3++30H﹣=Fe(OH)3↓,故D正确;
故选D。
5.【答案】B
【解析】A. 灰水与过量碳酸氢钠溶液反应的离子方程式为:2HCO3﹣+Ca2++2OH﹣=CaCO3↓+2H2O+CO32﹣,A不符合题意;
B. 硫酸氢钠溶液中加入氢氧化钡溶液至中性,离子方程式为:2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O,B符合题意;
C. 氧化铜与稀硫酸反应的离子方程式为:2H++CuO=H2O+Cu2+,C不符合题意;
D. 碳酸氢钠溶液中加入盐酸反应的离子方程式为:HCO3﹣+H+=CO2↑+H2O,D不符合题意;
故答案为:B。
6.【答案】D
【解析】正确答案:D
A. 铁跟盐酸反应: Fe +2H+ =Fe2++H2↑;
B. 氯气与水反应:Cl2 + H2OH++Cl+HClO;
C. 硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O。
7. 【答案】(1)将混合物溶于水,得无色澄清溶液;CuSO4溶液呈蓝色,说明混合物中无CuSO4。Na2CO3、Na2SO4和CaCl2生成沉淀,不能同时存在;
(2)向此溶液中滴加BaCl2溶液,有白色沉淀产生,说明可能含有Na2CO3、Na2SO4,生成的沉淀为硫酸钡、碳酸钡或混合物,则判断一定不含有CaCl2;
(3)过滤后,在白色沉淀中加足量稀HNO3,沉淀完全溶解。证明沉淀是碳酸钡,证明一定含有Na2CO3;一定不含有Na2SO4;硫酸钡不溶于酸;
则原固体中一定含有Na2CO3;一定不含CuSO4;Na2SO4;CaCl2;NaCl不能确定;若想进一步确定可能有的物质是否存在,可以加入硝酸酸化的硝酸银依据生成白色沉淀证明含有氯离子,反应的离子方程式为:Ag++Cl-=AgCl↓;第(3)步操作的离子方程式是硝酸和碳酸钠反应,硝酸溶解碳酸钡沉淀的反应,反应的离子方程式为:2H++CO32-=H2O+CO2↑ BaCO3+2H+=Ba2++CO2↑+H2O;
故答案为:Na2CO3;CuSO4、Na2SO4、CaCl2;NaCl;硝酸酸化的硝酸银;Ag++Cl-=AgCl↓;2H++CO32-=H2O+CO2↑、BaCO3+2H+=Ba2++CO2↑+H2O。
重难点
题型
分值
重点
能运用书写规则书写常见反应的离子方程式;或结合具体反应对所给离子方程式进行正误判断。了解离子反应的概念,了解离子反应发生的条件,并会判断离子在溶液中能否大量共存。
选择
填空
6-10分
难点
离子方程式进行正误判断,判断离子在溶液中能否大量共存。
高中人教版 (2019)第二节 离子反应导学案及答案: 这是一份高中人教版 (2019)第二节 离子反应导学案及答案,共5页。学案主要包含了电解质的电离,离子反应等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时导学案及答案: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时导学案及答案,共8页。
高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时导学案: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时导学案,共12页。