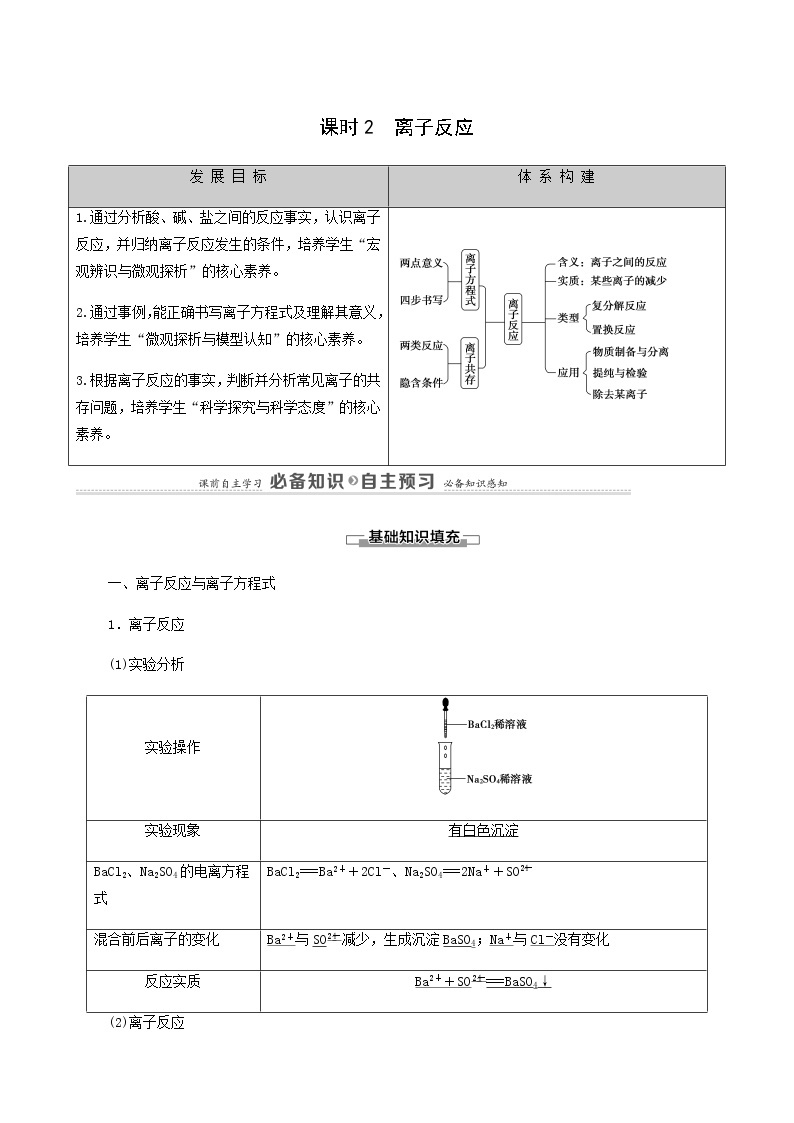

高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应学案
展开一、离子反应与离子方程式
1.离子反应
(1)实验分析
(2)离子反应
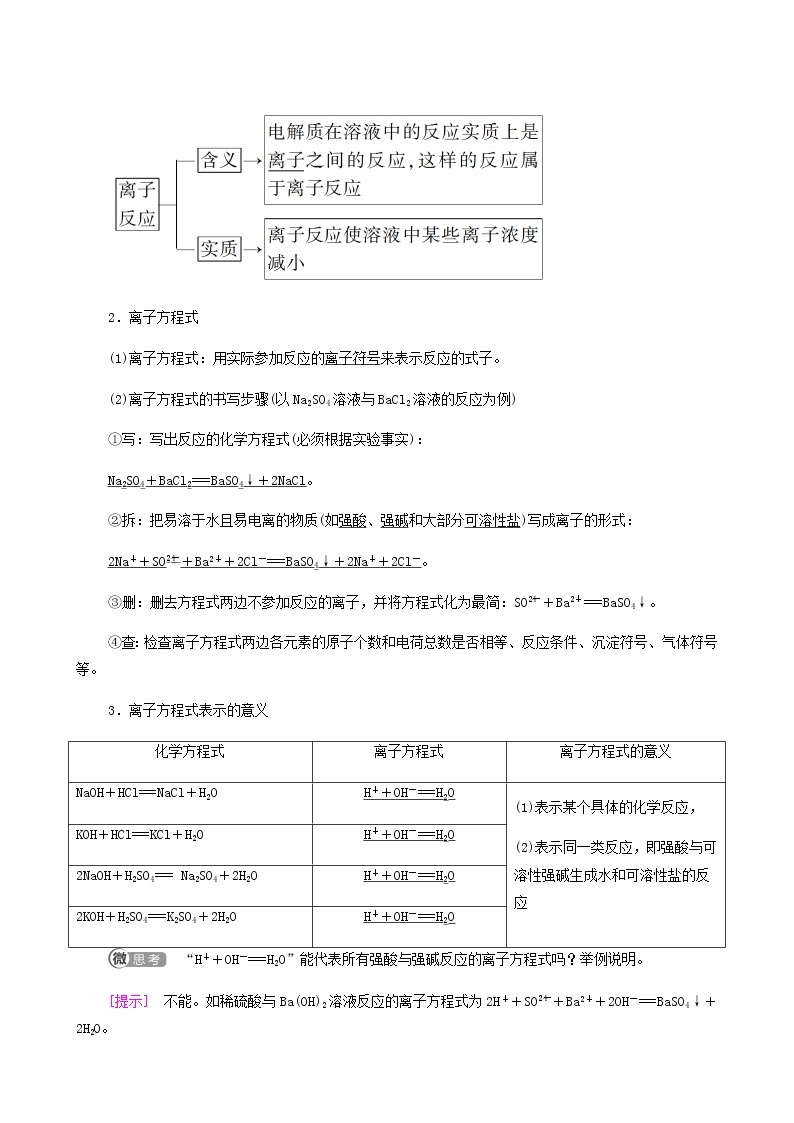
2.离子方程式
(1)离子方程式:用实际参加反应的离子符号来表示反应的式子。
(2)离子方程式的书写步骤(以Na2SO4溶液与BaCl2溶液的反应为例)
①写:写出反应的化学方程式(必须根据实验事实):
Na2SO4+BaCl2===BaSO4↓+2NaCl。
②拆:把易溶于水且易电离的物质(如强酸、强碱和大部分可溶性盐)写成离子的形式:
2Na++SOeq \\al(2-,4)+Ba2++2Cl-===BaSO4↓+2Na++2Cl-。
③删:删去方程式两边不参加反应的离子,并将方程式化为最简:SOeq \\al(2-,4)+Ba2+===BaSO4↓。
④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等、反应条件、沉淀符号、气体符号等。
3.离子方程式表示的意义
“H++OH-===H2O”能代表所有强酸与强碱反应的离子方程式吗?举例说明。
[提示] 不能。如稀硫酸与Ba(OH)2溶液反应的离子方程式为2H++SOeq \\al(2-,4)+Ba2++2OH-===BaSO4↓+2H2O。
二、离子反应发生的条件
1.溶液中复分解反应的条件
2.其他离子反应如溶液中的置换反应,如Fe与CuSO4溶液反应的离子方程式为Fe+Cu2+===Cu+Fe2+。
微点拨:难电离物质除了水外,还有弱酸(CH3COOH、HF、H2CO3、HClO等)和弱碱(NH3·H2O等)。
1.判断正误(正确的打“√”,错误的打“×”)
(1)离子反应中参加反应的全是离子。( )
(2)NaCl溶液与AgNO3溶液反应的实质是Ag++Cl-===AgCl↓。( )
(3)CaCO3与HCl溶液反应的离子方程式为COeq \\al(2-,3)+2H+===H2O+CO2↑。( )
(4)Cu(OH)2溶于盐酸的离子方程式为OH-+H+===H2O。( )
[答案] (1)× (2)√ (3)× (4)×
2.下列化学方程式中,不可以用H++OH-===H2O表示的是( )
A.2NaOH+H2SO4===Na2SO4+2H2O
B.Ba(OH)2+2HCl===BaCl2+2H2O
C.Cu(OH)2+2HNO3===Cu(NO3)2+2H2O
D.KOH+HCl===KCl+H2O
C [H++OH-===H2O代表强酸和可溶性强碱反应生成可溶性盐和H2O的反应,A、B、D均符合;而C项中Cu(OH)2为难溶性弱碱,应写成Cu(OH)2形式。 ]
3.将下列反应改为离子方程式或化学方程式
(1)BaCO3+2HNO3===Ba(NO3)2+CO2↑+H2O
_____________________________________________________。
(2)COeq \\al(2-,3)+2H+===CO2↑+H2O
_____________________________________________________。
(3)Zn+2H+===Zn2++H2↑
_____________________________________________________。
[答案] (1)BaCO3+2H+===Ba2++CO2↑+H2O
(2)Na2CO3+2HCl===2NaCl+CO2↑+H2O(合理即可)
(3)Zn+H2SO4===ZnSO4+H2↑(合理即可)
1.写出下列反应的离子方程式
(1)CuO溶于稀硫酸中
(2)KOH溶液与稀硫酸混合
(3)氨水与稀盐酸混合
(4)石灰水中充入少量CO2
(5)石灰水中充入过量CO2
(6)Na2CO3溶液与石灰水混合
(7)CH3COONa溶液与稀盐酸混合
(8)Zn与CuSO4溶液反应
[答案] (1)CuO+2H+===Cu2++H2O
(2)OH-+H+===H2O
(3)NH3·H2O+H+===NHeq \\al(+,4)+H2O
(4)Ca2++2OH-+CO2===CaCO3↓+H2O
(5)OH-+CO2===HCOeq \\al(-,3)
(6)COeq \\al(2-,3)+Ca2+===CaCO3↓
(7)CH3COO-+H+===CH3COOH
(8)Zn+Cu2+===Cu+Zn2+
2.判断下列离子方程式的正误(正确的打“√”,错误的打“×”)
(1)Fe和稀盐酸反应:Fe+2H+===Fe2++H2↑。( )
(2)FeCl2溶液与Cl2反应:Fe2++Cl2===Fe3++2Cl-。( )
(3)Fe与FeCl3溶液反应:Fe+Fe3+===2Fe2+。( )
(4)Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++HCOeq \\al(-,3)+OH===CaCO3↓+H2O。( )
(5)向NaHSO4溶液中滴入Ba(OH)2溶液至中性:HSOeq \\al(-,4)+Ba2++OH-===BaSO4↓+H2O。( )
[答案] (1)√ (2)× (3)× (4)√ (5)×
1.书写离子方程式的关键——“拆分”
(1)能拆写成离子的物质
(2)不能拆写成离子的物质
(3)特殊物质的拆与不拆
①微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式。微溶物作为生成物,一般写化学式(标“↓”),如石灰水和石灰乳:石灰水写成离子形式,而石灰乳则写化学式。
②三大强酸中浓硫酸不拆,浓盐酸和浓硝酸应拆。
③氨水作反应物可写作NH3·H2O;作生成物,若有加热条件或浓度很大时,可写作NH3(标“↑”)。
④多元弱酸的酸式酸根离子,在离子方程式中不能拆开写,如NaHCO3与盐酸反应的离子方程式为HCOeq \\al(-,3)+H+===CO2↑+H2O。
⑤既不是水溶液中反应也不是熔融状态下反应,不能写离子方程式
提醒:熟记可拆的强酸、强碱和易溶盐的口诀
钾钠铵盐硝酸盐,都能溶于水中间;
氯化物除银亚汞,硫酸不溶铅与钡;
碳酸磷酸亚硫酸,可溶只有钾钠铵;
易溶钾钠铵钡碱,不溶的酸是硅酸。
2.离子方程式正误的判断方法
(1)看离子反应是否符合客观事实。如铁与稀硫酸反应生成Fe2+而不生成Fe3+。
(2)物质的拆写是否正确。
(3)看电荷是否守恒。如FeCl2溶液与Cl2反应,不能写成Fe2++Cl2===Fe3++2Cl-,而应写成2Fe2++Cl2===2Fe3++2Cl-。
(4)看是否漏写离子反应。如Ba(OH)2溶液与CuSO4溶液反应,既要写Ba2+与SOeq \\al(2-,4)反应生成BaSO4沉淀的离子反应,又不能漏写Cu2+与OH-反应生成Cu(OH)2沉淀的离子反应。
(5)看反应物或产物的配比是否正确。如稀硫酸与Ba(OH)2溶液反应不能写成H++OH-+SOeq \\al(2-,4)+Ba2+===BaSO4↓+H2O,而应写成2H++2OH-+SOeq \\al(2-,4)+Ba2+===BaSO4↓+2H2O。
(6)当多元弱酸与碱反应,若酸过量,生成酸式盐,反之,生成正盐。如石灰水通入过量CO2,生成可溶性Ca(HCO3)2,离子方程式应为OH-+CO2===HCOeq \\al(-,3)。
【典例】 下列离子方程式正确的是( )
A.石灰石与盐酸反应:COeq \\al(2-,3)+2H+===CO2↑+H2O
B.铜和硝酸银溶液反应:Cu+Ag+===Cu2++Ag
C.向Ba(OH)2溶液中逐滴滴加NaHSO4溶液至SOeq \\al(2-,4)恰好沉淀完全:Ba2++2OH-+2H++SOeq \\al(2-,4)===BaSO4↓+2H2O
D.NH4HCO3溶液与过量稀盐酸混合:HCOeq \\al(-,3)+H+===CO2↑+H2O
D [石灰石难溶于水,不能拆成离子形式,A不正确;该离子方程式没有配平,电荷不守恒,B不正确;根据题意可知NaHSO4是少量的,则沉淀1个SOeq \\al(2-,4)只要1个Ba2+,同时中和1个H+只要1个OH-,故向Ba(OH)2溶液中滴加NaHSO4溶液至SOeq \\al(2-,4)恰好沉淀完全的离子方程式为Ba2++OH-+H++SOeq \\al(2-,4)===BaSO4↓+H2O,C不正确;NH4HCO3溶液与过量稀盐酸反应的离子方程式为HCOeq \\al(-,3)+H+===CO2↑+H2O,D正确。]
[借题发挥]
(1)向Ba(OH)2溶液中加入过量NaHSO4溶液反应的离子方程式为_____________________________________________________。
(2)向NH4HCO3溶液中加入过量NaOH溶液反应的离子方程式为_____________________________________________________。
[答案] (1)Ba2++2OH-+2H++SOeq \\al(2-,4)===BaSO4↓+2H2O
(2)NHeq \\al(+,4)+HCOeq \\al(-,3)+2OH-===COeq \\al(2-,3)+NH3·H2O+H2O
酸式盐与碱反应的离子方程式书写方法——设“1”法
(1)设定少量物质的个数为“1”;
(2)过量物质的反应离子个数根据反应书写;
(3)根据定量写出产物及其个数然后配平。
如:NaHCO3与少量Ca(OH)2溶液反应,设Ca(OH)2为“1”
即:eq \f(Ca2++2OH-,“1”)+2HCOeq \\al(-,3)===CaCO3↓+2H2O+COeq \\al(2-,3)
1.能正确表示下列化学反应的离子方程式的是( )
A.向ZnCl2溶液中加入Fe粉:Fe+Zn2+===Fe2++Zn
B.向硫酸溶液中加入Cu(OH)2固体:OH-+H+===H2O
C.向碳酸氢钠溶液中加入稀盐酸:COeq \\al(2-,3)+2H+===CO2↑+H2O
D.向氯化钾溶液中滴加硝酸银溶液:Cl-+Ag+===AgCl↓
D [A项不符合化学事实,错误;B项Cu(OH)2为难溶性固体,不能拆分成离子形式,错误;C项NaHCO3应拆分为HCOeq \\al(-,3),错误;D项正确。]
2.(双选)下列离子方程式书写正确的是( )
A.Fe和盐酸反应:2Fe+6H+===2Fe3++3H2↑
B.MgCO3与稀硫酸反应:MgCO3+2H+===Mg2++H2O+CO2↑
C.往澄清石灰水中通入过量CO2气体:CO2+OH-===HCOeq \\al(-,3)
D.向H2SO4溶液中加入Ba(OH)2溶液至中性:H++SOeq \\al(2-,4)+Ba2++OH-===BaSO4↓+H2O
BC [Fe和盐酸反应生成FeCl2和H2,离子方程式为Fe+2H+===Fe2++H2↑,A项错误;MgCO3微溶于水,不能拆写成离子形式,B项正确;往澄清石灰水中通入过量CO2气体,离子方程式为CO2+OH-===HCOeq \\al(-,3),C项正确;向H2SO4溶液中加入Ba(OH)2溶液至中性,二者恰好完全反应,离子方程式为2H++SOeq \\al(2-,4)+Ba2++2OH-===BaSO4↓+2H2O,D项错误。]
3.下列各组内的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与足量硝酸溶液;CaCO3与硝酸溶液
D.石灰石与硝酸;石灰石与盐酸
D [A错,盐酸用H+表示,碳酸用H2CO3表示。B错,前者离子方程式为Ba2++SOeq \\al(2-,4)===BaSO4↓,后者离子方程式为2H++SOeq \\al(2-,4)+Ba2++2OH-===BaSO4↓+2H2O。C错,Na2CO3溶液用COeq \\al(2-,3)表示,CaCO3用CaCO3表示。D对,硝酸和盐酸均用H+表示,离子方程式为CaCO3+2H+===Ca2++CO2↑+H2O。]
4.写出下列反应的离子方程式。
(1)向Ca(HCO3)2溶液中加入足量NaOH溶液__________________________________________________________。
(2)向NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性
_____________________________________________________。
(3)向NaOH溶液中充入过量CO2______________________。
[答案] (1)Ca2++2HCOeq \\al(-,3)+2OH-===CaCO3↓+COeq \\al(2-,3)+2H2O
(2)2H++2OH-+Ba2++SOeq \\al(2-,4)===BaSO4↓+2H2O
(3)OH-+CO2===HCOeq \\al(-,3)
素材1 胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3)能治疗胃酸过多;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含氢氧化铝的胃药(如胃舒平)。
问题探究:(1)NaHCO3能治疗胃酸过多的原理(离子方程式表示)是什么?为什么胃溃疡病人不能服用?
(2)胃舒平治疗胃酸过多的原理是什么(用离子方程式表示)?
(3)NaOH能否治疗胃酸?为什么?
[答案] (1)HCOeq \\al(-,3)+H+===CO2↑+H2O。生成CO2气体易造成胃溃疡病人胃穿孔。
(2)Al(OH)3+3H+===Al3++3H2O。
(3)不能,NaOH具有强腐蚀性,与水作用放出大量热。
素材2 波尔多液是法国植物学家米拉德无意中发现的。1878年,名为“霉叶病”的植物病害狂扫波尔多城,许多葡萄园很快变得枝叶凋零。米拉德发现公路旁的葡萄树郁郁葱葱,经打听,才知是园主为防馋嘴的过路人偷吃而洒的“毒药”,由熟石灰与硫酸铜溶液混合配制而成。于是米拉德经过不断努力,成功制成了波尔多液。
无水硫酸铜为白色晶体,胆矾(CuSO4·5H2O)为蓝色晶体,硫酸铜溶液是蓝色溶液,向硫酸铜溶液中加入BaCl2溶液,有白色沉淀生成。
问题探究:(1)写出制备波尔多液的化学反应方程式。
(2)配制波尔多液能否用铁桶?为什么?
(3)写出CuSO4溶液中加BaCl2的离子方程式。
[答案] (1)CuSO4+Ca(OH)2===CaSO4+Cu(OH)2。
(2)不能,因为Fe与CuSO4反应Fe+CuSO4===FeSO4+Cu。
(3)SOeq \\al(2-,4)+Ba2+===BaSO4↓。
通过素材1、素材2中反应及应用,使学生体验“变化观念、科学探究与社会责任”的核心素养。
1.下列各组物质间的反应中,不属于离子反应的是( )
A.Zn和H2SO4(稀)反应
B.NaCl溶液和AgNO3溶液反应
C.CaCO3高温分解
D.氨水与FeCl3溶液反应
[答案] C
2.BaCO3与稀硝酸反应,正确的离子方程式是( )
A.Ba2++COeq \\al(2-,3)+2H++2NOeq \\al(-,3)===Ba(NO3)2+H2O+CO2↑
B.BaCO3+2H++2NOeq \\al(-,3)===Ba(NO3)2+H2O+CO2↑
C.BaCO3+2H+===Ba2++H2O+CO2↑
D.COeq \\al(2-,3)+2H+===H2O+CO2↑
C [二者反应的化学方程式是BaCO3+2HNO3===Ba(NO3)2+H2O+CO2↑,其中碳酸钡难溶于水,硝酸、硝酸钡都是易溶且易电离的物质,故应拆成离子形式。]
3.下列反应的离子方程式书写正确的是( )
A.氯化铜溶液与铁粉反应:Cu2++Fe===Fe2++Cu
B.稀硫酸与铁粉反应:2Fe+6H+===2Fe3++3H2↑
C.氢氧化钡溶液与稀硫酸反应:Ba2++SOeq \\al(2-,4)===BaSO4↓
D.碳酸钙与盐酸反应:COeq \\al(2-,3)+2H+===H2O+CO2↑
A [B错,不符合反应事实,H2SO4(稀)+Fe===FeSO4+H2↑,应为Fe+2H+===Fe2++H2↑。
C错,漏掉了2H++2OH-===2H2O,应为2OH-+Ba2++SOeq \\al(2-,4)+2H+===2H2O+BaSO4↓。
D错,碳酸钙难溶于水,应为CaCO3+2H+===H2O+CO2↑+Ca2+。]
4.下列反应可以用同一离子方程式表示的是( )
A.HCl溶液+Na2CO3溶液,HCl溶液+NaHCO3溶液
B.NaOH溶液+HCl溶液,Ba(OH)2溶液+H2SO4溶液
C.BaCl2溶液+H2SO4溶液,Ba(OH)2溶液+Na2SO4溶液
D.CaCO3+HCl溶液,Na2CO3溶液+H2SO4溶液
C [A项,第1组反应为2H++COeq \\al(2-,3)===CO2↑+H2O,第2组反应为H++HCOeq \\al(-,3)===CO2↑+H2O,两者不同;B项,第1组反应为H++OH-===H2O,第2组反应为Ba2++2OH-+2H++SOeq \\al(2-,4)===BaSO4↓+2H2O,两者不同;C项,两组反应均为Ba2++SOeq \\al(2-,4)===BaSO4↓;D项,第1组反应为CaCO3+2H+===Ca2++CO2↑+H2O,第2组反应为COeq \\al(2-,3)+2H+===CO2↑+H2O,两者不同。]
5.(素养题)2019年3月21日,宁波市首家也是目前唯一一家“准四类水”污水处理厂——宁波市供排水集团新周污水处理厂开始出水。污水处理厂往往会给人一种污水横流、空气中飘满臭味印象,但新周污水处理厂非常清新、洁净、优雅,是一座花园式工厂。
某河道两旁有甲、乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NOeq \\al(-,3)六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________________。
(2)乙厂的废水中含有另外三种离子。如果加一定量的物质A可以回收乙厂其中的某种金属B,A、B分别是____________________。
(3)在污水处理厂某技术人员提出了另一种设想是将甲厂和乙厂的废水按适当的比例混合,经过滤后的废水,可用来浇灌农田。你能解释其中的原因吗?____________________________________。
[解析] (1)甲厂废水呈碱性,则溶液中含有大量的OH-,与OH-反应的Ag+、Fe3+不能大量共存,根据溶液呈电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl-、OH-不能共存,所以根据溶液电中性可知乙厂还有NOeq \\al(-,3),由此可知:甲厂含有K+、Cl-、OH-,乙厂含有Ag+、Fe3+、NOeq \\al(-,3)。
(2)乙厂含有的金属离子有Ag+、Fe3+,加入单质Fe,可置换出Ag。
(3)将甲厂和乙厂的废水按适当的比例混合,可生成AgCl、Fe(OH)3沉淀,生成沉淀的离子有Ag+、Fe3+、Cl-、OH-,经过滤后的废水中溶质主要为KNO3。
[答案] (1)OH-、Cl-、K+ (2)A为铁粉、B为Ag
(3)将甲厂和乙厂的废水按适当的比例混合,可生成AgCl、Fe(OH)3沉淀,经过滤后的废水中溶质主要为KNO3,可作为钾肥浇灌农田
发 展 目 标
体 系 构 建
1.通过分析酸、碱、盐之间的反应事实,认识离子反应,并归纳离子反应发生的条件,培养学生“宏观辨识与微观探析”的核心素养。
2.通过事例,能正确书写离子方程式及理解其意义,培养学生“微观探析与模型认知”的核心素养。
3.根据离子反应的事实,判断并分析常见离子的共存问题,培养学生“科学探究与科学态度”的核心素养。
实验操作
实验现象
有白色沉淀
BaCl2、Na2SO4的电离方程式
BaCl2===Ba2++2Cl-、Na2SO4===2Na++SOeq \\al(2-,4)
混合前后离子的变化
Ba2+与SOeq \\al(2-,4)减少,生成沉淀BaSO4;Na+与Cl-没有变化
反应实质
Ba2++SOeq \\al(2-,4)===BaSO4↓
化学方程式
离子方程式
离子方程式的意义
NaOH+HCl===NaCl+H2O
H++OH-===H2O
(1)表示某个具体的化学反应,
(2)表示同一类反应,即强酸与可溶性强碱生成水和可溶性盐的反应
KOH+HCl===KCl+H2O
H++OH-===H2O
2NaOH+H2SO4=== Na2SO4+2H2O
H++OH-===H2O
2KOH+H2SO4===K2SO4+2H2O
H++OH-===H2O
离子方程式的书写及其正误的判断方法
人教版 (2019)必修 第一册第二节 离子反应第2课时学案及答案: 这是一份人教版 (2019)必修 第一册第二节 离子反应第2课时学案及答案,共12页。学案主要包含了离子反应,离子方程式,离子反应的类型及发生反应的条件等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三节 氧化还原反应学案设计: 这是一份人教版 (2019)必修 第一册第三节 氧化还原反应学案设计,共15页。学案主要包含了氧化剂和还原剂,氧化还原反应对生产等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应导学案: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应导学案,共11页。学案主要包含了电解质,电解质的电离等内容,欢迎下载使用。













