
- 必修1 第一章 第二节 离子反应(1)同步练习 学案 19 次下载
- 必修1 第一章 第二节 离子反应(2) 学案 学案 26 次下载
- 必修1 第一章 第二节 离子反应(2)同步练习 学案 20 次下载
- 必修1 第一章 第三节 氧化还原反应(1)同步练习 学案 15 次下载
- 必修1 第一章 第三节 氧化还原反应(1) 学案 学案 27 次下载
高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应精品导学案
展开核心知识点一:
一、电解质与非电解质
注意:
(1)电解质、非电解质均应是化合物。金属属于单质,故既不是电解质,也不是非电解质。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质应是一定条件下本身电离而导电的化合物;CO2、SO2、SO3、NH3溶于水后也导电,却是与水反应生成新物质后电离而导电的,不是本身电离导电的,故属于非电解质。
(4)能导电的物质并不一定是电解质,如铜、铝、石墨能导电,但因其为单质,故不属于电解质(也不属于非电解质);食盐水能导电,但其为混合物,不属于电解质。溶于水不能导电的物质可能是电解质,如BaSO4难溶于水,但其溶于水的部分是完全电离的,属于电解质。
核心知识点二:
二、强电解质与弱电解质的比较
强电解质与弱电解质
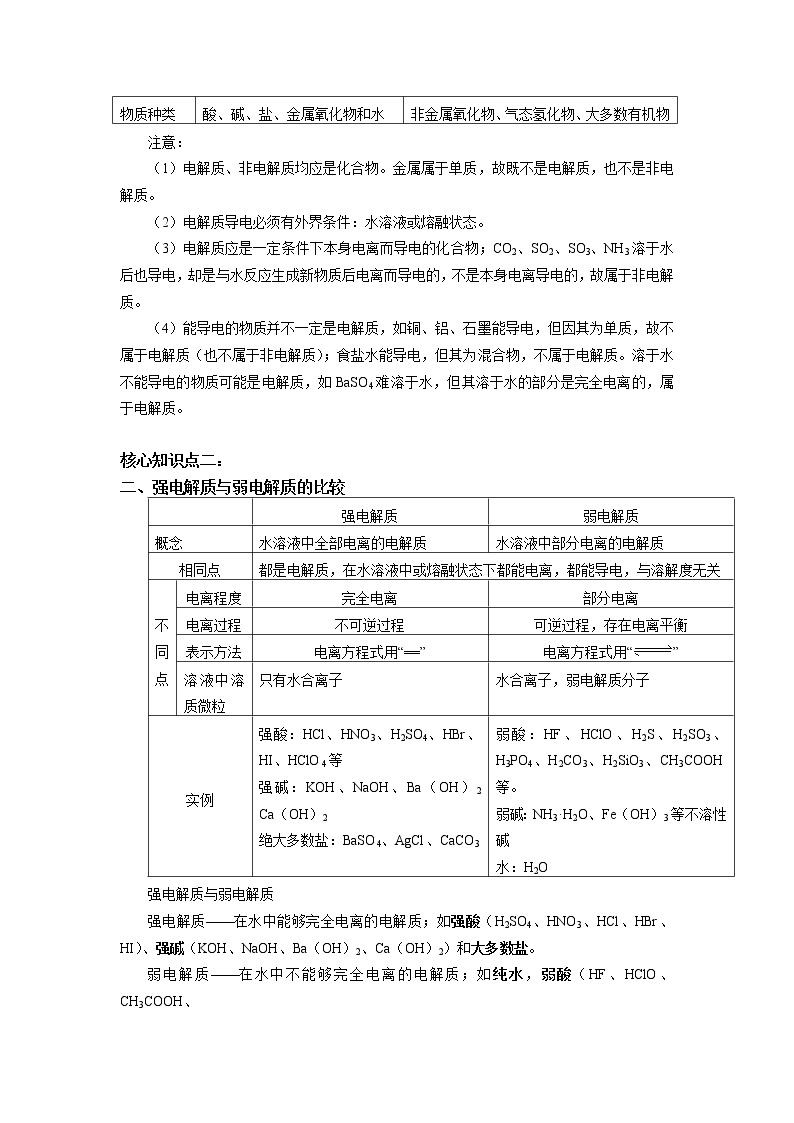
强电解质——在水中能够完全电离的电解质;如强酸(H2SO4、HNO3、HCl、HBr、HI)、强碱(KOH、NaOH、Ba(OH)2、Ca(OH)2)和大多数盐。
弱电解质——在水中不能够完全电离的电解质;如纯水,弱酸(HF、HClO、CH3COOH、
H2SO3、H2CO3、H2SiO4,H3PO4)、弱碱(NH3·H2O、Fe(OH)3、Mg(OH)2等)、个别盐(醋酸铅)
三、电离
1. 溶液的导电性
溶液导电是有条件的:有自由移动的电子或者阴阳离子;而电解质水溶液里或熔融状态下一般可产生自由移动的阴阳离子。
强碱和盐等离子化合物在固态时,固体内虽然存在阴、阳离子,但是不能自由移动,所以不能导电;在熔融状态或水溶液里能电离出自由移动的离子,故能导电。酸在固态或液态(熔融状态)时只有分子,没有自由移动的离子,因而也不导电,如液态HCl、H2SO4等不能导电;但是在水溶液里受水分子的作用,电离产生自由移动的离子,因而能够导电。
电解质溶液的导电能力影响因素:
①溶液中离子浓度
②离子所带电荷多少。即离子浓度越大,离子所带电荷越多,溶液导电能力越强。所以,溶液导电能力的强弱与该溶液是强电解质溶液还是弱电解质溶液无关,即盐酸溶液的导电性不一定比醋酸溶液强。
注意
电解质的强弱是以电离的程度来区分的,与物质的溶解度、溶液的导电能力没有必然联系。
①BaSO4、CaCO3等虽然在水中溶解度很小,溶液的导电性很差,但是由于都是离子化合物,溶于水的部分是全部电离的,是强电解质。
②浓氨水的导电性比极稀NaOH溶液强,但NH3·H2O属于弱电解质。
2. 电离
(1)电离:物质溶于水或者受热融化时,离解成自由移动的离子的过程
(2)电离方程式的书写方法:
①要求左边书写电解质的化学式,右边写电解质电离出的离子的化学式,不同离子间用加号相连。强电解质用“==”,弱电解质用“”。
如:H2SO4==2H++SO42- ;NaHSO4==Na++H++SO42—;Ca(HCO3)2==Ca2++2HCO3—
CH3COOHCH3COO- + H+ ;NH3·H2ONH4+ +OH- ; H2OH+ + OH-
②电离过程中,元素或原子团的化合价不变。离子所带电荷数等于它在化合物中显示的化合价。
③检查电离方程式书写是否正确时,不仅要检查质量是否守恒(即电离前后原子的种类是否相同和个数是否相等),而且要检查电荷是否守恒(即电离后的阴、阳离子所带负、正电荷总数是否相等)。
④多元弱酸分步电离,且第一步电离程度远远大于第二步,如碳酸电离方程式:
H2CO3H++HCO3―;HCO3―H++CO32―
⑤多元弱碱电离方程式一步写出,如氢氧化铁电离方程式:Fe(OH)3Fe3++3OH―
3.酸、碱、盐的定义
(1)酸:电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
HCl = H+ + Cl- H2SO4 = 2H+ + SO42- HNO3=H+ + NO3-
(2)碱:电离时生成的阴离子全部是氢氧根离子的的化合物叫做碱。
NaOH = Na+ + OH- Ba(OH)2 = Ba2++2OH- KOH = K+ + OH-
(3)电离时生成金属阳离子(或铵根离子)和酸根阴离子的化合物叫做盐。
NH4NO3 = NH4+ + NO3- MgCl2 = Mg2+ + 2Cl- Fe2(SO4)3 = 2Fe3+ + 3SO42-
核心知识点一:
下列物质中①NaCl溶液、②NaOH、③H2SO4、④Cu、⑤CH3COOH、⑥NH3·H2O、⑦CO2、⑧乙醇、⑨水,____________是电解质;__________是非电解质;____________既不是电解质,也不是非电解质。
【考点】本题考查基本概念的记忆与理解,电解质指的是在水溶液中或熔化状态下能够导电的化合物;而非电解质指的是在水溶液和熔化状态下都不能导电的化合物。
【答案】②③⑤⑥⑨;⑦⑧;①④
【解析】首先判断是否是化合物,然后判断水溶液中或熔化状态下能否导电,是化合物的有②③⑤⑥⑦⑧ ⑨,而NaCl溶液是混合物,是电解质溶液,不是电解质。
【总结】一种物质是电解质还是非电解质,前提首先应该是化合物。只要在水溶液中、熔化状态下任一条件导电,就是电解质,比如某些共价化合物熔化状态下都不导电,但溶于水可以导电,所以就是电解质;水溶液中、熔化状态下都不导电才是非电解质。
下列各组按强电解质、弱电解质、非电解质排序的是是( )
A. Fe、CH3COOH、C12H22O11(蔗糖)
B. NaCl、NH3、BaSO4
C. CaCO3、H3PO4、C2H5OH
D. HNO3、Fe(OH)3、H2O
【考点】考查强电解质、弱电解质、非电解质的定义及区别。
【答案】C
【解析】
A. Fe是单质不是强电解质
B. BaSO4是强电解质
D. H2O是弱电解质
核心知识点二:
写出下列物质的电离方程式:
H3PO4
Ba(OH)2
NH3·H2O
CaCO3
【考点】考查电解质在溶液中如何进行电离
【答案】H3PO4H+ H2PO4—
H2PO4—H+ HPO42—
HPO42—H+ PO43—
Ba(OH)2 = Ba2++2OH-
NH3·H2ONH4+ +OH-
CaCO3==Ca2++CO32—
【解析】H3PO4为弱电解质,需要分步电离。Ba(OH)2是强碱,NH3·H2O是弱碱。
下列电解质在水中的电离方程式书写错误的是( )
A. NaHCO3==Na++H++CO3-
B. NaHSO4==Na++H++SO42-
C. MgCl2==Mg++Cl2-
D. Ba(OH)2==Ba2++2OH-
【考点】考查电解质在溶液中如何进行电离
【答案】AC
【解析】HCO3-为弱酸根离子,在溶液中只有很少一部分发生电离,不能拆成H+与CO32-,应写为NaHCO3== Na++HCO3-,A错。NaHSO4中的HSO4-在水溶液中能够完全电离成H+与SO42-,B正确。MgCl2电离应写为MgCl2 ==Mg2++2Cl-,C错。Ba(OH)2是强碱,D正确。
【总结】NaHSO4在水溶液中能完全电离出钠离子、氢离子和氯酸根离子,电离方程式为:NaHSO4Na++H++SO42-。NaHSO4若在受热熔化时只能电离出钠离子和硫酸氢根离子,无H+生成,故其在受热熔化时的电离方程式为:NaHSO4Na+ +HSO4-。
(答题时间:25分钟)
1. 下列叙述正确的是( )
A. 铝易导电,属于电解质
B. NH3溶于水可导电,所以NH3是电解质
C. HCl气体和液体都不导电,但HCl属于电解质
D. NaHSO4溶于水能电离出H+,则NaHSO4属于酸
2. 下面关于电解质的叙述中错误的是( )
A. 在水溶液中或熔融状态下能导电的化合物叫电解质
B. 电解质、非电解质都是对化合物而言,单质不属于此范畴
C. 电解质在水中一定能导电,在水中导电的化合物一定是电解质
D. 纯水的导电性很差,但水也是电解质
3. 下列物质中,属于电解质的是( )
①汞 ②浓氨水 ③氯化钠晶体 ④硝酸 ⑤干冰 ⑥蔗糖 ⑦硫酸
A. ①③④
B. ③④⑦
C. ②③④
D. ⑤⑥
4. 下列各组物质,按电解质、非电解质、既不是电解质也不是非电解质顺序排列的是( )
A. 硝酸钾、硫酸铜、稀硫酸
B. 空气、水、稀硫酸
C. 氯化钠、乙醇、铜
D. 硝酸、食盐水、烧碱
5. 下列物质属于电解质且能导电的是( )
①氯化铜溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融氢氧化钾 ⑥稀硫酸 ⑦酒精
A. ⑤
B. ①②⑥
C. ②⑤⑥⑦
D. ①③④⑤⑥
6. 有关电解质的说法正确的是( )
A. 固体氯化镁不导电,所以氯化镁不是电解质
B. 三氧化硫水溶液的导电性很好,所以三氧化硫是电解质
C. 熔融的铁导电性很好,所以铁是电解质
D. 氯化钾熔融状态能导电,所以氯化钾是电解质
7. 下列说法中,正确的是( )
A. 液态氯化氢、固态氯化钠都不导电,所以氯化氢、氯化钠都是非电解质
B. 氨气、二氧化碳的水溶液都能导电,所以氨气、二氧化碳都是电解质
C. 蔗糖、酒精在水溶液里或熔融状态时都不导电,所以它们是非电解质
D. 铜、石墨都导电,所以它们都是电解质
8. 现有一种固体化合物X不导电,但熔融状态或溶于水导电,下列关于X的说法中,正确的是( )
A. X一定为电解质
B. X可能为非电解质
C. X只能是盐类
D. X只能是碱类
9. 现有下列物质:①液氨,②氯化镁晶体,③液态的醋酸,④汞,⑤碳酸钡固体,⑥矿泉水,⑦酒精(C2H5OH),⑧熔化氢氧化钾,⑨硫酸溶液,⑩干冰。请用序号回答下列问题:
(1)以上物质中能导电的是__________,
(2)以上物质中属于电解质的是__________,
(3)以上物质中属于非电解质的是__________。
1. C 【解析】电解质都是化合物,Al是单质,故它不是电解质,A项错误;NH3溶于水可导电是因为NH3与H2O反应生成的NH3·H2O电离出NH4-和OH-,而NH3分子本身不电离,所以NH3是非电解质,B项错误;HCl的水溶液即盐酸能导电,根据电解质的定义,HCl属于电解质,C项正确;从组成上来看,NaHSO4是盐,D项错误。
2. C 【解析】在水溶液中或熔融状态下能导电的化合物叫电解质,在水溶液中和熔融状态下均不导电的化合物叫非电解质,A、B正确;电解质导电是有条件的,电解质在水中不一定能导电,如硫酸钡,在水中导电的化合物也不一定是电解质,如二氧化碳,C错误;水是电解质,D正确。
3. B 【解析】酸、碱、盐、活泼金属氧化物、水、部分非金属氢化物等是电解质,单质和混合物既不是电解质,也不是非电解质,非金属氧化物、部分非金属氢化物、部分有机物等是非电解质。
4. C 【解析】A项,硫酸铜是电解质;B项,空气是混合物,既不是电解质,也不是非电解质,水是电解质;D项,食盐水是混合物,既不是电解质,也不是非电解质,烧碱是电解质,A、B、D项不符合此排序,C项,氯化钠是电解质,乙醇是非电解质,铜是单质,既不是电解质,也不是非电解质,符合此排序。
5. A 【解析】铜、石墨属于单质,氯化铜溶液、稀硫酸属于混合物,都不属于电解质;酒精为非电解质;氯化铵固体是电解质,但固体中存的离子不能自由移动,不导电。熔融氢氧化钾是电解质,能导电。
6. D 【解析】氯化镁在水溶液中或熔融状态下都能导电,属于电解质;三氧化硫水溶液的导电性很好是因为三氧化硫与水反应生成电解质硫酸,三氧化硫是非电解质;铁是单质,不属于电解质;氯化钾熔融状态能导电,氯化钾属于电解质,D项正确。
7. C 【解析】判断某化合物是否为电解质,应从其水溶液或熔融状态下能否导电判断。
8. A 【解析】因为该化合物在熔融状态或溶于水能导电,该化合物一定是电解质,可以是盐类(如氯化钠),也可以是碱类(如氢氧化钠)等。
9.(1)①③④⑤⑥⑦⑨⑩⑪ (2)①⑤⑦⑨⑩ ②⑧⑫
【解析】(1)金属单质(如④)和部分非金属单质(如⑥)在常温下能导电,其原因是物质中含有自由移动的电子;活泼金属氧化物在熔融状态下能导电,如⑩氧化钠;酸溶于水能导电,如①;水在液态时导电;大多数盐(如⑤)和强碱(如⑦)溶于水或熔融状态下均导电;氨水和盐酸能导电是因为一水合氨和氯化氢在水溶液中发生电离。
(2)电解质与非电解质必须是化合物,单质④、⑥和混合物③、⑪既不是电解质,也不是非电解质;电解质必须符合化合物在一定条件下自身发生电离,②、⑧、⑫自身溶于水或液态时均不电离。高中化学
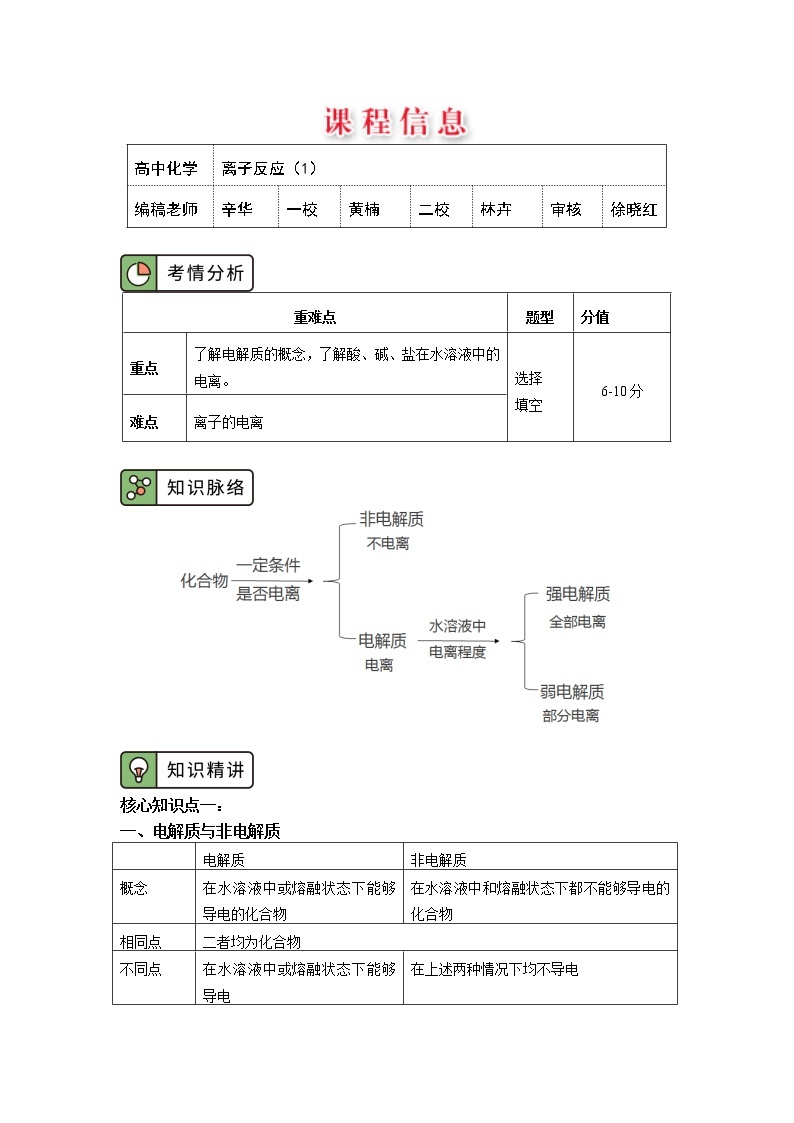
离子反应(1)
编稿老师
辛华
一校
黄楠
二校
林卉
审核
徐晓红
重难点
题型
分值
重点
了解电解质的概念,了解酸、碱、盐在水溶液中的电离。
选择
填空
6-10分
难点
离子的电离
电解质
非电解质
概念
在水溶液中或熔融状态下能够导电的化合物
在水溶液中和熔融状态下都不能够导电的化合物
相同点
二者均为化合物
不同点
在水溶液中或熔融状态下能够导电
在上述两种情况下均不导电
物质种类
酸、碱、盐、金属氧化物和水
非金属氧化物、气态氢化物、大多数有机物
强电解质
弱电解质
概念
水溶液中全部电离的电解质
水溶液中部分电离的电解质
相同点
都是电解质,在水溶液中或熔融状态下都能电离,都能导电,与溶解度无关
不
同
点
电离程度
完全电离
部分电离
电离过程
不可逆过程
可逆过程,存在电离平衡
表示方法
电离方程式用“==”
电离方程式用“”
溶液中溶质微粒
只有水合离子
水合离子,弱电解质分子
实例
强酸:HCl、HNO3、H2SO4、HBr、HI、HClO4等
强碱:KOH、NaOH、Ba(OH)2 Ca(OH)2
绝大多数盐:BaSO4、AgCl、CaCO3
弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3、H2SiO3、CH3COOH等。
弱碱:NH3·H2O、Fe(OH)3等不溶性碱
水:H2O
高中人教版 (2019)第二节 离子反应导学案及答案: 这是一份高中人教版 (2019)第二节 离子反应导学案及答案,共5页。学案主要包含了电解质的电离,离子反应等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时导学案及答案: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时导学案及答案,共8页。
人教版 (2019)必修 第一册第二节 离子反应导学案: 这是一份人教版 (2019)必修 第一册第二节 离子反应导学案,共7页。学案主要包含了离子方程式的正误判断,溶液中离子大量共存的判断,常见离子的检验与推断等内容,欢迎下载使用。













