

必修 第一册第一章 物质及其变化第三节 氧化还原反应学案
展开一、氧化还原反应的认识
1.从得失氧的角度认识氧化还原反应
从得失氧的角度分析以下反应,完成下表。
2CuO+Ceq \(=====,\s\up10(高温))2Cu+CO2↑;Fe2O3+3COeq \(=====,\s\up10(高温))2Fe+3CO2
结论:一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应,氧化反应和还原反应是在一个反应中同时发生的,称为氧化还原反应。
2.从元素化合价升降的角度认识氧化还原反应
(1)对于有氧元素参加的反应2CuO+Ceq \(=====,\s\up10(高温),\s\d10( ))2Cu+CO2↑。
①铜元素化合价降低,CuO发生还原反应。
②碳元素化合价升高,C发生氧化反应。
(2)对于无氧元素参加的反应Fe+CuSO4===FeSO4+Cu。
①铜元素化合价降低,CuSO4发生还原反应。
②铁元素化合价升高,Fe发生氧化反应。
结论:物质所含元素化合价升高的反应是氧化反应;物质所含元素化合价降低的反应是还原反应;凡是有元素化合价升降的反应,都是氧化还原反应。
3.从电子转移的角度认识氧化还原反应
(1)在2Na+Cl2eq \(=====,\s\up10(△),\s\d10( ))2NaCl的反应过程中:
①钠原子失去最外电子层上的1个电子,成为具有稳定结构的Na+,其化合价由0价升高为+1价,Na发生了氧化反应,被氧化。
②氯原子最外层得到1个电子,成为具有稳定结构的Cl-,其化合价由0价降低为-1价,Cl2发生了还原反应,被还原。
③在这个反应中,氯原子和钠原子之间发生了电子的得失,分别形成阴离子和阳离子,使元素的化合价发生了变化。
④反应过程中相应变化关系图
(2)在H2+Cl2eq \(=====,\s\up10(点燃),\s\d10( ))2HCl的反应过程中:
①氢原子和氯原子都不易失去电子,都可获得1个电子形成稳定结构,二者只能形成共用电子对,使双方最外电子层都达到稳定结构。
②共用电子对偏向于吸引力稍强的氯原子,氯元素的化合价由0价降低为-1价,被还原,氯气发生了还原反应。
③共用电子对偏离于吸引力稍弱的氢原子,氢元素的化合价由0价升高到+1价,被氧化,氢气发生了氧化反应。
④反应过程中相应变化关系图
该反应生成的氯化氢分子因共用电子对的偏移,而使元素的化合价发生了变化。
(3)结论:凡是有电子转移(得失或偏移)的反应都是氧化还原反应。失去电子(或电子对偏离)物质发生氧化反应,物质被氧化;得到电子(或电子对偏向)物质发生还原反应,物质被还原。
(4)氧化还原反应的特征与本质
①特征:元素化合价升降。
②本质:电子转移(电子得失或电子对偏移)。
二、氧化还原反应与四种基本反应类型的关系
(1)有单质参加或单质生成的化合反应或分解反应均是氧化还原反应。
(2)所有置换反应都是氧化还原反应。
(3)所有复分解反应都不是氧化还原反应。
1.判断正误(正确的打“√”,错误的打“×”)
(1)氧化还原反应中一定有氧元素参加。( )
(2) 冶炼金属钛(Ti)的第一步反应为TiO2+2C+2Cl2eq \(=====,\s\up10(高温),\s\d10( ))TiCl4+2CO,该反应属于氧化还原反应。( )
(3)有单质参加的反应一定是氧化还原反应。( )
(4)在氧化还原反应中反应物的化合价升高或降低,没有化合价不变的元素。( )
[答案] (1)× (2)√ (3)× (4)×
2.下列反应是氧化还原反应且是置换反应的是( )
A.CO+CuOeq \(=====,\s\up10(△))Cu+CO2
B.2Na2O2+2CO2===2Na2CO3+O2
C.Cl2+H2O===HCl+HClO
D.Br2+2KI===2KBr+I2
[答案] D
3.有反应:Fe2O3+2Aleq \(=====,\s\up10(高温),\s\d10( ))Al2O3+2Fe。
(1)________元素的化合价升高,则该元素的原子_____________电子,被________(填“氧化”或“还原”);而________元素的化合价降低,则该元素的原子________电子,被________________(填“氧化”或“还原”)。
(2)该反应中Fe2O3发生了________反应,Al发生了________反应。
(3)1个Al原子参加反应,转移________个电子。
[答案] (1)Al 失 氧化 Fe 得 还原 (2)还原 氧化 (3)3
高铁酸钠(Na2FeO4)是一种新型净水剂和消毒剂,主要用于饮用水处理。工业上制备高铁酸钠的方法之一为:3NaClO+2Fe(OH)3+4NaOH===2Na2FeO4+3NaCl+5H2O。
请探究下列问题
(1)Na2FeO4中铁元素的化合价是________。
(2)被氧化的元素是________。发生还原反应的物质是________。
(3)被氧化的物质是________。
(4)2个Fe(OH)3反应时,转移的电子数是________个。
[答案] (1)+6价 (2)Fe(或铁元素) NaClO
(3)Fe(OH)3 (4)6
1.氧化还原反应概念间的联系
2.氧化还原反应中的4个“不一定”
(1)一种元素被氧化,不一定有另一种元素被还原。如Ceq \(l,\s\up10(0))2+H2O===Heq \(Cl,\s\up10(-1))+eq \(HClO,\s\up10(+1))中,被氧化和被还原的元素都是氯元素。
(2)一种反应物不一定只表现出一种性质。如反应2KMnO4eq \(=====,\s\up10(△))K2MnO4+MnO2+O2↑中,参加反应的KMnO4既表现了还原性,又表现了氧化性。
(3)有单质参加或生成的反应不一定是氧化还原反应。如同素异形体之间的相互转化不属于氧化还原反应。
(4)某种物质由化合态变为游离态,不一定是被还原,如HCl→Cl2是被氧化。
3.判断元素化合价的常用方法
(1)熟记常见元素的化合价
钠钾氢银正一价,钙镁锌钡正二价。
氟氯溴碘负一价,通常氧是负二价。
铜正一二铝正三,铁有正二和正三。
碳有正二和正四,硫有负二、正四和正六。
(2)计算:依据化合物中元素的正、负化合价的代数和为零进行计算。步骤:
①标出熟悉元素的化合价。
②根据化合物中正、负化合价的代数和为零的原则求解其他元素的化合价。
③有机物中碳元素化合价(设为x)的确定方法:有机物中氧元素的化合价为-2,氢元素的化合价为+1。利用元素化合价代数和为零的原则确定碳元素的化合价。乙酸(C2H4O2)中满足2x+(+1)×4+(-2)×2=0,则x=0。
【典例】 ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A. KClO3在反应中失去电子
B. ClO2是氧化产物
C. H2C2O4在反应中被氧化
D. H2SO4在反应中得到电子被还原
C
[借题发挥]
(1)KClO3发生________反应。
(2)当生成4个CO2分子时,转移电子数为________个。
[答案] (1)还原 (2)4
1.下列变化中,属于还原反应的是( )
A.Cl-―→Cl2 B.FeCl2―→FeCl3
C.C―→CO2D.KMnO4―→MnO2
D [物质发生还原反应时,所含元素的化合价降低,其中Cl-→Cl2,化合价由-1价升高为0价,被氧化;FeCl2→FeCl3,铁元素化合价由+2→+3,发生氧化反应;C→CO2,碳元素化合价由0→+4,发生氧化反应;KMnO4→MnO2,锰元素化合价由+7→+4,发生还原反应。]
2.海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂二氧化硫发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4,下列说法正确的是( )
A.溴发生了还原反应
B.二氧化硫在反应中被还原
C.溴在反应中失去电子
D.该反应既是化合反应又是氧化还原反应
A [该反应为氧化还原反应,溴在反应中得到电子发生还原反应,溴被还原。]
3.(1)A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuOeq \(=====,\s\up10(△))Cu+H2O所属的区域。
A
(2)“四种基本反应类型与氧化还原反应的关系”也可用B图表达。其中Ⅰ为化合反应,则Ⅱ为________反应。写出有水生成的符合反应类型Ⅲ的一个化学方程式:________________________。
B
[解析] (1)H2+CuOeq \(=====,\s\up10(△))Cu+H2O属于置换反应,而置换反应全部属于氧化还原反应。(2)Ⅰ为化合反应,则Ⅱ为分解反应,Ⅲ为复分解反应,Ⅳ为置换反应。中和反应属于复分解反应,且有水生成,如HCl+NaOH===NaCl+H2O。
[答案] (1) (2)分解 NaOH+HCl===NaCl+H2O(或其他合理答案)
1.基本步骤
2.注意事项
(1)箭头、箭尾必须对应化合价变化的同种元素的原子。
(2)必须注明“得到”或“失去”。
(3)被还原的物质和被氧化的物质得到、失去电子数守恒。
4.用双线桥法表示下列反应的电子转移的方向与数目。
(1)2KClO3eq \(=====,\s\up10(MnO2),\s\d10(△))2KCl+3O2↑
(2)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(3)4NH3+5O2eq \(=====,\s\up10(催化剂),\s\d10(△))4NO+6H2O
(4)Cl2+H2O===HCl+HClO
[答案]
素材1 每逢南方的梅雨季节,盒里的饼干就很容易受潮变软,不再酥脆了。有一种食品干燥剂——泡沫铁粉,是铁粉在高温炉里加入发泡剂,使铁粉变成疏松多孔的物质。饼干盒里有了它,铁粉吸收空气中的水分和氧气,自己变为铁锈,但食品的保质期却可以大大延长,味正如初。铁单质是由铁矿石冶炼得到的。
问题探究:(1)铁生锈的过程中,铁发生什么反应?化合价如何变化?
[答案] 氧化反应。化合价由0价升高到+3价。
(2)铁矿石一般用CO还原Fe2O3得到Fe,写出该反应的化学方程式,并用双线桥表示电子转移的方向和数目。若生成一分子CO2,转移电子数为多少?该反应是置换反应吗?
[答案] 。转移电子数为2分子。不是置换反应。
素材2 楼房有的是用红砖砌成的,有的则是青砖砌成的,可曾想过为什么同样的砖坯有的能烧成红砖,有的能烧成青砖呢?原来烧制砖瓦的黏土中含有二价铁盐,黏土做成砖坯,送到窑内大火烘烧,然后熄灭,自然冷却。此时窑内空气流畅,氧气充足,二价铁盐被氧化成三氧化二铁(Fe2O3),由于三氧化二铁是红色,所以得到的就是红砖瓦。待砖坯烧透后,从窑顶向下不断淋水,当水遇到红热砖瓦变成水蒸气后,碳与水蒸气反应生成氢气和一氧化碳。这些还原性气体能把砖瓦中红色的氧化铁还原成黑色氧化亚铁或四氧化三铁。
问题探究:(1)红砖、青砖烧制过程中涉及的反应是氧化还原反应吗?反应本质是什么?
[答案] 是。反应中有电子转移。
(2)红砖转变为青砖(含FeO)的有关化学方程式。有哪些?请写出。
[答案] H2O(g)+Ceq \(=====,\s\up10(高温))H2+CO,
H2+Fe2O3eq \(=====,\s\up10(高温))2FeO+H2O,
CO+Fe2O3eq \(=====,\s\up10(高温))2FeO+CO2。
(3)红砖转化为青砖的过程中,Fe2O3发生什么反应?
[答案] 还原反应。
通过素材1了解铁生锈及泡沫铁粉的抗氧化性,培养学生“变化观念和社会责任”的核心素养;通过素材2了解了生产红砖和青砖的原理,培养学生“科学探究与创新意识”的核心素养。
1.下列关于氧化还原反应的说法中正确的是( )
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+→Fe2+的变化过程一定是氧化反应
D.元素化合价升高的反应是还原反应
A [判断氧化还原反应的概念,关键是要紧紧抓住反应中元素的化合价有无变化。化合价有变化一定是氧化还原反应,但不一定有氧的得失。化合价升高发生的是氧化反应,Fe3+转化为Fe2+,铁元素的化合价降低,发生的是还原反应。]
2.将燃着的镁条伸入盛有二氧化碳的集气瓶中,镁条继续燃烧,反应的化学方程式为CO2+2Mgeq \(=====,\s\up10(点燃),\s\d10( ))C+2MgO,该反应属于( )
①化合反应 ②分解反应 ③置换反应 ④复分解反应 ⑤氧化还原反应 ⑥离子反应 ⑦非氧化还原反应
A.①③⑦ B.②③⑥
C.③⑤ D.④⑥
C [根据置换反应的定义可知该反应属于置换反应,化合价反应前后有变化,也属于氧化还原反应。]
3.(素养题)我国“四大发明”在人类发展史上起到了非常重要的作用。
黑火药爆炸的反应为S+2KNO3+3C===K2S+3CO2↑+N2↑。在该反应中,被还原的元素是( )
A.N B.C
C.N和SD.N和C
C [被还原的元素就是反应过程中化合价降低的元素。]
4.已知某两种物质在一定条件下能发生化学反应,其反应的微观示意图如下。则下列说法正确的是( )
(说明:一种小球代表一种元素的原子)
A.图中的反应物都是化合物
B.该反应属于置换反应
C.该反应属于非氧化还原反应
D.该反应不符合质量守恒定律
B [根据示意图可知该反应为置换反应,属于氧化还原反应,符合质量守恒定律。]
5.实验室制取Cl2的化学方程式为
MnO2+4HCl(浓)eq \(=====,\s\up10(△))MnCl2+Cl2↑+2H2O
请根据上述方程式回答下列问题:
(1)______元素被氧化,发生氧化反应的物质是______。
(2)生成2分子Cl2,转移电子数为________个。
(3)用双线桥法表示电子转移的方向和数目。
[答案] (1)Cl(氯) HCl
(2)4
(3)
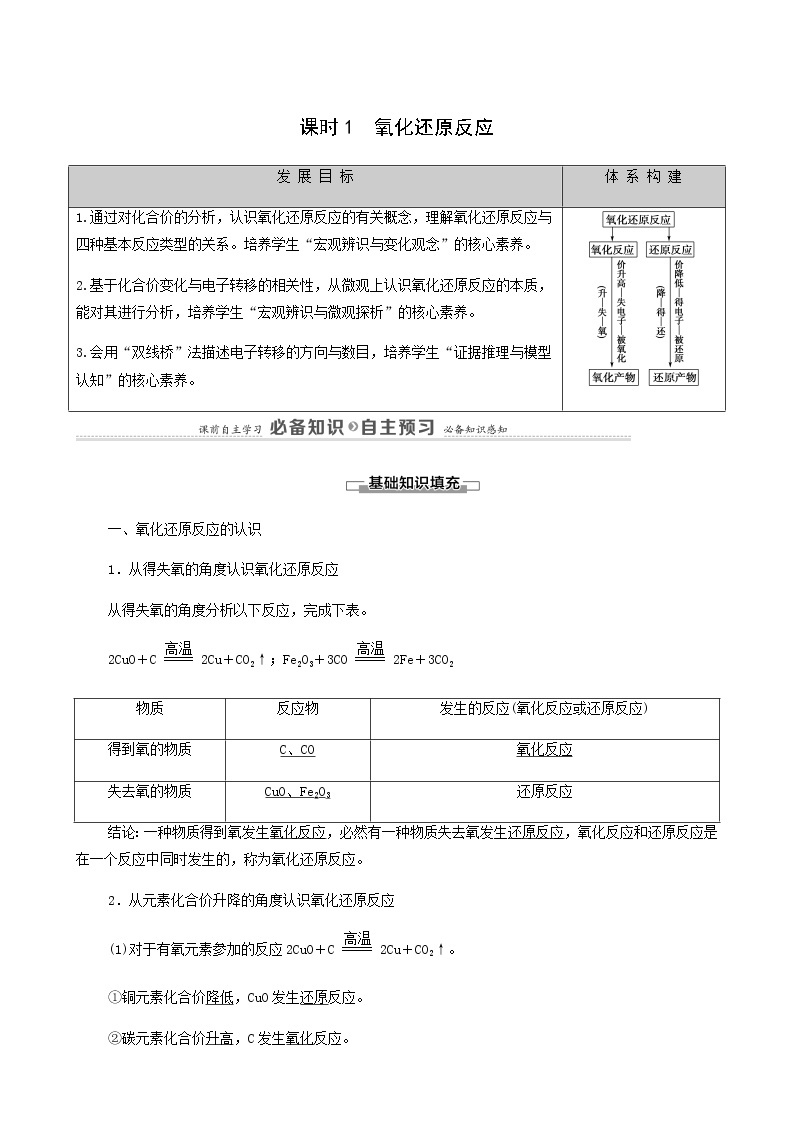
发 展 目 标
体 系 构 建
1.通过对化合价的分析,认识氧化还原反应的有关概念,理解氧化还原反应与四种基本反应类型的关系。培养学生“宏观辨识与变化观念”的核心素养。
2.基于化合价变化与电子转移的相关性,从微观上认识氧化还原反应的本质,能对其进行分析,培养学生“宏观辨识与微观探析”的核心素养。
3.会用“双线桥”法描述电子转移的方向与数目,培养学生“证据推理与模型认知”的核心素养。
物质
反应物
发生的反应(氧化反应或还原反应)
得到氧的物质
C、CO
氧化反应
失去氧的物质
CuO、Fe2O3
还原反应
氧化还原反应的有关概念与联系
双线桥法表示电子转移的方向与数目
人教版高考化学一轮复习第1章物质及其变化第3节第1课时氧化还原反应的概念与规律学案含答案: 这是一份人教版高考化学一轮复习第1章物质及其变化第3节第1课时氧化还原反应的概念与规律学案含答案
人教版 (2019)必修 第一册第三节 氧化还原反应第1课时导学案: 这是一份人教版 (2019)必修 第一册第三节 氧化还原反应第1课时导学案,共13页。学案主要包含了从三个角度分析氧化还原反应,氧化还原反应的概念和实质等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应导学案: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应导学案,共11页。学案主要包含了电解质,电解质的电离等内容,欢迎下载使用。













