






2021学年第二节 离子反应备课课件ppt
展开学习目标:1、掌握离子反应发生的条件。2、掌握离子共存的判断方法并能进行常见离子是否共存的判断。
1、复分解反应的条件:生成气体、生成沉淀、生成弱电解质(弱酸、弱碱、水)2、氧化还原反应
例1、下列可大量共存的离子组是( )A、Mg2+、OH-、NO3-、K+B、Na+、Cl-、H+、CO32- C、 Cl- 、H+ 、OH-、Na- D、Na+、SO42-、K+、NO3-
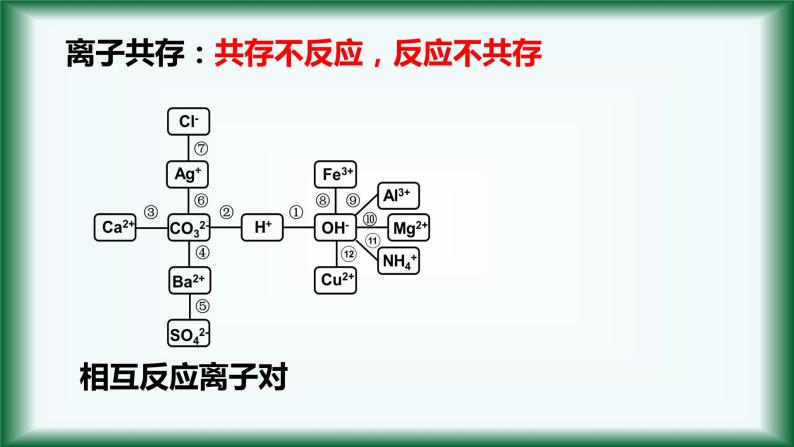
共存不反应,反应不共存
1、会发生离子反应的离子,即符合复分解反应条件的离子不能在溶液中大量共存。
⑴生成难溶物或微溶物:P110
如:Ba2+与CO32-、Ag+与Cl-、 Ca2+与SO42-、Cu2+与OH-等
⑵生成气体或挥发性物质:
如:NH4+与OH-、 H+与CO32-、HCO3-、SO32-、HSO3-等
离子共存:共存不反应,反应不共存
1、下列各组中的离子,能在溶液中大量共存的是( )A、Fe3+、Na+、NO3-、 OH- B、SO42-、Cl-、Ca2+ 、Mg2+C、NH4+、Fe3+、SO42-、NO3- D、Ba2+ 、K+ 、CO32- 、Cl-
2.下列各组离子在水溶液中能大量共存的是 ( )A.Na+、Ba2+、Cl-、SO42-B. Ca2+、HCO3-、Cl-、K+ C.Mg2+、Ag+、NO3-、Cl- D. H+ 、Cl- 、Na+ 、CO32-
⑶生成难电离物质即生成弱电解质:
①H+与OH-不能大量共存。② H+与弱酸根阴离子不能大量共存。如: H+与CO32- , SO32- , CH3COO- ,HCO3 — , HSO3— , F —……③ OH-与弱碱根阳离子不能大量共存。如: OH-与NH4+ , Fe3+ ……注意: HCO3 — 和 HSO3—既不能与H+大量共存,也不能与OH-大量共存。
3.下列各组离子在水溶液中能大量共存的是 ( )A.Na+、 H+ 、Cl-、 OH-B. Ca2+、HCO3-、Cl-、H+ C.Mg2+、NH4+、NO3-、Cl- D. OH- 、Cl- 、Na+ 、 NH4+
4.下列各组离子,既不能与酸又不能与碱共存的是 ( )A.Na+、 Ba2+ 、Cl-、 OH-B. Ca2+、HCO3-、Cl-、K+ C.Cu2+、NH4+、NO3-、Cl- D. SO42- 、Cl- 、Na+ 、 NH4+
(4)注意附加的隐含条件
①溶液无色透明时,则溶液中一定没有有色离子。
常见的有色离子:Cu2+、Fe3+、Fe2+、MnO4-等
注意:透明溶液可以是有颜色。
使酚酞变红、石蕊变蓝或变红等
5、在无色、酸性溶液中能大量共存的是( )A、NH4+、Al3+、SO42-、NO3- B、Ca2+、Na+、NO3- 、CO32- C、K+、Fe3+、NH4+、 NO3- D、Na+、K+、SO32-、NO3-、
6、在碱性溶液中能大量共存且溶液为无色透明的离子组是( ) A、K+ MnO4- Na+ Cl- B、K+ Na+ NO3- CO32- C、Na+ H+ NO3- SO42- D、Fe3+ Na+ Cl- SO42-
7.(双选)在某透明的使石蕊溶液变红的溶液中,能共存的离子组是 ( )A.Na+ 、K+、SO42-、HCO3 B.Cu2+、K+、SO42-、NO3C.Na+、 K+、Cl、 NO3 D.Na+ 、K+、SO42-、OH
8.已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是( )A.CO32-、Cl- B.NO3-、Cl- C.NO3-、SO42- D.OH-、NO3-
⑵生成气体或挥发性物质
小结 离子共存问题
(4)注意附加的隐含条件①溶液无色透明时,则溶液中一定没有有色离子。②强碱性溶液:③强酸性溶液:④指示剂变色如:使酚酞变红、石蕊变蓝或变红等
离子方程式的定量书写
① CO32-+2H+ = CO2↑+H2O
① CO32-+H+ = HCO3-
② HCO3-+H+ = CO2↑+H2O
现象:开始时无明显气体,稍后有大量气体 产生
2、酸式盐与碱的反应涉及到的“量”
方法:按“以少定多”的原则来书写,即以量少的反应物(离子)确定量多离子前面的系数。
(1) Ca(HCO3)2与NaOH
a.往足量碳酸氢钙溶液中加入少量氢氧化钠溶液
b.往足量氢氧化钠溶液中加入少量碳酸氢钙溶液
OH- +HCO3-+Ca2+ = CaCO3↓+H2O
Ca2++2HCO3- +2OH- = CaCO3↓+CO32-+2H2O
(2)NaHCO3与Ca(OH)2
b.往足量澄清石灰水中加入少量碳酸氢钠溶液
Ca2+ +2OH- +2HCO3- = CaCO3↓+CO32-+2H2O
a.往足量碳酸氢钠溶液中加入少量澄清石灰水
HCO3- +Ca2++OH- = CaCO3↓+H2O
(3)KHSO4溶液与Ba(OH)2溶液混合?
a.KHSO4少量时:
SO42-+H++ Ba2++OH- = BaSO4 ↓ +H2O
b.KHSO4过量时:
Ba2++ 2OH- +SO42-+2H+ = BaSO4↓+2H2O
CO2+2OH- = CO32-+H2OCO2+OH- = HCO3-
3、某些物质与CO2反应涉及到的“量”
Ca2+ + 2ClO- + CO2 + H2O = CaCO3 ↓ +2HClO ClO- + CO2 + H2O = HCO3-+ HClO
(2)漂白粉溶液中通入CO2
(1)用NaOH吸收CO2
注意:Ca(OH)2溶液中加入少量的Ca(HCO3)2溶液Ca(OH)2溶液中加入足量的Ca(HCO3)2溶液
(3)NaHSO4溶液与Ba(OH)2溶液混合
Ba(OH)2溶液中加入NaHSO4溶液至中性Ba(OH)2溶液中加入NaHSO4溶液至沉淀完全
SO42-+H++ Ba2++OH- =BaSO4 ↓ +H2O
Ca2+ + OH- + HCO3-= CaCO3↓+ H2O
高中化学人教版 (2019)必修 第一册第二节 离子反应课前预习ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应课前预习ppt课件,共13页。PPT课件主要包含了实验1-3,有白色沉淀产生,Cl-,离子方程式,写出反应的化学方程式,难溶物,弱电解质,氧化物,弱碱水等,NaI2等等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 离子反应精品ppt课件: 这是一份人教版 (2019)必修 第一册第二节 离子反应精品ppt课件,文件包含12离子反应ppt、实验1-2物质的导电性mp4、实验1-3硫酸钠溶液与氯化钡溶液的反应mp4、导课视频手湿不要摸电器水能导电要牢记mp4等4份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
高中化学第二节 离子反应评优课课件ppt: 这是一份高中化学第二节 离子反应评优课课件ppt,文件包含12课时2离子反应课件新教材人教版2019高中化学必修第一册ppt、12课时2离子反应练习新教材人教版2019高中化学必修第一册docx等2份课件配套教学资源,其中PPT共30页, 欢迎下载使用。













