

高中化学人教版 (2019)必修 第一册第二节 离子反应第2课时教学设计
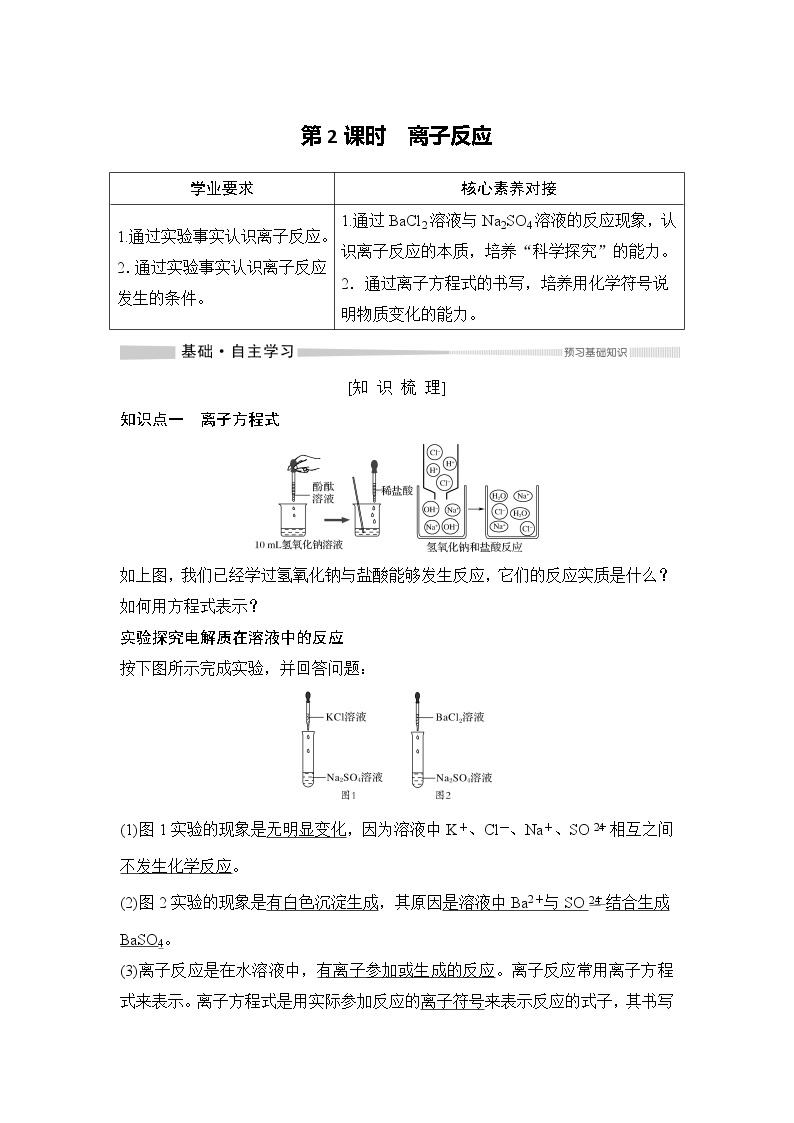
展开知识点一 离子方程式
如上图,我们已经学过氢氧化钠与盐酸能够发生反应,它们的反应实质是什么?如何用方程式表示?
实验探究电解质在溶液中的反应
按下图所示完成实验,并回答问题:
(1)图1实验的现象是无明显变化,因为溶液中K+、Cl-、Na+、SOeq \\al(2-,4)相互之间不发生化学反应。
(2)图2实验的现象是有白色沉淀生成,其原因是溶液中Ba2+与SOeq \\al(2-,4)结合生成BaSO4。
(3)离子反应是在水溶液中,有离子参加或生成的反应。离子反应常用离子方程式来表示。离子方程式是用实际参加反应的离子符号来表示反应的式子,其书写步骤要求(以氯化钡和硫酸钠在溶液中反应为例):
①写:化学方程式必须根据实验事实
BaCl2+Na2SO4===BaSO4↓+2NaCl;
②拆:把易溶于水、易电离的物质拆成离子的形式:
2Na++SOeq \\al(2-,4)+Ba2++2Cl-===BaSO4↓+2Na++2Cl-;
③删:删去方程式两边不参加反应的离子,并将计量数化为最简整数:
SOeq \\al(2-,4)+Ba2+===BaSO4↓;
④查:检查方程式两边各元素的原子个数和电荷总数是否相等、反应条件、沉淀符号、气体符号等。
离子方程式的书写步骤:“写→拆→删→查”。其关键是要将易溶于水、易电离的电解质写成离子的形式,单质、沉淀、气体、难电离的物质(如水、弱酸、弱碱)等写成化学式。
知识点二 离子反应发生的条件
1.两种电解质在溶液中相互交换离子而发生复分解反应。请写出下列复分解反应的离子方程式:
(1)氯化铝溶液和氨水: 。
生成难溶的物质,如生成BaSO4、AgCl、CaCO3、Fe(OH)3、Cu(OH)2等沉淀。
(2)碳酸钙和盐酸溶液: 。
生成气体或易挥发性物质,如生成CO2、SO2、H2S等气体。
(3)硫酸溶液和烧碱溶液: 。
生成难电离的物质,如生成H2O等。
2.置换反应
锌与盐酸的反应: 。
微判断
(1)CuSO4溶液与BaCl2溶液反应,实质上是SOeq \\al(2-,4)和Ba2+生成BaSO4的反应。( )
(2)离子反应H++OH-===H2O能表示所有的中和反应。( )
(3)离子反应中参加反应的全是离子。( )
(4)AgNO3溶液与NaCl溶液反应和AgNO3溶液与盐酸反应都可用Ag++Cl-===AgCl↓来表示。( )
(5)稀H2SO4与Ba(OH)2溶液反应的离子方程式为:Ba2++SOeq \\al(2-,4)===BaSO4↓。( )
微训练
1.下列不能发生离子反应的是________。
①NaCl溶液与AgNO3溶液
②KNO3溶液与NaOH溶液
③稀硫酸与BaCl2溶液
④盐酸与Na2CO3溶液
⑤Na2CO3溶液与Ca(OH)2溶液
⑥NaOH溶液与稀HNO3溶液
⑦锌与CuSO4溶液
⑧稀H2SO4和NaCl溶液
⑨Na2SO4溶液和CuCl2溶液
2.根据离子方程式的书写步骤写出CaCO3与稀盐酸反应的离子方程式。
微思考
写出下列反应的离子方程式或化学方程式。
(1)H2SO4+2NaOH===Na2SO4+2H2O的离子方程式为___________________。
(2)COeq \\al(2-,3)+2H+===CO2↑+H2O的化学方程式为________________________。
学习任务1 探究溶液中离子反应的实质
【情景素材】
为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和过程如下:
如图所示连接好装置,向烧杯中加入25 mL的Ba(OH)2溶液和2滴酚酞溶液,再一边不断地滴加H2SO4溶液,并轻轻振荡。
(1)实验现象及分析:①溶液颜色变化为__________________________,
原因是_____________________________________________________。
②灯泡亮度变化:___________________________________________,
原因是________________________________________________________。
③溶液变浑浊,原因是____________________。
(2)实验结论:稀H2SO4与Ba(OH)2溶液反应的实质是_______________________
(用离子方程式表示)。
提示 要证实Ba(OH)2和H2SO4溶液的反应是离子反应,则需证明发生反应的离子浓度发生了变化,而离子浓度变化和溶液导电性是有联系的。
1.离子反应发生的条件
2.离子不能大量共存的两类情况
(1)能发生复分解反应。
①生成难溶或微溶的物质。如生成BaSO4、AgCl、CaCO3、CaSO4、Ag2SO4、BaCO3、MgCO3、Fe(OH)3等
②生成难电离的物质。如生成CH3COOH、HClO、H2O、NH3·H2O等
③生成挥发性物质(气体)。如生成CO2、SO2、H2S等。只要具备上述三个条件中的一个,则离子不能大量共存
(2)能发生置换反应:金属单质与金属阳离子之间的置换反应,如Fe与CuSO4溶液的反应,实际上是Fe与Cu2+之间的置换反应。
3.离子共存问题中易忽视的三类隐含条件
(1)隐含条件一:无色透明溶液。
①“无色”是指溶液中不含有带有颜色的离子,如:呈蓝色的Cu2+、呈浅绿色的Fe2+、呈棕黄色的Fe3+、呈紫色的MnOeq \\al(-,4)。
②“透明溶液”意味着无难溶物和微溶物,但并不意味着溶液无色。
(2)隐含条件二:酸性环境“强酸性溶液”“使石蕊变红的溶液”“常温下,pH<7的溶液”,一定含有H+。
(3)隐含条件三:碱性环境“强碱性溶液”“使酚酞变红的溶液”“常温下,pH>7的溶液”,一定含有OH-。
一色、二性、三反应:
(1)记住几种溶液颜色,如Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕黄色)、MnOeq \\al(-,4)(紫红色)等。
(2)溶液酸性(如:石蕊显红色、pH=2等)、碱性(如:石蕊显蓝色、pH=12等)。
(3)能生成沉淀、气体、难电离物质(H2O、弱酸、弱碱)等符合离子反应条件的离子不能共存。
【例题1】 加入氢氧化钾溶液之后,溶液中下列离子数目明显减少的是 能与OH-反应的离子?( )
A.硝酸根离子 B.钠离子
C.钡离子D.铜离子
变式训练1 在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是 哪些离子有颜色?( )
A.Na+、K+、OH-、Cl-B.Na+、Cu2+、SOeq \\al(2-,4)、NOeq \\al(-,3)
C.Mg2+、Na+、SOeq \\al(2-,4)、Cl-D.Ba2+、HCOeq \\al(-,3)、NOeq \\al(-,3)、K+
学习任务2 离子方程式的书写及正误判断
1.在书写离子方程式时把CaCO3拆写成Ca2+和COeq \\al(2-,3)正确吗?为什么?
2.AgNO3溶液和Cu反应的离子方程式写成Cu+Ag+===Cu2++Ag正确吗?为什么?
1.离子方程式书写及判断的核心
在书写离子方程式和判断离子方程式的正误时要从“两易”“两等”和“两查”入手:
2.“六看”判断离子方程式的正误
(1)看是否符合客观事实
如:Fe加入硫酸铜溶液中:2Fe+3Cu2+===2Fe3++3Cu( )
Fe+Cu2+===Fe2++Cu( )
(2)看是否符合拆写原则
如石灰石加入稀盐酸中:COeq \\al(2-,3)+2H+===CO2↑+H2O( )
CaCO3+2H+===Ca2++CO2↑+H2O( )
(3)看是否遵守质量守恒定律
如Na2CO3与稀硫酸反应:COeq \\al(2-,3)+H+===CO2↑+H2O( )
COeq \\al(2-,3)+2H+===CO2↑+H2O( )
(4)看是否遵守电荷守恒
如钠与稀硫酸反应:Na+2H+===Na++H2↑( )
2Na+2H+===2Na++H2↑( )
(5)看是否漏掉参加反应的离子
如CuSO4与Ba(OH)2溶液反应:Ba2++SOeq \\al(2-,4)===BaSO4↓( )
Ba2++SOeq \\al(2-,4)+Cu2++2OH-===BaSO4↓+Cu(OH)2↓( )
(6)看是否符合阴、阳离子的个数配比
如Ba(OH)2溶液和稀硫酸反应:Ba2++OH-+H++SOeq \\al(2-,4)===BaSO4↓+H2O( )
Ba2++2OH-+2H++SOeq \\al(2-,4)===BaSO4↓+2H2O( )
核心提示:对微溶物,如Ca(OH)2,如果是反应物且为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物或是石灰乳等,则不能拆写成离子,应保留化学式Ca(OH)2。
3.书写离子方程式时的拆分原则
(1)强酸、强碱和易溶于水的盐改写成离子形式,难溶物质、难电离物质、易挥发物质、单质、氧化物、非电解质等均写化学式。
(2)改写微溶物时要看清题目要求:
①作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式。
②作为生成物,一般写化学式(标↓号)。
(3)氨水作反应物写NH3·H2O;作生成物,若有加热条件或浓度很大时,可写NH3(标↑号)+H2O;若是稀溶液且不加热时,可写成NH3·H2O。
(4)容易出现错误的几类物质的改写。
①多元弱酸的酸式酸根离子不能拆开写,如NaHCO3不能拆写成Na+、H+和COeq \\al(2-,3),应拆写成Na+和HCOeq \\al(-,3)。
②浓硫酸作为反应物不能拆开写,应写成化学式;在溶液中的NaHSO4应拆写成Na+、H+和SOeq \\al(2-,4)。
【例题2】 能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与硫酸的反应:OH-+H+===H2O
B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
C.铜片插入硝酸银溶液中:Cu+Ag+===Cu2++Ag
D.碳酸钙溶于稀盐酸中:CaCO3+2H+===Ca2++H2O+CO2↑
变式训练2 下列离子方程式正确的是( )
A.铜与硝酸银溶液反应
Cu+Ag+===Cu2++Ag
B.CH3COOH溶液与NaOH溶液反应
H++OH-===H2O
C.碳酸镁与稀H2SO4反应
MgCO3+2H+===Mg2++H2O+CO2↑
D.石灰乳与稀盐酸反应
H++OH-===H2O
学习任务3 (核心素养)与量有关的离子方程式书写
一、知识要点
在化学反应中,有时反应物的量不同,发生的反应不同,生成物不同,在书写离子方程式时要注意量的关系。
二、核心素养
【素养解题】
[典例示范] 写出下列反应的离子方程式:
(1)少量的NaHCO3与Ca(OH)2溶液的反应:___________________________
__________________________________________________________。
(2)少量的Ca(OH)2溶液与NaHCO3的反应: ___________________________
___________________________________________________________。
[与量有关的离子方程式书写解题思维模型]
三、对点训练
1.离子方程式与一般化学方程式的本质区别在于一般化学方程式表示的是一个具体的化学反应,而离子方程式表示的是一类反应,而且是一类反应的实质。从这个角度讲,可用离子方程式2H++COeq \\al(2-,3)===H2O+CO2↑表示的反应是( )
A.碳酸盐与盐酸反应
B.可溶性碳酸盐与稀硫酸反应
C.二氧化碳与酸溶液反应
D.盐酸与可溶性银盐溶液反应
2.某无色溶液既可能是强酸性又可能是强碱性,在该溶液中一定能大量共存的离子是( )
A.H+、Na+、MnOeq \\al(-,4)、SOeq \\al(2-,4)
B.Na+、COeq \\al(2-,3)、K+、Cl-
C.K+、Na+、Cl-、SOeq \\al(2-,4)
D.K+、Cl-、Ba2+、HCOeq \\al(-,3)
3.下列离子方程式书写正确的是( )
A.盐酸与碳酸钡反应:COeq \\al(2-,3)+2H+===CO2↑+H2O
B.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SOeq \\al(2-,4)===BaSO4↓+Cu(OH)2↓
C.硝酸银溶液中加入铜粉:Ag++Cu===Cu2++Ag↓
D.铁与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
4.氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道稀硫酸中的哪种粒子(H2O、H+、SOeq \\al(2-,4))能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
(1)通过实验Ⅰ可以证明_______________________________________。
(2)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入________,再加入________。
(3)探究结果为________________________________________。
(4)反应的离子方程式为________________________________。
[合 格 练]
1.下列叙述中正确的是( )
A.凡是盐在离子方程式中都要以离子形式表示
B.离子反应总是向着溶液中反应物离子浓度减小的方向进行
C.酸碱中和反应的实质是H+与OH-结合生成水,故所有的酸碱中和反应的离子方程式都可写成H++OH-===H2O的形式
D.复分解反应必须同时具备离子反应发生的三个条件才能进行
2.NaHCO3和NaHSO4的溶液混合后,实际参加反应的离子是 ( )
A.H+和COeq \\al(2-,3)B.HCOeq \\al(-,3)和HSOeq \\al(-,4)
C.Na+、HCOeq \\al(-,3)和H+D.HCOeq \\al(-,3)和H+
3.下列离子方程式改写成化学方程式正确的是( )
A.Cu2++2OH-===Cu(OH)2↓ CuCO3+2NaOH===Cu(OH)2↓+Na2CO3
B.COeq \\al(2-,3)+2H+===CO2↑+H2O BaCO3+2HCl===BaCl2+CO2↑+H2O
C.Zn+2H+===H2↑+Zn2+ Zn+2CH3COOH===H2↑+Zn(CH3COO)2
D.H++OH-===H2O 2KOH+H2SO4===K2SO4+2H2O
4.表示下列反应的离子方程式正确的是( )
A.铁跟稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
B.向NH4HCO3溶液中加入少量NaOH溶液:HCOeq \\al(-,3)+OH-===COeq \\al(2-,3)+H2O
C.氢氧化钡溶液和稀硫酸反应:Ba2++OH-+H++SOeq \\al(2-,4)===BaSO4↓+H2O
D.向澄清石灰水中通入少量CO2:CO2+OH-===HCOeq \\al(-,3)
5.下列反应的离子方程式书写正确的是( )
A.将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+===Ca2++H2O+CO2↑
B.向CuSO4溶液中加入NaOH溶液:Cu2++2OH-===Cu(OH)2↓
C.将Cu丝插入AgNO3溶液中:Cu+Ag+===Cu2++Ag
D.向KHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性:H++SOeq \\al(2-,4)+Ba2++OH-===H2O+BaSO4↓
6.如表是某矿物质饮用水的部分标签说明,则该饮用水中还可能较大量存在( )
A.OH-B.Ag+
C.Na+D.Ca2+
7.下列碱性透明溶液中,能大量共存的离子组是( )
A.K+、Na+、MnOeq \\al(-,4)、Cl-
B.K+、Ag+、NOeq \\al(-,3)、Cl-
C.Ba2+、Na+、Cl-、SOeq \\al(2-,4)
D.Na+、Cu2+、NOeq \\al(-,3)、Cl-
8.下列各组离子能在强酸性溶液中大量共存的是( )
A.K+、Na+、SOeq \\al(2-,4)、NOeq \\al(-,3)
B.OH-、Na+、Cl-、SOeq \\al(2-,4)
C.Ba2+、K+、Cl-、SOeq \\al(2-,4)
D.K+、NHeq \\al(+,4)、HCOeq \\al(-,3)、Cl-
9.有甲、乙、丙、丁四位同学分别对四种溶液中所含的离子进行检验,所得结果如下,其中一定错误的结果是( )
甲:K+、Na+、OH-、NOeq \\al(-,3) 乙:OH-、COeq \\al(2-,3)、Cl-、K+
丙:Cu2+、SOeq \\al(2-,4)、OH-、Cl- 丁:Ba2+、Na+、OH-、NOeq \\al(-,3)
A.甲B.乙
C.丙D.丁
10.下列离子在溶液中能大量共存,加入OH-能产生白色沉淀的是( )
A.Na+、Ca2+、SOeq \\al(2-,4)、Cl-B.H+、Mg2+、COeq \\al(2-,3)、S2-
C.K+、Mg2+、SOeq \\al(2-,4)、NOeq \\al(-,3)D.K+、Na+、NOeq \\al(-,3)、SOeq \\al(2-,3)
11.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.所含溶质为NaHSO4的溶液:加入K+、COeq \\al(2-,3)、NOeq \\al(-,3)、Na+
B.滴加酚酞变红的溶液:加入SOeq \\al(2-,4)、Cu2+、K+、Cl-
C.含有大量SOeq \\al(2-,4)的溶液:加入K+、Cu2+、Cl-、NOeq \\al(-,3)
D.常温下,加入铁粉能生成H2的溶液:Na+、Ca2+、Cl-、HCOeq \\al(-,3)
12.用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl):试剂_____________________________________________,
离子方程式为___________________________________________________。
(2)O2(CO2):试剂________,离子方程式为__________________________
_______________________________________________________________ 。
(3)SOeq \\al(2-,4)(COeq \\al(2-,3)):试剂________,离子方程式为_______________________
_________________________________________________________。
[能 力 练]
13.按要求书写下列反应的离子方程式。
(1)往澄清石灰水中通入少量二氧化碳,请写出此反应的离子方程式:______________________________。
(2)锌粒投入稀H2SO4中,溶液里氢离子的量减少,锌离子的量增加,________离子的量没有变化,反应的离子方程式是______________________________。
(3)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:______________________________________________。
(4)①Ca(HCO3)2与少量NaOH溶液反应
②NaOH与少量Ca(HCO3)2溶液反应
请分别写出发生反应的离子方程式:
①___________________________________________________。
②___________________________________________________。
14.(1)实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式:___________________________________________;
常用澄清石灰水检验CO2气体的离子方程式是________________________
_______________________________________________________________。
(2)将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是_______________________________________________________________;
反应片刻后,可观察到有气体产生,其离子方程式是________________________________________________________。
(3)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为
______________________________________________。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为______________________________________________
__________________________________________________________。
学业要求
核心素养对接
1.通过实验事实认识离子反应。
2.通过实验事实认识离子反应发生的条件。
1.通过BaCl2溶液与Na2SO4溶液的反应现象,认识离子反应的本质,培养“科学探究”的能力。
2.通过离子方程式的书写,培养用化学符号说明物质变化的能力。
主要成分
钾离子(K+):20~27.3 mg·L-1
氯离子(Cl-):30~34.2 mg·L-1
镁离子(Mg2+):20.2~24.9 mg·L-1
硫酸根离子(SOeq \\al(2-,4)):24~27.5 mg·L-1
高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应第1课时教学设计: 这是一份高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应第1课时教学设计,共6页。教案主要包含了活动设计,设计意图,设计实验方案,对比实验1,对比实验2等内容,欢迎下载使用。
化学必修1第二章 化学物质及其变化第二节 离子反应第2课时教案: 这是一份化学必修1第二章 化学物质及其变化第二节 离子反应第2课时教案,共3页。教案主要包含了温故知新,课堂生成,课堂研讨等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第二节 离子反应第2课时教案设计: 这是一份高中化学人教版 (新课标)必修1第二节 离子反应第2课时教案设计,共6页。