

化学必修 第一册第一章 物质及其变化第二节 离子反应课堂检测
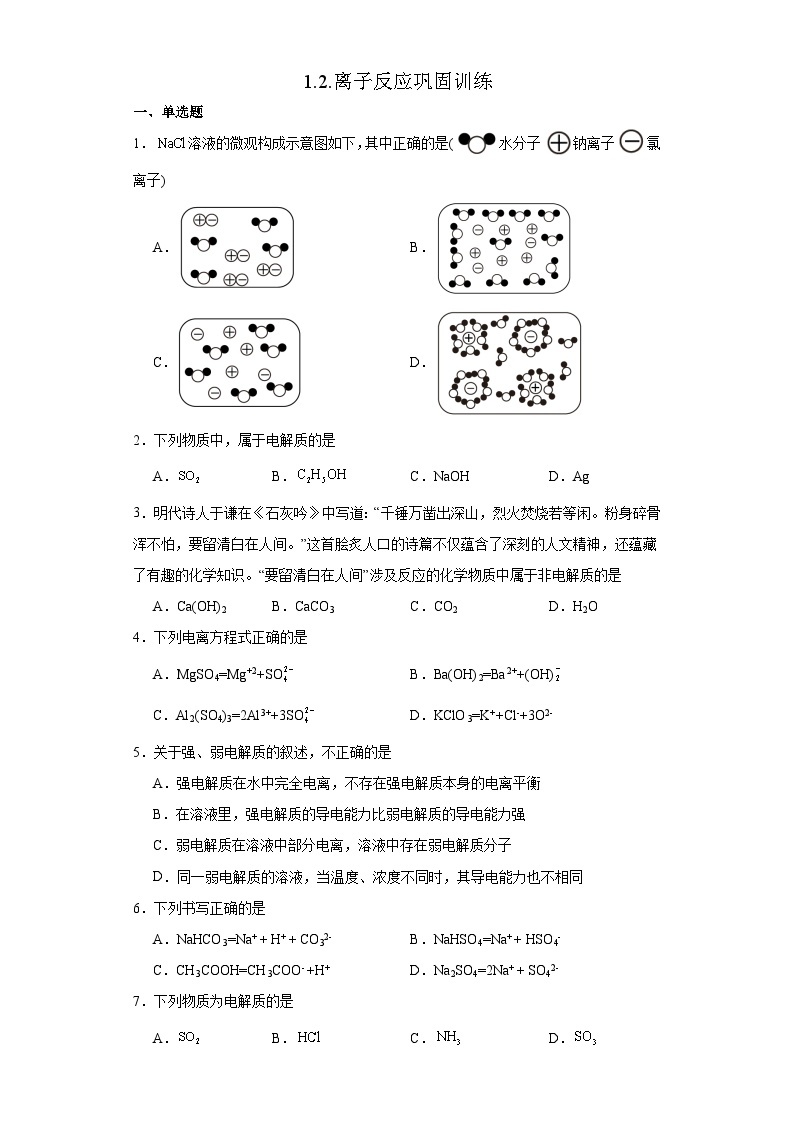
展开1.溶液的微观构成示意图如下,其中正确的是(水分子钠离子氯离子)
A.B.
C.D.
2.下列物质中,属于电解质的是
A.B.C.NaOHD.Ag
3.明代诗人于谦在《石灰吟》中写道:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。”这首脍炙人口的诗篇不仅蕴含了深刻的人文精神,还蕴藏了有趣的化学知识。“要留清白在人间”涉及反应的化学物质中属于非电解质的是
A.Ca(OH)2B.CaCO3C.CO2D.H2O
4.下列电离方程式正确的是
A.MgSO4=Mg+2+SOB.Ba(OH)2=Ba2++(OH)
C.Al2(SO4)3=2Al3++3SOD.KClO3=K++Cl-+3O2-
5.关于强、弱电解质的叙述,不正确的是
A.强电解质在水中完全电离,不存在强电解质本身的电离平衡
B.在溶液里,强电解质的导电能力比弱电解质的导电能力强
C.弱电解质在溶液中部分电离,溶液中存在弱电解质分子
D.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同
6.下列书写正确的是
A.NaHCO3=Na+ + H+ + CO32-B.NaHSO4=Na+ + HSO4-
C.CH3COOH=CH3COO- +H+ D.Na2SO4=2Na+ + SO42-
7.下列物质为电解质的是
A.B.C.D.
8.下列反应的离子方程式不正确的是( )
A.锌与硫酸铜溶液反应:
B.碳酸氢钠与稀盐酸反应;
C.硝酸银溶液与盐酸反应:
D.氢氧化钡溶液与稀硫酸反应:
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离产生的c(H+)=10-12 ml·L-1的溶液:K+、Na+、ClO-、I-
B.c(H+)/c(OH-)=1×10-12的溶液:K+、、、Na+
C.硫化钠溶液:Cu2+、、Br-、H+
D.pH=13的溶液:Al[(OH)4]-、Cl-、、
10.在酸性溶液中,下列离子能大量共存的是
A.Na+、Mg2+、Cl-、OH-B.K+、Fe3+、、SCN-
C.Na+、、、K+D.K+、Cu2+、、
11.下列有关物质分类的说法正确的是
A.纯碱、液态氧、碘酒、稀盐酸依次是盐、单质、混合物、电解质
B.干冰、生石灰、硫酸、碳酸氢铵依次是电解质、氧化物、酸、盐
C.氯化氢、氨气、水银、草木灰依次是电解质、非电解质、单质、混合物
D.冰水混合物、雾、泥水依次是溶液、胶体、浊液
12.下列离子方程式书写正确的是
A.大理石与稀盐酸反应制取CO2:
B.氢氧化钡溶液与稀硫酸混合:
C.稀硫酸滴在铜片上:
D.硝酸银溶液与氯化钾溶液混合:
13.下列离子组一定不能够大量共存的是
A.K+、Na+、、
B.、、、Na+
C.Al3+、、、Cl−
D.、Na+、K+、
14.下列对应反应的离子方程式书写正确的是
A.将加入到溶液中:
B.向溶液中加入过量溶液,有白色沉淀生成:
C.向溶液加入溶液
D.已知电离平衡常数:,向溶液中通入少量:
15.下列离子方程式的书写正确的是( )
A.铁跟稀盐酸反应:2Fe+6H+═2Fe3++3H2↑
B.碳酸氢钙溶液中加入盐酸:Ca(HCO3)2+2HCl═CaCl2+2H2O+2CO2↑
C.CO2通入澄清石灰水中:CO2+Ca2++2OH﹣═CaCO3↓+H2O
D.NaHCO3溶液中加入盐酸:HCO3﹣+H+═H2CO3
16.某无色溶液由K+、Cu2+、Al3+、、、Cl-等某些离子组成,为检验其组成,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列分析正确的是
A.溶液中肯定有Cl-
B.(2)中发生反应的离子方程式为+2H+=CO2↑+H2O
C.此溶液一定为K2SO4溶液
D.(1)中发生反应的离子方程式为Ba2++=BaCO3↓
17.下列离子方程式书写正确的是
A.将足量的SO2通到Na2CO3溶液中:CO+ SO2=CO2+SO
B.向溶液中加入过量的NaOH溶液:
C.向Fe(NO3)2溶液中加入稀盐酸: 3Fe2+ + 4H+ + NO= 3Fe3+ + 2H2O + NO↑
D.向碳酸氢铵溶液中加入过量的NaOH溶液:
18.下列物质的分类组合不正确的有
(1)海水、空气、胆矾、盐酸均为混合物
(2)、、、均为酸
(3)、NaOH、、石灰水均为碱
(4)干冰、、、均为酸性氧化物
(5)、AgCl、、均为盐
(6)、、小苏打既为钠盐,同时又为酸式盐
A.(1)(4)(6)B.(1)(3)(4)C.(2)(5)(6)D.(1)(3)(5)
19.碘化锂(LiI)在能源、医药等领域有重要应用,某兴趣小组制备LiI·3H2O和LiI,流程如图:
已知:LiI·3H2O在300℃以上转变成无水LiI。LiI易溶于水,溶解度随温度升高而增大,在空气中受热易被氧化。Li2CO3难溶于水。下列说法错误的是
A.步骤①主要发生的离子反应为Li2CO3+2H+=2Li++CO2↑+H2O
B.步骤②过滤用到的玻璃仪器有玻璃棒、烧杯、漏斗
C.步骤④可在空气中加热到300℃以上进行转化
D.步骤③中一系列操作包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥
20.下列指定反应的离子方程式正确的是
A.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B.酸化NaIO3和NaI的混合溶液:5I−++6H+=3I2+3H2O
C.KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3=2+3Cl−+4H++H2O
D.向氢氧化钡溶液中加入稀硫酸:Ba2++OH–+H++=BaSO4↓+H2O
21.下列导电性变化图像和实物对应一致的
A.向AgNO3溶液中通入HCl直至过量
B.向氨水中通入HCl直至过量
C.向饱和石灰水中不断通入CO2至恰好沉淀完全
D.向NaHSO4溶液中加入Ba(OH)2溶液至恰好沉淀完全
22.按下列添加试剂的先后顺序,可将盐酸、H2SO4、K2SO4、NaOH和KNO3五种无色透明溶液鉴别开来的是
A.紫色石蕊溶液、AgNO3溶液、稀硝酸B.BaCl2溶液、无色酚酞溶液、AgNO3溶液
C.紫色石蕊溶液、BaCl2溶液D.无色酚酞溶液、BaCl2溶液、AgNO3溶液
23.下列离子方程式书写正确的是
A.NaHCO3溶液中加入稀盐酸: +2H+=CO2↑+H2O
B.碳酸钠溶液与足量硫酸反应:+2H+=CO2↑+H2O
C.硫酸滴加到氢氧化钡溶液中:Ba2++ +H+ + OH-= BaSO4↓+H2O
D.钠与水反应:Na + H2O =Na+ + OH- + H2↑
24.表示下列变化的化学用语正确的是
A.溶液显碱性:
B.在水溶液中的电离方程式:
C.铁在潮湿空气中被腐蚀的负极反应:
D.溶液显酸性:
25.某无色溶液中只可能含有K+、Ag+、Ba2+、Cu2+、Cl-、OH-、CO、SO中的一种或几种,对其进行如下实验操作:
(1)取少量溶液,滴加无色酚酞试剂,酚酞变红;
(2)另取少量溶液,加入足量BaCl2溶液,产生白色沉淀;
(3)向(2)所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成;
(4)将(3)所得混合物过滤,向滤液中加入AgNO3溶液,有白色沉淀生成。
下列对该溶液的说法正确的是
A.一定含有K+、OH-、CO、SO
B.可能含有Cl-、OH-、K+
C.一定不含有Ag+、Ba2+、Cu2+、Cl-
D.无法判断
二、填空题
26.写出下列物质的电离方程式
(1)Ba(OH)2
(2)H2SO4
(3)FeCl3
27.I.写出下列典型物质的电离方程式
(1)H2SO4
(2)Fe(OH)3
(3)NaHSO4
(4)NaHCO3
(5)Al2O3(熔融)
II.写出下列典型反应的离子方程式:
(1)在稀H2SO4中加入CH3COONa溶液
(2)氧化镁溶于稀硫酸
(3)CuSO4溶液与Ba(OH)2溶液混合
(4)NaHCO3溶液与稀盐酸混合
(5)NaHSO4溶液与NaOH溶液混合
28.怎样用化学方法除去下列物质中混有的少量杂质,写出除杂需加入的试剂以及发生反应的离子方程式。
学法题:归纳总结除杂试剂选择的方法
步骤
操作
现象
(1)
向此溶液中滴加BaCl2溶液
出现白色沉淀
(2)
过滤,将沉淀物置于足量稀硝酸中
沉淀完全溶解,有气泡产生
(3)
向滤液中加入AgNO3溶液和稀硝酸
有白色沉淀产生
需加入的除杂试剂
发生反应的离子方程式
①CO2气体中混有HCl杂质
②NaHCO3溶液中混有Na2CO3
③FeCl2溶液中混有FeCl3杂质
④Fe2O3固体中混有Al2O3杂质
参考答案:
1.D
【详解】氯化钠是离子化合物,属于强电解质,在溶液中完全电离生成钠离子和氯离子,其离子键被水分子破坏形成水合钠离子和水合氯离子,根据图示可知,故答案选D。
2.C
【分析】在水溶液中或熔融状态下能够导电的化合物属于电解质;常见的电解质是酸、碱、盐、金属氧化物、水。
【详解】A.属于非金属氧化合物,所以不属于电解质,故A错误;
B.属于有机物,且不属于酸,所以不属于电解质,故B错误;
C.NaOH属于碱,所以NaOH属于电解质,故C正确;
D.Ag属于单质,所以Ag不属于电解质,故D错误;
故选C。
3.C
【详解】“要留清白在人间”涉及的化学反应为Ca(OH)2与CO2反应生CaCO3和H2O,CaCO3、Ca(OH)2为强电解质,H2O为弱电解质,CO2为非电解质;
答案选C。
4.C
【详解】A.MgSO4的电离方程式为:MgSO4=Mg2++SO,A错误;
B.Ba(OH)2的电离方程式为:Ba(OH)2=Ba2++2OH-,B错误;
C.Al2(SO4)3的电离方程式为:Al2(SO4)3=2Al3++3SO,C正确;
D.KClO3的电离方程式为:KClO3=K++,D错误;
故答案为:C。
5.B
【详解】A.强电解质再水中完全电离,不存在电解质本身的电离平衡,A正确;
B.在同温、同溶度下,强电解质的导电能力比弱电解质导电能力强,B错误;
C.弱电解质在溶液中部分电离,溶液中分子、离子共存,C正确;
D.弱电解质的导电能力受温度和浓度的影响,D正确;
故答案选B。
6.D
【详解】A、碳酸为弱酸,碳酸氢根不能拆开;
B、硫酸为强酸,硫酸氢根需要拆开;
C、醋酸为弱酸,部分电离,用可逆符号;
答案选D。
7.B
【分析】电解质是在水溶液中或熔融状态下能导电的化合物,据此分析判断。
【详解】A.SO2 本身不能电离产生自由移动的离子,溶于水能够导电,是生成的亚硫酸发生了电离,SO2 属于非电解质,故A不选;
B.HCl是溶于水能够导电的化合物,属于电解质,故B选;
C.NH3 本身不能电离产生自由移动的离子,溶于水能够导电,是生成的一水合氨发生了电离,氨气属于非电解质,故C不选;
D.SO3本身不能电离产生自由移动的离子,溶于水能够导电,是生成的硫酸发生了电离,SO3 属于非电解质,故D不选;
故选B。
8.D
【详解】A. 锌与硫酸铜溶液反应,其化学反应方程式为:,其离子反应方程式为:,A正确;
B. 碳酸氢钠与稀盐酸反应,化学反应方程式为:,其离子反应方程式为:,B正确;
C. 硝酸银溶液与盐酸反应,其化学反应方程式为:,其离子反应方程式为:,C正确;
D. 氢氧化钡溶液与稀硫酸反应,其化学反应方程式为:,其离子反应方程式为:,D错误; 故答案为:D。
9.B
【详解】A.水电离产生的c(H+)=10-12 ml·L-1的溶液,溶液可能呈酸性或者碱性,酸性条件下H+与ClO-反应生成弱电解质,酸性或碱性条件下ClO-与I-发生氧化还原反应不共存,A项不符合题意;
B.c(H+)/c(OH-)=1×10-12的溶液呈碱性,K+、、、Na+可以大量共存,B项符合题意;
C.硫化钠溶液:Cu2+与S2-会生成硫化铜沉淀, S2-、、H+会发生归中反应,C项不符合题意;
D.pH=13的溶液呈碱性,+ OH-=+H2O,D项不符合题意;
故选B。
10.D
【详解】A.酸性溶液中有大量,与反应生成水,不能大量共存,A项错误;
B.与可以生成红色络合物,不能大量共存,B项错误;
C.酸性溶液中有大量,与反应生成二氧化碳和水,不能大量共存,C项错误;
D.四种离子在酸性溶液中均不能相互反应,可以大量共存,D项正确;
故选D。
11.C
【详解】A.纯碱是碳酸钠为盐,液态氧为一种元素组成的是单质,碘酒是碘单质的酒精溶液为混合物,稀盐酸是混合物,既不是电解质也不是非电解质,故A错误;
B.干冰是二氧化碳,本身在水溶液和熔化状态下不能电离属于非电解质,生石灰是氧化钙为氧化物,硫酸为酸,碳酸氢铵为盐,故B错误;
C.氯化氢溶于水导电属于电解质,氨气本身在水溶液和熔化状态下不能电离属于非电解质,水银是Hg属于金属单质,草木灰主要成分为碳酸钾,属于混合物,故C正确;
D.冰水是一种物质组成属于纯净物,雾属于胶体,泥水属于浊液,故D错误;
答案为C。
12.D
【详解】A.碳酸钙为沉淀,不能写成离子,正确离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.氢氧化钡溶液与稀硫酸混合的离子反应为2H++2OH-+Ba2++SO42-=BaSO4↓+2H2O,故B错误;
C.铜与稀硫酸不反应,故C错误;
D.硝酸银溶液与氯化钾溶液混合生成氯化银沉淀,离子方程式为Ag++Cl-=AgCl↓,故D正确;
故答案为D。
【点睛】离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等。
13.C
【详解】A项,四种离子相互之间不能反应,能大量共存,故A正确;
B项,NH与HCO虽然能相互促进水解,但不彻底,所以能大量共存,故B正确;
C项,Al3+、HCO发生双水解生成沉淀和气体,不能大量共存,故C错误;
D项,SiO能发生水解,但水解程度很弱,所以四种离子之间能大量共存,故D正确;
故答案选C。
14.B
【详解】A.由于I-能被Fe3+氧化,故将Fe2O3加入到溶液中的离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O,A错误;
B.向溶液中加入过量溶液,有白色沉淀生成的离子方程式为:,B正确;
C.由于CH3COOH是弱酸,为弱电解质,故向CH3COOH溶液加入KOH溶液的离子方程式为:CH3COOH+OH-=CH3COO-+H2O,C错误;
D.已知电离平衡常数:,故向溶液中通入少量的离子方程式为:,D错误;
故答案为:B。
15.C
【详解】A.铁跟稀盐酸反应,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.碳酸氢钙溶液中加入盐酸,离子方程式:HCO3﹣+H+═H2O+CO2↑,故B错误;
C.CO2通入澄清石灰水中,离子方程式:CO2+Ca2++2OH﹣═CaCO3↓+H2O,故C正确;
D.NaHCO3溶液中加入盐酸,离子方程式:HCO3﹣+H+═H2O+CO2↑,故D错误;
故选C。
【点睛】离子方程式的正误判断遵循的原则:1、电荷要守恒 2、原子种类和个数守恒 3、符合客观事实 4、单质、沉淀,气体、水、氧化物、弱酸和弱碱等不能拆成离子形式。
16.D
【分析】溶液呈无色,则不含有铜离子,①向此溶液中滴加氯化钡溶液,生成白色沉淀,而②生成的白色沉淀完全溶于足量的稀硝酸,且有气泡产生,则一定有碳酸根离子,一定不含有硫酸根离子,③项滤液中加入硝酸银溶液和稀硝酸,由白色沉淀产生,证明滤液中有氯离子,依据离子共存,溶液中一定不存在铝离子,依据电荷守恒,原溶液中一定含有钾离子,综上所述,原溶液中一定含有钾离子,碳酸根离子,一定不含有铜离子,氯离子,硫酸根离子,可能含有氯离子。
【详解】A.由分析可知,原溶液中不一定有氯离子,A项错误;
B.(2)中发生反应的离子方程式为BaCO3+2H+=Ba2++ CO2↑+H2O,B项错误;
C.由分析知,原溶液中一定含有钾离子,碳酸根离子,可能含有氯离子,所以此溶液中肯定含有碳酸钾,可能含有氯化钾,C项错误;
D.①中加入氯化钡,只有碳酸根发生反应,离子方程式为Ba2++=BaCO3↓,D项正确;
答案选D。
17.C
【详解】A.将足量的SO2通到Na2CO3溶液中应该生成亚硫酸氢钠,离子方程式为:CO+ 2SO2+H2O=CO2+2HSO,A错误;
B.根据“以少定多”的原则,向溶液中加入过量的NaOH溶液的离子方程式为:,B错误;
C.硝酸有强氧化性可以把二价铁氧化为三价铁,故向Fe(NO3)2溶液中加入稀盐酸的离子方程式为:3Fe2+ + 4H+ + NO= 3Fe3+ + 2H2O + NO↑,C正确;
D.NaOH过量碳酸氢根离子也可以和氢氧根反应,故正确的离子方程式为:,D错误;
故选C。
18.B
【详解】(1)海水、空气、盐酸均为混合物;胆矾为纯净物,故(1)不正确;
(2)电离出的阳离子全部是氢离子的是酸,、、、均为酸,故(2)正确;
(3)电离出的阴离子全部是氢氧根离子的是碱,、NaOH、为碱,石灰水为混合物,故(3)错误;
(4)与水直接化合形成相应酸或与碱反应生成盐和水的氧化物为酸性氧化物,干冰、、均为酸性氧化物,不符合酸性氧化物的标准,故(4)错误;
(5)由金属阳离子或铵根离子与酸根阴离子组合而成的化合物为盐,、AgCl、、均为盐,故(5)正确;
(6)与碱能继续反应的盐属于酸式盐,、、小苏打既为钠盐,均含有钠离子,同时又为酸式盐,故故(6)正确;
综上所述,(1)(3)(4)分类错误,故选B。
19.C
【分析】粗碳酸锂加强酸氢碘酸溶解为LiI,同时生成二氧化碳和水,溶液调pH=7,过滤,滤液经蒸发浓缩,冷却结晶,过滤,洗涤,干燥得到LiI·3H2O,再经脱水得到无水LiI。
【详解】A.碳酸锂难溶于水,与强酸氢碘酸反应生成LiI、CO2、H2O,LiI易溶于水,因此反应离子方程式为Li2CO3+2H+=2Li++CO2↑+H2O,故A正确;
B.过滤用到的玻璃仪器有玻璃棒、烧杯、漏斗,故B正确;
C.LiI·3H2O在300℃以上转变成无水LiI,但在空气中受热易被氧化,所以步骤④不能在空气中加热到300℃以上进行转化,故C错误;
D.步骤③是从LiI溶液中获得LiI·3H2O,则一系列操作包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故D正确;
综上所述,错误的是C项。
20.B
【详解】A.碳酸钙和醋酸都需要保留化学式,反应的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故A错误;
B.酸化NaIO3和NaI的混合溶液发生氧化还原反应,反应的离子方程式为:5I-++6H+═3I2+3H2O,故B正确;
C.碱性溶液中,不能生成氢离子,反应的离子方程式为:3ClO-+2Fe(OH)3+4OH¯=2+3Cl-+5H2O,故C错误;
D.氢氧化钡溶液中加入稀硫酸,反应的离子方程式:Ba2++2OH-+2H++=BaSO4↓+2H2O,故D错误;
故选B。
21.B
【详解】A.向AgNO3溶液中通入HCl会发生反应,溶质从AgNO3变为HNO3,离子浓度几乎不变,导电性几乎不变,HCl过量时离子浓度会增大,导电性会明显增强,故A错误;
B.氨水中的是弱电解质,通入HCl会发生反应,从弱电解质变成强电解质NH4Cl,离子浓度会增大,溶液导电性会增强,HCl过量导电性会一直增强,故B正确;
C.向饱和石灰水中不断通入CO2至恰好沉淀完全,会从强电解质Ca(OH)2变成难溶的碳酸钙,离子浓度减小,导电性减弱,故C错误;
D. 向NaHSO4溶液中加入Ba(OH)2溶液至恰好沉淀完全,会发生反应,离子浓度会有所减小,但不会为零,故D错误;
故答案为:B。
22.C
【详解】试题分析:在五种溶液中,遇紫色石蕊溶液变蓝色的是NaOH,变红色的是HCl和H2SO4,不变色的是K2SO4和KNO3。然后再借助BaCl2将HCl和H2SO4、K2SO4和KNO3鉴别开即可,所以答案选C。
考点:考查物质的检验
点评:该题是高考中的常见题型,属于中等难度的试题,试题侧重对学生能力的考查。该题的关键是熟练掌握物质的性质,特别是化学性质。然后结合具体的物质,选出最佳方案即可。本题有利于培养学生严谨的逻辑思维能力,提高学生的实验操作能力,有利于调动学生的学习积极性。
23.B
【详解】A.碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳,故为 +2H+ = CO2↑+H2O,选项A错误;
B.碳酸钠溶液与硫酸反应生成硫酸钠、水、二氧化碳,故为+2H+ = CO2↑+H2O,选项B正确;
C.硫酸滴加到氢氧化钡溶液中反应生成硫酸钡沉淀和水,反应的离子方程式为:Ba2++ +2H+ + 2OH-= BaSO4↓+2H2O,选项C错误;
D.钠与水反应生成氢氧化钠和氢气,故为2Na + 2H2O = 2Na++ 2OH- + H2↑,选项D错误;
答案选B。
24.D
【详解】A.溶液显碱性:,A错误;
B.在水溶液中的电离方程式:,B错误;
C.铁在潮湿空气中被腐蚀的负极反应:,C错误;
D.溶液显酸性因为镁离子水解生成氢氧化镁沉淀和氢离子:,D正确;
答案选D。
25.A
【详解】(1)无色溶液说明不含Cu2+,滴加无色酚酞溶液变红,说明含OH-,则不含Ag+;
(2)加入足量BaCl2溶液,产生白色沉淀,说明含、CO或SO或两者都有,则一定不含Ba2+;
(3)向(2)所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成,说明原溶液中含CO和SO;
(4)向滤液中加入AgNO3溶液,有白色沉淀生成,说明滤液中含有Cl-,但可能是加入的BaCl2溶液及盐酸引入的,不能确定原溶液是否含有Cl-。根据溶液呈电中性,则溶液中一定含K+。综上所述,原溶液一定含有K+、OH-、、CO、SO,一定不含Ag+、Ba2+、Cu2+,可能含有Cl-。故答案选:A。
26. Ba(OH)2=Ba2++2OH- H2SO4=2H++SO42- FeCl3=Fe3++3Cl-
【详解】(1) Ba(OH)2是强碱,属于强电解质,在水中可以完全电离,故电离方程式是:Ba(OH)2=Ba2++2OH-;
(2) H2SO4是强酸,属于强电解质,在水中可以完全电离,故电离方程式是:H2SO4=2H++SO;
(3) FeCl3是盐,属于强电解质,在水中可以完全电离,故电离方程式是:FeCl3=Fe3++3Cl-;
27. H2SO4===2H++SO42- Fe(OH)3Fe3++3OH- NaHSO4===Na++H++SO42- NaHCO3===Na++HCO3-、 Al2O32Al3++3O2- CH3COO-+H+===CH3COOH MgO+2H+===Mg2++H2O Cu2++SO42-+Ba2++2OH-===Cu(OH)2↓+BaSO4↓ HCO3-+H+===H2O+CO2↑ H++OH-===H2O
【分析】I. (1)硫酸为强电解质,在溶液中完全电离;
(2)Fe(OH)3为多元弱碱,则电离方程式为Fe(OH)3Fe3++3OH-;
(3)NaHSO4是强电解质,完全电离;
(4)碳酸氢钠是弱酸强碱酸式盐,是强电解质完全电离;
(5) Al2O3(熔融)是强电解质,熔融时完全电离;
II. (1) H2SO4和CH3COONa溶液反应反应生成醋酸和硫酸钠,醋酸是弱酸不能拆,硫酸钠是强电解质要拆;
(2)氧化镁溶于稀硫酸生成硫酸镁和水,硫酸和硫酸镁是强电解质,在离子方程式里要拆;
(3) CuSO4溶液与Ba(OH)2溶液混合生成硫酸钡沉淀和氢氧化铜沉淀;
(4) 碳酸氢钠和盐酸反应生成二氧化碳、水和氯化钠;
(5) NaHSO4溶液与NaOH溶液混合生成硫酸钠和水,NaHSO4是强电解质在溶液中电离出氢离子、钠离子和硫酸根离子,硫酸钠是强电解质在离子方程式中要拆。
【详解】I. (1)硫酸为强电解质,在溶液中完全电离,其电离方程式为:H2SO4===2H++SO42-,故答案为:H2SO4===2H++SO42-;
(2)Fe(OH)3为多元弱碱,则电离方程式为Fe(OH)3Fe3++3OH-,故答案为:Fe(OH)3Fe3++3OH-;
(3)NaHSO4是强电解质,完全电离,电离方程式为NaHSO4===Na++H++SO42-,故答案为:NaHSO4===Na++H++SO42-;
(4)碳酸氢钠是弱酸强碱酸式盐,是强电解质完全电离;电离方程式为:NaHCO3===Na++HCO3-;故答案为:NaHCO3===Na++HCO3-;
(5) Al2O3(熔融)是强电解质,熔融时完全电离,电离方程式为:Al2O3 2Al3++3O2-;故答案为:NaHCO3===Na++HCO3-;
II. (1) H2SO4和CH3COONa溶液反应反应生成醋酸和硫酸钠,醋酸是弱酸不能拆,硫酸钠是强电解质要拆,离子反应为CH3COO-+H+=CH3COOH;
(2)氧化镁溶于稀硫酸生成硫酸镁和水,硫酸和硫酸镁是强电解质,在离子方程式里要拆,离子方程式为:MgO+2H+===Mg2++H2O;
(3) CuSO4溶液与Ba(OH)2溶液混合生成硫酸钡沉淀和氢氧化铜沉淀,离子方程式为:Cu2++SO42-+Ba2++2OH-===Cu(OH)2↓+BaSO4↓;
(4) 碳酸氢钠和盐酸反应生成二氧化碳、水和氯化钠,反应的化学方程式为:NaHCO3+HCl=CO2↑+H2O+NaCl;碳酸氢钠、氯化氢都是可溶性的强电解质,离子方程式中需要拆开,二氧化碳、水需要保留分子式,该反应的化离子方程式:HCO3-+H+==CO2↑+H2O;
(5) NaHSO4溶液与NaOH溶液混合生成硫酸钠和水,NaHSO4是强电解质在溶液中电离出氢离子、钠离子和硫酸根离子,硫酸钠是强电解质在离子方程式中要拆,该反应的化离子方程式:H++OH-===H2O。
【点睛】本题考查离子反应方程式的书写,为高考高频考点,把握发生的化学反应为解答的关键,注意氧化还原反应中电子、电荷守恒及与量有关的离子反应,题目难度中等。
28.(9分)
【详解】试题分析:二氧化碳中的氯化氢可以将气体通过饱和碳酸氢钠溶液,氯化氢与碳酸氢钠反应生成氯化钠和水、二氧化碳。碳酸氢钠中的碳酸钠杂质可以用通入二氧化碳的方法除去,碳酸钠和二氧化碳和水反应碳酸氢钠。氯化亚铁中的氯化铁,可以选用加入铁粉的方法除去,氯化铁和铁反应生成氯化亚铁。氧化铁中的氧化铝可以利用氧化铝能与氢氧化钠反应除去。
考点: 物质的除杂和提纯
【名师点睛】物质的分离和提纯过程中注意能将杂质除去,但不能引入新的杂质,对于不同的状态的物质除杂的方法也不同,例如碳酸钠中的碳酸氢钠,若为固体状态,可以用加热的方法除去,若为溶液,可以加入氢氧化钠除去。在除杂过程中若能生成想要保留的物质是最好的选择。例如二氧化碳中的氯化氢,用饱和碳酸氢钠除去,既能除去氯化氢又增加了二氧化碳的量。物质
需加入的除杂试剂(写化学式)
发生反应的离子方程式
CO2气体中混有HCl
饱和NaHCO3溶液
H++HCO3-=H2O+CO2↑
NaHCO3溶液中混有Na2CO3
足量CO2
CO32-+CO2+H2O=2HCO3-
FeCl2溶液中混有FeCl3
铁粉
Fe+2Fe3+=3Fe2+
Fe2O3固体中混有Al2O3
NaOH溶液
Al2O3+2OH-=AlO2-+H2O
高中人教版 (2019)第二节 氯及其化合物随堂练习题: 这是一份高中人教版 (2019)第二节 氯及其化合物随堂练习题,共17页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应巩固练习: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应巩固练习,共16页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键课后测评: 这是一份人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键课后测评,共17页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。













