








- 2.7《摩尔质量》课件+教案 课件 37 次下载
- 2.8《气体摩尔体积 阿伏伽德罗定律》课件+教案 课件 37 次下载
- 3.1《铁及其化合物 》课件+教案 课件 43 次下载
- 3.2《金属材料 》课件+教案 课件 39 次下载
- 4.1《原子结构》课件+教案 课件 36 次下载
高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量说课ppt课件
展开人教版化学科高一年必修一
《物质的量浓度》教学设计
课题 | 物质的量浓度 | 课型 | 新授课 |
教学目标 | 1理解物质的量浓度的概念。 | ||
2掌握配制一定浓度溶液的步骤 | |||
3学会溶液配制的误差分析。 | |||
教学重难点 | 重点:物质的量浓度概念的形成 | ||
难点:溶液配制步骤 误差分析 | |||
教学环节 | 教学过程 | ||
课堂导入 | 【新课导入】 1、什么是溶液? 溶液:由一种或几种物质(溶质),分散到另一种物质(溶剂)里,形成的均一、稳定的混合物。 2、在初中阶段,同学们学习过一种溶液浓度的表示方法,是怎样表示的? | ||
课程 学习
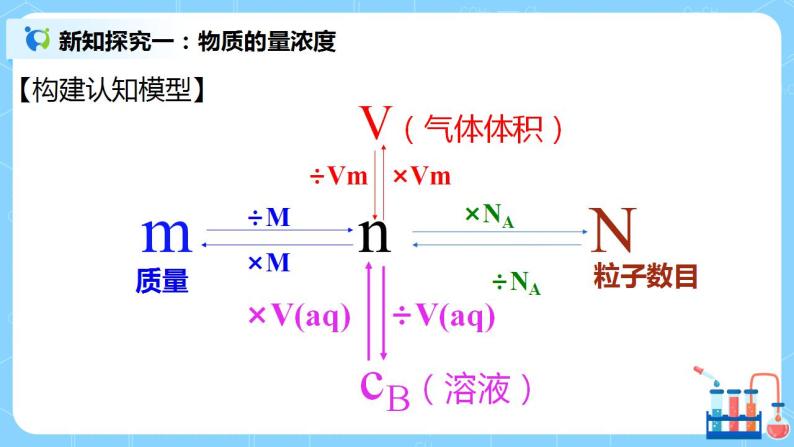
| 一、物质的量浓度 1. (1)含义:用来表示_单位体积溶液中__中所含溶质B的物质的量的物理量。符号为 c(B) ,常用单位为__mol•L-1_。(B表示各种溶质) 通俗地说,它表示的就是每1 L 的溶液中含有多少mol的溶质。 (2)表达式:c(B)=____。如1 L溶液中含有1 mol溶质,溶质的物质的量浓度就是 1 mol·L-1。 2. 判断正误,并说明理由。 ①将1mol NaCl溶于1L水中配成溶液,其物质的量浓度是1mol/L。 错,体积指的是溶液的体积,而不是溶剂的体积。 ②从100mL2mol/L的NaOH溶液中取出50mL,则取出的溶液中溶质的物质的量浓度为1mol/L。 错,在一定物质的量浓度溶液中取出任意体积的溶液,其物质的量浓度不变。 3. 【例题2】将配制500mL0.1mol/LNaOH溶液,需要NaOH的质量是多少? 预设:需要NaOH的质量是2g 4.
二、一定物质的量浓度的配置 1. 认识容量瓶(规格:50ml 100ml 250ml 500ml 1000ml ) 注意事项:①使用前要检查漏、洗涤 ②溶解或稀释的操作不能在容量瓶中进行 ③不能长期存放溶液或进行化学反应 ④选择容量瓶时,要使容量瓶的规格与所配溶液的体积相对应 2.实验目的:配制100mL1.0mol/L的NaCl溶液 步骤:计算→称量→溶解→冷却→移液→洗涤→定容→摇匀→装瓶 3.【思考与讨论1】 ①.如果换成液体试剂配制一定物质的量浓度溶液,溶液配制变成了一个什么问题?原理是什么? ②.配制1.8mol/L稀硫酸100mL,需要量取18mol/L浓硫酸溶液体积是多少? 计算原理:根据稀释前后溶质物质的量不变:c浓∙V浓=c稀∙V稀 注意:配制一定物质的量浓度的稀硫酸不需要托盘天平,但用到量筒量取浓硫酸的体积;浓硫酸加水稀释时放出大量的热,必须要冷却至室温,再转移到容量瓶。 4. 【思考与讨论2】 (1)为什么要用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将溶液也注入容量瓶? (2)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质实际的浓度比所要求的大了还是小了? (3)如果读书时,仰视或者俯视容量瓶上的刻度线,最后配成的溶液中溶质实际的浓度比所要求的大了还是小了? 5.误差分析 ①从溶质的角度分析:例如,导致溶质减少的操作常见的有溶解时溶液溅出烧杯外、烧杯和玻璃棒未洗涤或洗涤液未转移入容量瓶、转移溶液时溶液溅出到容量瓶外等等。若用浓溶液配制稀溶液,用量筒量取一定体积的浓溶液时仰视、把量筒内附着的浓溶液的也洗涤后一起倒入烧杯中,都会使取得的浓溶液体积偏大从而使溶质偏多,配得的溶液浓度偏高 ②、从配制后溶液体积的角度分析,主要在定容阶段。例如,定容时仰视、摇匀后发现液面下降再加水等,会使最终所得溶液体积偏大,从而使配得的溶液浓度偏小。出现这样的情况,只能重新配制。溶液的“热胀冷缩”特点会使溶液冷却后体积变小。
三、课堂练习 1.判断正误(正确的打“√”,错误的打“×”) (1)将40 g NaOH溶解在1 L水中所得溶液的物质的量浓度是1 mol·L-1。 ( ) (2)将25 g CuSO4·5H2O溶解在1 L水中,所得溶液的物质的量浓度为0.1 mol·L-1。( ) (3)把1 mol NH3通入水中得到1 L溶液,其物质的量浓度为1 mol·L-1。 ( ) (4)配制250 mL 0.200 mol/L的NaCl溶液需称量2.9 g NaCl(用托盘天平)。 ( ) 2、配制一定物质的量浓度的溶液时,液面略高于容量瓶的刻度线,则应采取的措施是( ) A.用胶头滴管吸出多余的液体 B.为保证溶液浓度准确,需重新配制溶液 C.液体超过较少,不用处理 D.将容量瓶适当加热,蒸发除去适量水 3. 配制一定物质的量浓度的NaOH溶液时,会造成所配NaOH溶液浓度偏高的是( ) A.所用NaOH已经潮解 B.向容量瓶中加水,未到刻度线 C.没有洗涤烧杯和玻璃棒2~3次 D.称量NaOH固体时,NaOH固体和砝码放错托盘 4. 下列有关操作或判断正确的是( ) A.配制一定物质的量浓度的溶液时,定容时俯视容量瓶刻度线会导致所配溶液浓度偏低 B.用托盘天平称取25.20g NaCl C.用100mL的量筒量取5.2mL的盐酸 D.用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高 | ||
课堂 小结 | 一、物质的量浓度 二、配置一定物质的量浓度的溶液 | ||
板书设计 | 一、物质的量浓度 二、配置一定物质的量浓度的溶液 实验步骤:计算→称量→溶解→冷却→移液→洗涤→定容→摇匀→装瓶 容量瓶的使用 (一)忌用容量瓶进行溶解(体积不准确) (二)忌直接往容量瓶倒液 (三)忌加水超过刻度线 (四)忌读数仰视或俯视 (五)忌不洗涤玻璃棒和烧杯 (六)忌长时间盛放溶液(容量瓶是量器,不是容器 | ||
教学反思 | 本课时主要介绍物质的量浓度的概念,以及学会配制一定物质的量浓度的溶液方法及其步骤。教学中应注意学生难点在于溶液浓度的误差分析上,教导分析思路,结合实际例子启发学生的思维,真正理解溶液配制过程对结果的影响,最后深化溶液浓度的两种表示方法---溶质的质量分数;物质的量浓度。 | ||
高中化学第三节 物质的量教学课件ppt: 这是一份高中化学第三节 物质的量教学课件ppt,共22页。PPT课件主要包含了素养要求,任务1,物质的量浓度,限时训练,任务3等内容,欢迎下载使用。
高中第三节 物质的量优秀ppt课件: 这是一份高中第三节 物质的量优秀ppt课件,共48页。PPT课件主要包含了酒精的度数,物质的量浓度及计算,物质的量浓度,物质的量浓度计算,cK+,mol·L-1,还有什么疑问,课堂小结等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三节 物质的量精品ppt课件: 这是一份人教版 (2019)必修 第一册第三节 物质的量精品ppt课件,共17页。PPT课件主要包含了体积分数,练一练等内容,欢迎下载使用。














