



高中化学人教版 (2019)必修 第一册第三节 物质的量完美版课件ppt
展开1.了解容量瓶的特点、用途及使用注意事项。2.掌握配制一定物质的量浓度的溶液的方法及操作,建立实验误差分析 思维模型,并能应用模型解决实际问题。
1.配制一定物质的量浓度的溶液的方法及操作。2.溶液配制的实验操作和误差分析。
如何配制100 g 质量分数为10%的NaCl溶液?
(1)计算(2)称量:称NaCl的质量,量水的体积 90 mL(90 g)(3)溶解(4)装瓶贴签
如何配制 100 mL 1.00 ml/L 的NaCl溶液?
1.主要仪器托盘天平(或分析天平)、烧杯、玻璃棒、容量瓶、胶头滴管、量筒。2.容量瓶
50 mL、100 mL、250 mL、500 mL、
目标一 一定物质的量浓度溶液的配制
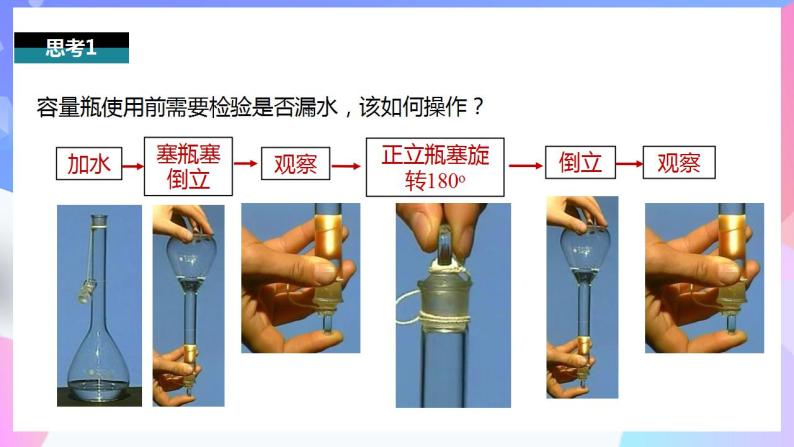
容量瓶使用前需要检验是否漏水,该如何操作?
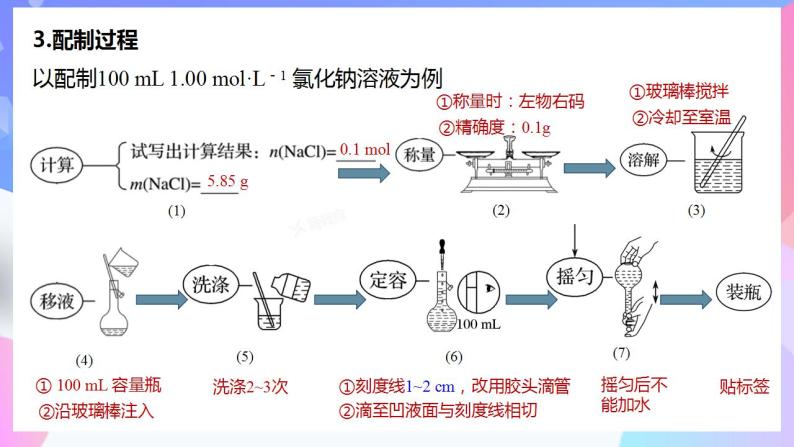
3.配制过程以配制100 mL 1.00 ml·L-1 氯化钠溶液为例
① 100 mL 容量瓶
①刻度线1~2 cm,改用胶头滴管②滴至凹液面与刻度线相切
算称量取步骤清,溶解转移再定容;室温洗涤莫忘记,摇匀贴签移瓶中。
配制一定物质的量浓度的溶液
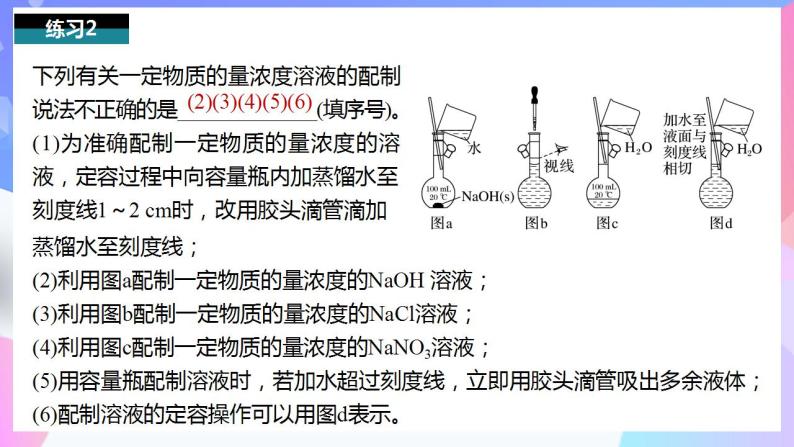
下列有关一定物质的量浓度溶液的配制说法不正确的是______________(填序号)。(1)为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至刻度线1~2 cm时,改用胶头滴管滴加
蒸馏水至刻度线;(2)利用图a配制一定物质的量浓度的NaOH 溶液;(3)利用图b配制一定物质的量浓度的NaCl溶液;(4)利用图c配制一定物质的量浓度的NaNO3溶液;(5)用容量瓶配制溶液时,若加水超过刻度线,立即用胶头滴管吸出多余液体;(6)配制溶液的定容操作可以用图d表示。
(2)(3)(4)(5)(6)
(2)使用容量瓶配制溶液时,不能直接溶解固体,故图a错误;(3)定容时,视线要与凹液面最低点相切,故图b错误;(4)玻璃棒下端应在刻度线以下,故图c错误;(5)用容量瓶配制溶液时,若加水超过刻度线,应重新配制溶液;(6)定容时,液面距刻度线1~2 cm时应改用胶头滴管,故图d错误。
实验室需要配制480 mL 1.00 ml·L-1的氢氧化钠溶液,则用托盘天平称量多少克氢氧化钠固体?
提示 配制氢氧化钠溶液480 mL,需要容量瓶的容积为500 mL。则计算应按照500 mL (0.5 L)计算。则n=c·V=1.00 ml·L-1×0.5 L=0.5 ml,m=n·M=0.5 ml×40 g·ml-1=20 g。托盘天平的精确度为0.1 g,则用托盘天平称量20.0 g氢氧化钠固体。
判断正误(1)配制溶液时,可以用托盘天平称取10 g固体溶质( )(2)要配制480 mL溶液,必须选择500 mL容量瓶( )(3)配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸( )(4)在使用容量瓶配制NaOH溶液或稀H2SO4时,必须要等溶液恢复至室温再转移到容量瓶中( )
(1)容量瓶是配制一定物质的量浓度的溶液的专用仪器,选择容量瓶应遵循“大而近”的原则:所配溶液的体积应等于或略小于容量瓶的容积。(2)使用容量瓶注意“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。
1.误差的分析方法根据cB= 可知,MB为定值(溶质的摩尔质量),实验过程中不规范的操作会导致mB或V的值发生变化,从而使所配制溶液的物质的量浓度产生误差。若实验操作导致mB偏大,则cB偏大;若实验操作导致V偏大,则cB偏小。
目标二 配制一定物质的量浓度的溶液的误差分析
容量瓶定容时仰视、俯视对溶液的浓度产生什么影响?
配制一定物质的量浓度的稀硫酸时,用量筒量取一定体积的浓硫酸时仰视、俯视对溶液的浓度产生什么影响?
提示 ①仰视刻度线(如图c):浓硫酸的体积偏大,即溶液中的溶质硫酸偏多,c偏高。②俯视刻度线(如图d):浓硫酸的体积偏小,即溶液中的溶质硫酸偏少,c偏低。
判断正误(1)称量NaCl固体和NaOH固体都可以用称量纸( )(2)称量NaOH固体时,称量时间过长,所配溶液浓度偏低( )(3)用托盘天平称取药品时药品和砝码位置颠倒,药品质量一定偏低( )(4)配制1 ml·L-1NaOH溶液时未恢复至室温就转移并定容会使所得溶液浓度偏低( )(5)容量瓶内壁附有水珠而未干燥处理就直接用于配制,会使所配溶液浓度偏低( )
①配制盐酸,用量筒量取盐酸时俯视刻度线②转移溶液时不慎将少量液体洒到容量瓶外面③定容时俯视刻度线④未冷却到室温就将溶液转移到容量瓶并定容⑤定容后塞上瓶塞反复摇匀,静置后,发现液面低于刻度线,再加水至刻度线⑥容量瓶内有少量水⑦称量4.0 g NaOH配制0.1 ml·L-1 NaOH溶液1 000 mL时,砝码错放在左盘⑧称量Na2CO3固体时,砝码上有杂质上述操作中,使所配制的溶液浓度偏高的是_______(填序号,下同),无影响的是______,偏低的是_______。
一定物质的量浓度溶液的配制
容量瓶的规格结构与使用注意事项
溶液配制的误差分析步骤
1.实验室中需要配制950 mL 2 ml·L-1的NaOH溶液,配制时应选用的容量瓶的规格和称取的NaOH的质量分别是A.950 mL,96.0 g B.500 mL,80.0 gC.1 000 mL,80.0 g D.1 000 mL,76.0 g
2.下列有关溶液配制的说法正确的是A.用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余的液体B.称取4.0 g NaOH固体于烧杯中,加入少量蒸馏水溶解,转移至250 mL容量 瓶中定容,即可配制0.400 0 ml·L-1的NaOH溶液C.用 、 配制50.00 mL 0.100 0 ml·L-1 Na2CO3溶液D. 配制一定物质的量浓度的氯化钠溶液
未冷却至室温,且未洗涤烧杯和玻璃棒
3.[2020·全国卷Ⅰ,27(1)]由FeSO4·7H2O固体配制0.10 ml·L-1 FeSO4溶液,需要的仪器有药匙、玻璃棒、_______________________(从下列图中选择,写出名称)。
4.某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示。该小组欲使用450 mL 0.2 ml·L-1稀硫酸。配制该浓度的硫酸溶液时:
(1)所需试剂瓶内硫酸溶液的体积为____mL。
(2)所用量筒和容量瓶的规格为__________和______________。
(3)浓硫酸稀释时的操作是__________________________________________________________________________。(4)如图是该小组转移溶液的示意图,图中的错误是______________________________________________。
向烧杯中加入一定量的水,再将浓硫酸沿烧杯内壁
慢慢倒入,并用玻璃棒不断搅拌
②未采用500 mL容量瓶
高中化学人教版 (2019)必修 第一册第三节 物质的量教学ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量教学ppt课件,共23页。PPT课件主要包含了学习目标,相对密度等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量多媒体教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量多媒体教学课件ppt,共18页。PPT课件主要包含了molL,物质的量浓度,天平01g,量筒01mL,容量瓶,cBV,④用途,①结构,②标志,③规格等内容,欢迎下载使用。
人教版 (2019)第三节 物质的量授课课件ppt: 这是一份人教版 (2019)第三节 物质的量授课课件ppt,共24页。PPT课件主要包含了思考与交流,如何配制,电子天平,怎么办到,容量瓶,①刻度线,②容积,③温度20℃,教材P54-55,使用注意事项等内容,欢迎下载使用。













