
- 必修1 第四章 第一节 原子结构与元素周期表(2) 学案 学案 18 次下载
- 必修1 第四章 第一节 原子结构与元素周期表(1)同步练习 学案 12 次下载
- 必修1 第四章 第一节 原子结构与元素周期表(3)同步练习 学案 12 次下载
- 期中试卷讲评 学案 13 次下载
- 期末试卷讲评 学案 16 次下载
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表精品学案
展开原子结构与元素周期表(3)
重难点 | 题型 | 分值 | |
重点 | 1. 了解碱金属、卤素在周期表中的位置。 2. 了解碱金属、卤素原子结构特点,了解原子结构与元素性质的关系。 | 填空和选择 | 6-8分 |
难点 | 了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释。 | ||
核心知识点一:
一、碱金属元素
1. 碱金属元素的原子结构
| 元素 名称 | 元素 符号 | 核电 荷数 | 原子结构 示意图 | 最外层电子数 | 电子 层数 | 原子 半径/nm |
碱金属元素 | 锂 | Li | 3 |
| 1 | 2 | 0.152 |
钠 | Na | 11 |
| 1 | 3 | 0.186 | |
钾 | K | 19 | 1 | 4 | 0.227 | ||
铷 | Rb | 37 | 1 | 5 | 0.248 | ||
铯 | Cs | 55 |
| 1 | 6 | 0.265 | |
结论:碱金属元素原子结构的共同点是最外层电子数均为1,不同点是电子层数和原子半径不同,其变化规律是随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大 | |||||||
2. 碱金属单质的物理性质
元素 | Li、Na、K、Rb、Cs(原子序数增大) | |
相同点 | 除铯外,其余都呈银白色,它们都比较软,有延展性,密度较小,熔点较低,导电、导热性强 | |
递变规律 | 密度 | 逐渐增大(钾反常) |
熔、沸点 | 逐渐降低 | |
个性特点 | ①铯略带金属光泽;②锂的密度比煤油的小;③钠的密度比钾大 | |
3. 碱金属单质的化学性质
(1)碱金属与氧气的反应
①实验现象:都能在空气中燃烧,钠产生黄色火焰(透过蓝色钴玻璃观察),钾产生紫色火焰,钾燃烧更剧烈。
②反应方程式:2Na+O2Na2O2、K+O2KO2。
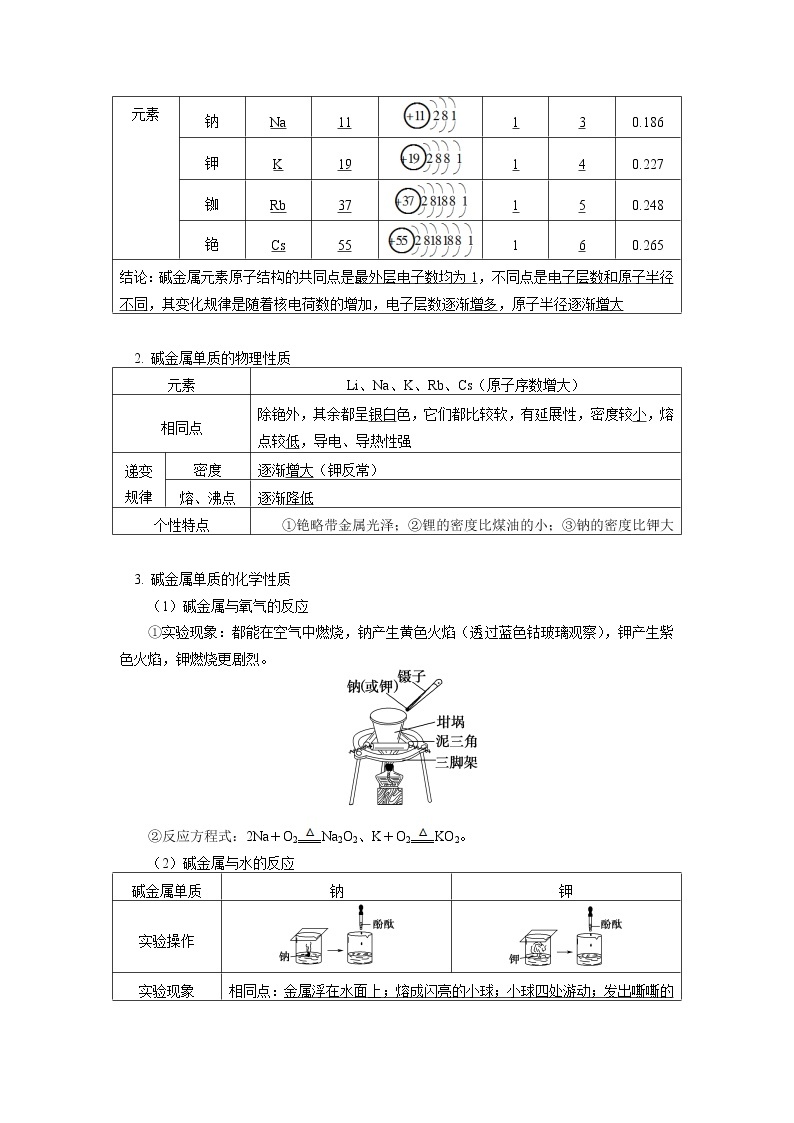
(2)碱金属与水的反应
碱金属单质 | 钠 | 钾 |
实验操作 | ||
实验现象 | 相同点:金属浮在水面上;熔成闪亮的小球;小球四处游动;发出嘶嘶的响声;反应后的溶液呈红色, 不同点:钾与水的反应有轻微爆炸声并着火燃烧 | |
实验原理 | 2Na+2H2O===2NaOH+H2↑ | 2K+2H2O===2KOH+H2↑ |
实验结论 | 与水反应剧烈程度:K>Na; 金属的活泼性:K>Na | |
4. 碱金属元素的原子结构与性质的关系
(1)相似性(R表示碱金属元素)
原子都容易失去最外层的一个电子,化学性质活泼,它们的单质都具有较强的还原性,它们都能与氧气等非金属单质及水反应。碱金属与水反应的通式为2R+2H2O===2ROH+H2↑。
(2)递变性
随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,碱金属元素的原子失电子能力逐渐增强,金属性逐渐增强。
①
②与O2的反应越来越剧烈,产物更加复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成 Na2O2,而K与O2反应能够生成KO2等。
③与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
④最高价氧化物对应水化物的碱性逐渐增强,CsOH的碱性最强。
核心知识点二
一、卤族元素
1. 卤族元素的原子结构
①随着原子序数的递增,卤族元素原子核外电子层数依次增多,原子半径逐渐增大。
原子最外层电子数相同,都为7,都易得到1个电子,单质具有较强的氧化性
2. 卤素单质的物理性质
| F2 | Cl2 | Br2 | I2 |
颜色、 状态 | 淡黄绿色 气体 | 黄绿色 气体 | 深红棕色 液体 | 紫黑色 固体 |
密度 | 逐渐增大 | |||
熔、沸点 | 逐渐升高 | |||
卤素的原子结构特点
相同点 | ①卤族元素位于周期表第ⅦA族; ②最外层上都有7个电子。 |
递变性 | 从F→I核电荷数依次增大,电子层数依次增多,原子半径依次增大 |
3. 卤素单质的化学性质
(1)卤素单质与氢气的反应
卤素单质 | 反应条件 | 化学方程式 | 产物稳定性 |
F2 | 暗处 |
| 很稳定 |
Cl2 | 光照或点燃 | 较稳定 | |
Br2 | 加热 | 不如氯化氢稳定 | |
I2 | 不断加热 | 不稳定 | |
结构 | 从F2到I2,与H2反应所需要的条件逐渐升高,反应剧烈程度依次减弱,生成气态化物的稳定性依次减弱 | ||
(2)卤素单质之间的置换反应
实验操作 | 实验现象 | 化学方程式 |
静置后,液体分层,上层接近无色,下层呈橙色 | Cl2+2NaBr===2NaCl+Br2 | |
静置后,液体分层,上层接近无色,下层呈棕黄色 | Cl2+2KI=== 2KCl+I2 | |
静置后,液体分层,上层接近无色,下层呈棕黄色 | Br2+2KI=== 2KBr+I2 | |
结论 | Cl2→I2氧化性逐渐减弱,相应卤素离子还原性逐渐增强 | |
微点拨:因为F2能与H2O发生反应(2F2+2H2O===4HF+O2),所以F2不能从其他卤化物的盐溶液中置换出卤素单质。
4. 卤素的原子结构与化学性质的关系
(1)相似性(X表示卤素元素)
卤素原子都容易得到一个电子使其最外层达到8个电子的稳定结构,它们的单质都是活泼的非金属单质,都具有较强的氧化性。
(1)与H2反应:X2+H22HX。
(2)与活泼金属(如Na)反应:2Na+X22NaX。
(3)与H2O反应
①X2+H2O===HX+HXO(X=Cl、Br、I);
②2F2+2H2O===4HF+O2。
(4)与NaOH溶液反应
X2+2NaOH===NaX+NaXO+H2O(X=Cl、Br、I)。
(2)递变性(X表示卤素元素)
随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,卤素原子得电子的能力逐渐减弱,非金属性逐渐减弱。
①
与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,即:稳定性:HF>HCl>HBr>HI;还原性:HF<HCl<HBr<HI。
②卤素单质与变价金属(如Fe)反应时,F2、Cl2、Br2生成高价卤化物(如FeX3),而I2只能生成低价卤化物(如FeI2)。
③氢化物都易溶于水,其水溶液酸性依次增强,氢化物中HCl、HBr、HI的熔、沸点依次升高,HF的熔、沸点最高。
④最高价氧化物的水化物的酸性逐渐减弱,即酸性:HClO4>HBrO4>HIO4,HClO4是已知含氧酸中酸性最强的酸。
核心知识点一:
下列关于碱金属按Li、Na、K、Rb、Cs的顺序叙述中不正确的是( )
A. 碱金属原子最外层都只有一个电子,在化学反应中容易失电子表现出强还原性
B. 单质的熔点和沸点依次递减
C. 单质都能与水反应生成碱,都能在空气中燃烧生成过氧化物
D. 原子半径逐渐增大,单质与水反应的剧烈程度逐渐增强
【答案】C
【解析】金属锂在空气中燃烧只生成氧化物。
【考点】碱金属的性质
下列叙述不正确的是( )
A. 锂与水反应不如钠与水反应剧烈
B. 还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠
C. 熔、沸点:Li>Na>K
D. 碱性:LiOH<NaOH<KOH
【答案】B
【解析】A中锂的活泼性比钠弱,与水反应不如钠剧烈;B中还原性,K>Na>Li,但K不能置换出NaCl溶液中的Na,而是先与H2O反应;C中碱金属元素从Li到Cs,熔、沸点逐渐降低,即Li>Na>K>Rb>Cs;D中从Li到Cs,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物的碱性依次增强,即碱性:LiOH<NaOH<KOH<RbOH<CsOH。
【考点】碱金属的性质
核心知识点二:
下列说法正确的是( )
A. F、Cl、Br原子的最外层电子数都是7,次外层电子数都是8
B. 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律
C. 酸性:HFO4>HClO4>HBrO4>HIO4
D. 砹是原子序数最大的卤族元素,根据卤素性质的相似性,砹微溶于水,易溶于CCl4
【答案】D
【解析】F的次外层电子数为2,Br的次外层电子数为18,A项错误;元素的非金属性强弱可以根据其最高价氧化物对应水化物的酸性强弱比较,不能根据氢化物的酸性强弱比较,B项错误;F无正化合价,不能形成HFO4,C项错误;由碘微溶于水、易溶于四氯化碳可推知,砹微溶于水,易溶于CCl4,D项正确。
【考点】卤素的化学性质
关于卤素(用X表示)的下列叙述正确的是( )
A. 卤素单质与水反应均可用X2+H2O===HXO+HX表示
B. HX热稳定性随核电荷数增加而增强
C. 卤素单质的颜色从F2→I2随相对分子质量增大而逐渐加深
D. X-的还原性依次为F-<Cl-<Br-<I-,因此相对分子质量小的卤素单质可将相对分子质量大的卤素从其盐溶液中置换出来
【答案】C
【解析】2F2+2H2O===O2+4HF,A错;HX热稳定性随核电荷数增加而减弱,B错;F2优先与水反应,故不能用F2从其他盐溶液中置换出来卤素单质,D错。
【考点】卤素的化学性质
(答题时间:25分钟)
选择题:本题包括12小题,每小题4分,共48分。
1. 我国西部地区蕴藏着丰富的锂资源,开发锂的用途是一个重要的科学课题。关于锂的叙述不正确的是( )
A. 锂是较轻的金属
B. LiOH的碱性比NaOH弱
C. 锂的金属性比钠强
D. 锂在空气中燃烧生成Li2O
2. 按氟、氯、溴、碘顺序,下列说法不正确的是( )
A. 它们的单质的熔、沸点逐渐升高
B. 原子半径逐渐增大,单质氧化性逐渐增强
C. 单质的颜色逐渐加深
D. 它们气态氢化物的稳定性逐渐减弱
3. 下列有关碱金属元素的叙述正确的是( )
A. 碱金属单质均为银白色,密度均小于水
B. 碱金属单质从Li到Cs,熔点依次升高
C. 氢氧化铯碱性强于氢氧化钠
D. 碱金属元素形成的阳离子,从Li+到Cs+氧化性依次增强
4. 向含有NaBr和KI的混合溶液中通入过量Cl2,充分反应后将溶液蒸干并灼烧所得物质,最后剩余的固体是( )
A. NaCl和KI B. NaCl、KCl、I2
C. KCl和NaBr D. KCl和NaCl
5. (1)卤素氢化物中最不稳定的是________(写化学式)。
(2)下列两个族的元素,单质熔、沸点随原子序数递增而升高的是________(填序号)。
A. 碱金属 B. 卤素
(3)下列反应中,更剧烈的是________(填序号)。
A. 钠与水反应 B. 钾与水反应
(4)取下列溶液分装两试管,再分别依次加入少量氯水和少量四氯化碳,用力振荡、静置后,四氯化碳层显紫红色的是________(填序号)。
A. 溴化钠溶液 B. 碘化钾溶液
1. 答案:C
解析:锂比钠的活泼性弱,在空气中燃烧只生成Li2O,LiOH的碱性比NaOH弱,锂的金属性比钠弱,C项错误。
2. 答案:B
解析:氟、氯、溴、碘的单质的熔、沸点逐渐升高,A正确;氟、氯、溴、碘同为第ⅦA族元素,同主族从上到下,原子半径逐渐增大,非金属性逐渐减弱,因此单质氧化性逐渐减弱,B错误;氟、氯、溴、碘的单质的颜色逐渐加深,C正确;非金属性F>Cl>Br>I,非金属性越强,氢化物越稳定,则它们气态氢化物的稳定性逐渐减弱,D正确。
3. 答案:C
解析:碱金属单质中除了Rb、Cs,其他的密度均小于水,Cs略带金属光泽,其他的都是银白色的,A错误;碱金属单质从Li到Cs,熔点依次降低,还原性依次增强,形成的阳离子的氧化性依次降低,对应的氢氧化物碱性依次增强,C正确,B、D错误。
4. 答案:D
解析:过量的Cl2将I-、Br-从溶液中完全置换出来,在蒸干、灼烧过程中溴挥发、碘升华,所得固体为NaCl和KCl。此题也可利用Cl2、Br2、I2活泼性强弱用排除法选出D项。
5. 答案:(1)HI (2)B (3)B (4)B
解析:卤素中碘元素的非金属性最弱,氢化物最不稳定的是HI;碱金属元素单质熔、沸点随原子序数递增而降低,卤素单质熔、沸点随原子序数递增而升高;钾比钠活泼,与水反应更剧烈;氯水与NaBr、KI溶液分别生成Br2、I2,而二者的四氯化碳溶液分别为橙色、紫红色。
2020-2021学年第一节 糖类导学案: 这是一份2020-2021学年第一节 糖类导学案,共10页。学案主要包含了糖类的组成和分类,二糖和多糖等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 原电池导学案及答案: 这是一份人教版 (2019)选择性必修1第一节 原电池导学案及答案,共21页。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表优秀导学案: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表优秀导学案,共3页。













