






高中人教版 (新课标)第三章 金属及其化合物第二节 几种重要的金属化合物授课ppt课件
展开(1)氧化钠与过氧化钠Na2O+H2O==2NaOH
想一想:那么过氧化钠呢?
因此过氧化钠可以做供氧剂,用于呼吸面具和潜水艇中作为氧气来源。
附表1:氧化钠与过氧化钠的比较
白色固体 淡黄色固体
-2价 -1价
常温 点燃、加热
不稳定 稳定
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
强氧化性、漂白性
供氧剂、漂白剂
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
1.碳酸钠和碳酸氢钠 [(1)溶解性探究]
白色粉末,加水后结块变成晶体,放热明显。
细小的白色晶体,加水部分溶解,放热不明显。
加水先变成含结晶水的晶体,溶解度较大,碱性较强。
加水部分溶解 ,溶解度比Na2CO3小,碱性比Na2CO3弱。
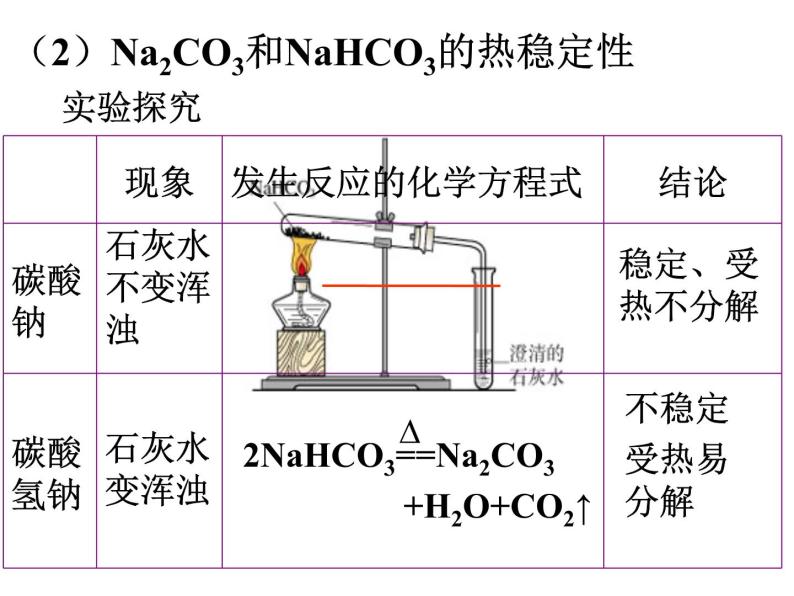
2NaHCO3==Na2CO3+H2O+CO2↑
(2)Na2CO3和NaHCO3的热稳定性
加热2.74gNa2CO3和NaHCO3的混合物至质量不再变化,剩余固体质量为2.12g。则混合物中Na2CO3的质量分数是( )% %% %
解:设碳酸氢钠的质量为x,
2NaHCO3==Na2CO3+H2O+CO2↑ △m2ml 1ml 1ml
168g/62g==x/0.62gx=1.68g
W=(2.74-1.68)g/2.74g×100%=38.69%
2×84g 18g 44g
62g
x (2.74-2.12)g
Na2CO3和NaHCO3性质比较
白色粉末Na2CO3•XH2O为晶体
可溶于水溶 解度小于碳酸钠
2 NaHCO3== Na2CO3+H2O+CO2↑
Na2CO3+2HCl= 2NaCl+H2O+CO2↑CO32-+2H+=H2O+CO2↑
NaHCO3+HCl= NaCl+H2O+CO2↑(快) HCO3-+H+=H2O+CO2 ↑
Na2CO3+Ca(OH)2= CaCO3↓+2NaOHNa2CO3+NaOH不反应
2NaHCO3+Ca(OH)2= CaCO3↓+Na2CO3+2 H2O
NaHCO3+NaOH= Na2CO3+H2O
Na2CO3+CaCl2= CaCO3↓+ 2NaCl
Na2CO3+BaCl2= BaCO3↓+ 2NaCl
CO2+H2O或少量H+
固(∆)、溶液(加NaOH)
怎样鉴别碳酸钠和碳酸氢钠
⑴ 加热固体。产生能使石灰水变浑浊的无色气体的是碳酸氢钠。
2NaHCO3 = Na2CO3 + H2O + CO2
⑶ 在固体中加入相同浓度的盐酸,反应剧烈的 是碳酸氢钠。
Na2CO3 + CaCl2 = 2NaCl + CaCO3
⑵ 溶解,加入氯化钙溶液,产生沉淀的是碳酸钠。
焰色反应 很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色 ,这在化学上叫做焰色反应。此过程属物理变化。 通过焰色反应可以检验某些金属元素的存在,可以利用金属元素的焰色反应制成节日的烟花。
常见金属元素焰色反应的颜色:钠(Na):黄色 钾(K):紫色
操作步骤:铂丝或铁丝在火焰上灼烧至与火焰颜色相同→蘸取样品→在外焰上灼烧观察现象→盐酸洗净→重复第一步
助记词钠黄钾紫钙砖红锶洋红、钡黄绿铜绿铷紫锂紫红
焰色反应:⑴焰色反应为物理变化过程。⑵焰色现象与金属元素的存在有关,与物质组成无关。如:钠元素的焰色为黄色,包括钠单质以及钠的所有化合物。⑶K的焰色要通过蓝色钴玻璃片看,目的是滤去黄色的光。
例:在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( ) A.溶液中Na+浓度增大,有O2放出 B.溶液的OH-浓度不变,有H2放出 C.溶液中Na+数目减小,有O2放出 D.溶液的OH-浓度增大,有O2放出
解释:注意题中“饱和”、“过氧化钠”、“原温度”等关键条件。
往饱和的碳酸钠溶液中通入过量的二氧化碳,有何现象?为什么?
Na2CO3 + H2O + CO2 = 2NaHCO3
反应后,溶质质量增大,
现象:溶液变浑浊,静置后析出白色晶体!
碳酸氢钠既能与强酸溶液反应,又能与强碱溶液反应。 请写出有关反应的离子方程式。
HCO3- + H+ = H2O + CO2
HCO3- + OH- = H2O + CO32-
[例2] 今向100g 8%的NaOH溶液中通入CO2,生成的盐的质量为13.7g 时,通入了多少克的CO2?
2NaOH + CO2 = Na2CO3 + H2O
∵ 16.8g > 13.7g > 10.6g
首先要分析产物是Na2CO3,还是NaHCO3 , 还是两者的混和物
NaOH + CO2 = NaHCO3
B = 16.8g
∴ 生成的盐是Na2CO3 和 NaHCO3 的混和物
高中化学人教版 (2019)必修 第一册第二节 金属材料教课内容课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料教课内容课件ppt,共29页。
化学必修1第一节 化学实验基本方法背景图ppt课件: 这是一份化学必修1第一节 化学实验基本方法背景图ppt课件,共24页。PPT课件主要包含了一蒸馏,导学探究,由左到右,石棉网,沸石或碎瓷片,蒸馏或过滤,接通冷凝管中的水,水从下口进上口出,二萃取和分液,互不相溶等内容,欢迎下载使用。
人教版 (新课标)必修1第二节 几种重要的金属化合物评课课件ppt: 这是一份人教版 (新课标)必修1第二节 几种重要的金属化合物评课课件ppt,共32页。PPT课件主要包含了铝的重要化合物,红宝石Al2O3,蓝宝石Al2O3,2化学性质,3用途,氢氧化铝,物理性质,化学性质,铝三角关系,生成白色沉淀等内容,欢迎下载使用。













