



化学必修1第二节 几种重要的金属化合物课文课件ppt
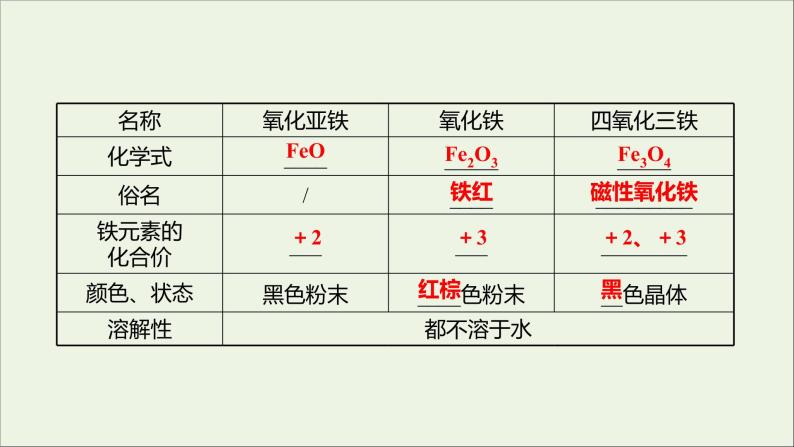
展开一、铁的主要化合物1.铁的氧化物(1)铁的存在:铁在地壳中的含量居于第四位,主要以________价的化合物的形式存在。(2)铁的氧化物①物理性质
②化学性质a.稳定性:Fe2O3、Fe3O4较稳定;FeO不稳定,受热被氧化为_____。b.与酸反应:FeO、Fe2O3是____氧化物,与盐酸反应的离子方程式分别为FeO: _______________________;Fe2O3 :__________________________。③用途a.与颜色有关的是______。b.与氧化性有关的是___。ⅰ.作油漆,ⅱ.涂料,ⅲ.赤铁矿是炼铁原料。
FeO+2H+===Fe2++H2O
Fe2O3+6H+===2Fe3++3H2O
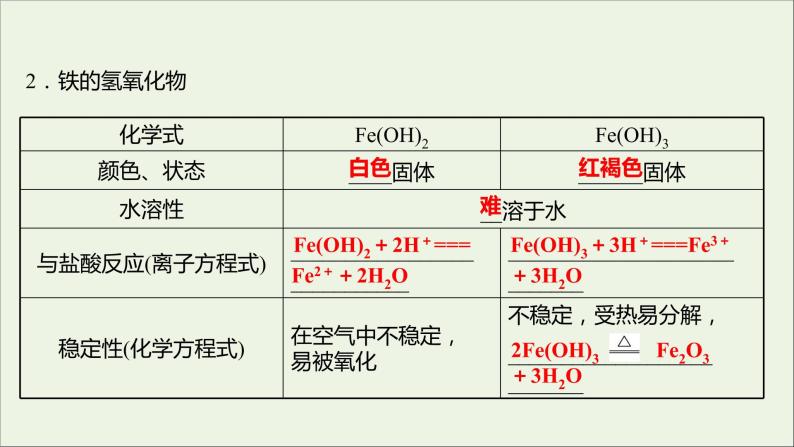
Fe(OH)2+2H+===
Fe(OH)3+3H+===Fe3+
2Fe(OH)3 Fe2O3
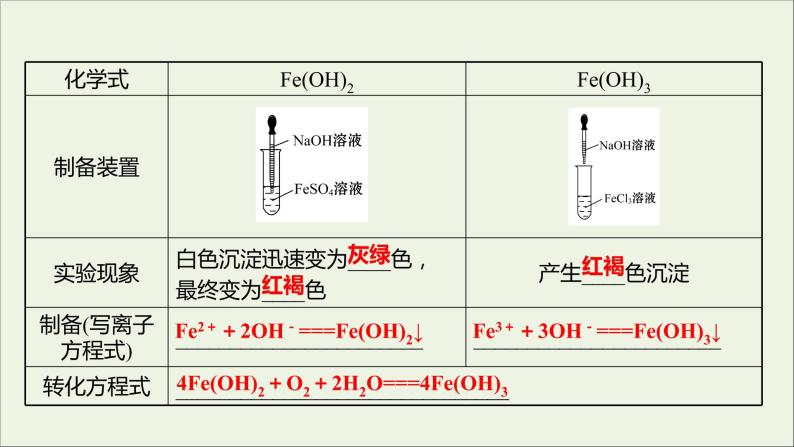
Fe2++2OH-===Fe(OH)2↓
Fe3++3OH-===Fe(OH)3↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3
3.铁盐和亚铁盐(1)Fe3+、Fe2+的检验
(2)Fe3+、Fe2+的相互转化①实验操作
②实验现象:溶液由棕黄色→浅绿色→溶液_________→溶液变成____。③反应的离子方程式依次为a.__________________,b.________________________,c.Fe3++3SCN-===Fe(SCN)3。④结论:
Fe+2Fe3+===3Fe2+
2Fe2++Cl2===2Fe3++2Cl-
(3)铁盐的净水作用:向混有少量泥沙的浑浊水中加入少量Fe2(SO4)3,浑浊水会变____。
(1)(情境思考)丹霞地貌即以陆相为主的红层发育的具有陡崖坡的地貌,也可表述为“以陡崖坡为特征的红层地貌”。丹霞地貌为什么显红色呢?提示:因为含有Fe2O3。Fe2O3为红棕色固体。
(2)(知识前后串联)试从化合价的角度分析Fe、FeSO4、Fe2(SO4)3三种物质中,哪种物质可作氧化剂?哪种物质可作还原剂?哪种物质既可作氧化剂又可作还原剂?三种物质可进行转化吗?提示:Fe2(SO4)3中Fe的化合价为+3,可作氧化剂;Fe的化合价为0,只作还原剂;FeSO4中Fe的化合价为+2,既作氧化剂又作还原剂。Fe+Fe2(SO4)3===3FeSO4。
(3)判断下列说法是否正确。①(2018·全国卷Ⅱ)向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化;该实验过程可用来探究维生素C的还原性( )提示:氯化铁具有氧化性,能氧化维生素C,颜色由棕黄色变为浅绿色。②(2018·北京卷)将NaOH溶液滴入FeSO4溶液中,观察到产生白色沉淀,随后变为红褐色;该实验中的颜色变化与氧化还原反应无关( )提示:白色沉淀变为红褐色是氢氧化亚铁被氧化的过程。
③(2019·天津卷)将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2( )提示: FeCl2溶液与Cl2可发生反应生成FeCl3,铁还原生成的Fe3+为Fe2+。
(4)(教材二次开发)教材中描述“白色的氢氧化亚铁[Fe(OH)2]被空气里的氧气氧化成了红褐色的氢氧化铁[Fe(OH)3]”,为防止制备的Fe(OH)2变质,可采取哪些措施?提示:①Fe2+必须是新制的,并放入Fe粉,以防Fe2+被氧化成Fe3+。②除去溶液中溶解的O2,其方法是加热煮沸NaOH溶液。③长胶头滴管末端插入试管内的液面以下。④在FeSO4溶液液面上加植物油或苯进行液封。
二、铜盐1.物理性质硫酸铜、氯化铜、硝酸铜等铜盐溶于水;铜绿的主要成分是____________,其难溶于水。2.化学性质(1)铜的化学性质______,使用铜器皿比较安全。(2)铜盐属于重金属盐,都有毒,原因是铜离子能与蛋白质作用,使蛋白质____而失去生理活性。
Cu2(OH)2CO3
(情境思考)1878年,美洲大陆的葡萄园突然爆发了霉叶病,很快就蔓延到查尔斯的葡萄园。看着葡萄藤的枝叶一天天凋零枯萎,查尔斯心急如焚,到处求医问药。后来,在一位化学家的指点下,查尔斯用蓝矾、生石灰和水调制了“波尔多液”喷洒到葡萄藤上。葡萄园很快就恢复了生机,又是一片郁郁葱葱的景象。“波尔多液”是怎样进行杀菌的?提示:Cu2+使蛋白质凝固变性。妨碍了代谢作用的正常进行。
(1)(思维升华)为什么在配制FeCl2溶液时,通常加入铁粉?(宏观辨识与微观探析)提示:防止溶液中的Fe2+被氧化成Fe3+,即将溶液中可能存在的Fe3+再还原成Fe2+。
(2)(情境应用)印刷电路板的过程:在复合物材料板上单面附有一薄层铜板,印刷电路时将电路部分以抗腐蚀的涂料印在铜板一面上,放入三氯化铁溶液中,没有印刷上涂料的铜被腐蚀掉,最后只剩下电路部分。上述过程发生的反应中FeCl3表现什么性质?如何证明最后的腐蚀液是否还含有FeCl3?(科学探究与创新意识)
提示:腐蚀电路板时发生反应2Fe3++Cu===2Fe2++Cu2+, FeCl3表现氧化性。用洁净的试管取少量的样品溶液,向其中滴入KSCN溶液1~2滴,若溶液立即显红色证明含有Fe3+。
【典例】(2020·大连高一检测)几种物质间的相互转化关系如图所示:
【母题追问】(1)如何除去FeCl3溶液中的Fe2+?提示:向溶液中通入适量Cl2,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。(2)整个转化过程涉及几个氧化还原反应?分别是哪几个?提示:有4个。分别是A→B;B→D;D→B;G→H。
1.(2020·银川高一检测)下列物质反应后一定有+3价铁生成的是( )①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中A.只有① B.只有①③C.只有①②③ D.全部
【解析】选B。①中的Cl2氧化性强,它能将铁氧化为+3价,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原。②中Fe与稀硫酸反应只能生成Fe2+。③在溶液中Fe2+被Cl2氧化生成Fe3+。④中首先发生Fe与盐酸生成FeCl2、Fe2O3与盐酸生成FeCl3的反应,但题中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
2.“秦砖汉瓦”是我国传统建筑文化的一个缩影。汉代瓦当是以动物装饰最为优秀;秦宫遗址出土的巨型瓦当是以动物变形图案,与铜器、玉器风格十分相近。秦砖汉瓦都是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能是( )
A.土壤中含有铁粉、二氧化锰等B.黑砖瓦是煅烧过程中附着了炭黑,红砖则是添加了红色耐高温染料C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色CuD.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3【解析】选D。黏土中含有Fe元素,在烧制砖瓦时,与O2反应,生成氧化物,Fe元素的氧化物有3种,FeO与Fe3O4为黑色,Fe2O3为红棕色,D项正确。
1.(思维升华)“硫酸铁等含有Fe3+的盐溶液遇到KSCN溶液时变成红色”,该红色物质是沉淀吗?提示:不是沉淀,是Fe3+和SCN-生成Fe(SCN)3。
2.(情境应用)化学老师在课堂上演示了一个“血手印”魔术。预先在手上喷上KSCN溶液,然后印在白纸上晾干。用FeCl3溶液喷洒白纸,白纸立刻出现红色血手印。这个现象与FeCl3的性质有什么关系?有什么用途?提示:该魔术利用Fe3+与SCN-结合生成红色Fe(SCN)3,该现象可用于Fe3+的检验。
3.(情境应用)人体易吸收二价铁盐,难吸收三价铁盐。通过学习了解到Fe2+和Fe3+可以互相转化,现提供的物质有FeCl2溶液、FeCl3溶液、Fe粉、KSCN溶液、3%H2O2,请你完成实验报告证明Fe2+和Fe3+的互相转化。(已知:H2O2可氧化Fe2+)(科学探究与创新意识)
【解析】(1)能使硫氰化钾显示红色的是铁离子,将KSCN溶液滴入盛有FeCl2溶液的试管中,无明显现象,再加入双氧水,亚铁离子被氧化剂双氧水氧化为铁离子,会变红色,此时可以证明亚铁离子被氧化为铁离子;(2)在盛有足量Fe粉的试管中滴入FeCl3溶液,此时金属铁和三价铁之间可以反应生成亚铁离子,溶液由棕黄色变为浅绿色,再加入KSCN溶液,充分振荡无现象,此时Fe3+被Fe粉还原成Fe2+。
【典例】(2021·天津河西区高一检测)下列有关Fe2+及Fe3+的检验方法合理的是( )A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+B.向某溶液中通入Cl2,然后再加入KSCN溶液,溶液变为红色,说明原溶液中含有Fe2+C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+D.向某溶液中加入NaOH溶液,得到白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
【解析】选C。Fe3+与KSCN溶液作用的离子方程式为Fe3++3SCN-===Fe(SCN)3(红色),而Fe2+与KSCN溶液不反应,如果该溶液既含Fe3+,又含Fe2+,滴加KSCN溶液,溶液呈红色,证明含有Fe3+而不能证明不含Fe2+,故A错误。若原溶液中含Fe2+,通入Cl2,氯气将Fe2+氧化成Fe3+,滴加KSCN溶液后显红色;若原溶液中不含Fe2+,含有Fe3+,通入Cl2,加入KSCN溶液同样可以变为红色,故B错误。加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+,故C正确。氢氧化镁为白色沉淀,能被红褐色沉淀掩盖,无法确定,故D错误。
提示:不可以。步骤a中不能选用盐酸,原因是酸性KMnO4溶液可以氧化盐酸。
1.(2020·大兴区高一检测)下列反应结束后,向其中滴加KSCN溶液,溶液变成血红色的是( )A.铁锈与过量稀盐酸B.FeCl3溶液与过量铜片C.FeCl3溶液与过量铁粉D.FeCl2溶液与过量锌粉
【解析】选A。铁锈与过量稀盐酸反应生成FeCl3,溶液中存在铁离子,向其中滴加KSCN溶液,溶液变成血红色,故A正确;FeCl3溶液与过量铜片反应生成FeCl2,溶液中不存在铁离子,向其中滴加KSCN溶液,溶液不变血红色,故B错误;FeCl3溶液与过量铁粉反应生成FeCl2,溶液中不存在铁离子,向其中滴加KSCN溶液,溶液不变血红色,故C错误;FeCl2溶液与过量锌粉生成ZnCl2和Fe,溶液中不存在铁离子,向其中滴加KSCN溶液,溶液不变血红色,故D错误。
2.“朱门酒肉臭,路有冻死骨”折射出阶层的差异,“朱门”是豪门的象征,朱门油漆往往与Fe2O3有关。
加入KSCN溶液,再加入氯水
1.《唐本草》记载“本来绿色,新出窟未见风者,正如琉璃。陶及今人谓之石胆,烧之赤色,故名绛矾矣”。文中“绛矾”为( )A.FeSO4·7H2O B.CuSO4·5H2OC.Na2SO4·10H2O D.KAl(SO4)2·12H2O【解析】选A。依据题中描述,晶体本来为绿色,加热后得到红色固体,所以该晶体为FeSO4·7H2O。
2.第五套人民币在票面文字、号码等处所采用的磁性油墨中含有一种金属氧化物,它在磁码识别器上有磁性信号反应,以此可辨别真伪。该金属氧化物是( )A.FeO B.CuOC.Fe3O4 D.Al2O3【解析】选C。根据信息知道该氧化物具有磁性,选项中,具有磁性的物质是四氧化三铁,是磁铁矿的主要成分。
3.(2020·济南高一检测)证明某溶液只含有Fe2+而不含有Fe3+的实验方法是( )A.先滴加氯水,再滴加KSCN溶液后显红色B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色C.滴加NaOH溶液,先产生白色沉淀,后变为灰绿色,最后呈红褐色D.只需滴加KSCN溶液【解析】选B。Fe2+和Fe3+检验设计是常考的热点。设计的步骤:先加KSCN溶液,无现象,可证明溶液中不含Fe3+,然后再滴加氯水,若溶液呈红色,说明溶液中含有Fe2+。
4.(教材二次开发·教材习题改编)制印刷电路板时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu===2FeCl2+CuCl2。向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列判断一定错误的是( )A.烧杯中有铜、无铁 B.烧杯中有铁、无铜C.烧杯中铁、铜都有 D.烧杯中铁、铜都无【解析】选B。溶液中有Cu2+而Fe有剩余是不可能的,因为Fe能与Cu2+反应生成Cu,故B项错误。
(2)“服用维生素C,可使食品中的三价铁离子还原成二价铁离子”这句话指出维生素C具有什么性质?(3)某同学根据铁元素价态特点,提出这样一个观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉足量时产物是FeCl2,为验证该观点是否正确,该同学将一定质量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:①提出假设假设1:该固体物质是FeCl2。假设2:该固体物质是FeCl3。
②设计实验方案取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:(完成下表)
【解析】(1)将Fe2+转化成Fe3+,需用氧化剂Cl2;将Fe3+转化成Fe2+,加入铁粉或铜粉均可以实现。(2)维生素C将Fe3+→Fe2+,说明维生素C具有还原性,作还原剂。(3)Cl2与铁粉反应,产物可能是FeCl3或FeCl2,加入KSCN溶液呈红色可证明有Fe3+,加入酸性KMnO4溶液,若溶液紫色不褪去或不变浅,证明不含Fe2+。答案:(1)①氯水 2Fe2++Cl2===2Fe3++2Cl- ②铁粉(或铜粉) 2Fe3++Fe===3Fe2+(或2Fe3++Cu===2Fe2++Cu2+) (2)还原性
第三章 金属及其化合物 金属及其化合物 第13讲 铁及其重要化合物: 这是一份第三章 金属及其化合物 金属及其化合物 第13讲 铁及其重要化合物,文件包含第13讲铁及其重要化合物pptx、第13讲铁及其重要化合物docx等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
人教版 (新课标)必修1第二节 几种重要的金属化合物教学课件ppt: 这是一份人教版 (新课标)必修1第二节 几种重要的金属化合物教学课件ppt,共1页。
人教版 (新课标)必修1第二节 几种重要的金属化合物教学ppt课件: 这是一份人教版 (新课标)必修1第二节 几种重要的金属化合物教学ppt课件,共60页。PPT课件主要包含了概念认知·自主学习,能力形成·合作探究,学情诊断·课堂检测等内容,欢迎下载使用。













