

高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化优秀学案设计
展开【教材梳理】
一、化学能转化为电能
1.化学能间接转化为电能——火力发电
(1)过程
化学能eq \(――→,\s\up9(燃料燃烧))热能eq \(――→,\s\up9(蒸汽轮机))机械能eq \(――→,\s\up9(发电机))电能
(2)关键——燃烧(氧化还原反应)
2.化学能直接转化为电能——化学电池
(1)实验探究
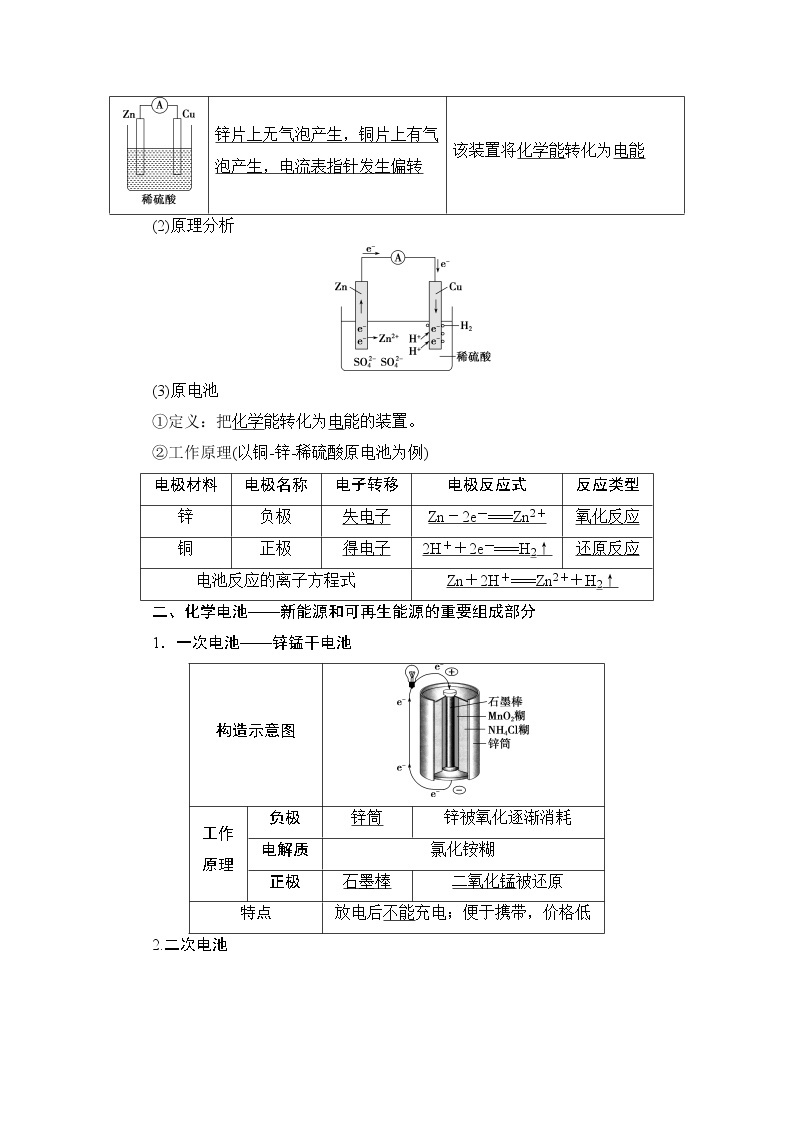
(2)原理分析
(3)原电池
①定义:把化学能转化为电能的装置。
②工作原理(以铜锌稀硫酸原电池为例)
二、化学电池——新能源和可再生能源的重要组成部分
1.一次电池——锌锰干电池
2.二次电池
3.发展中的燃料电池
【自主检测】
1.判断正误(正确的打“√”,错误的打“×”)
(1)火力发电过程经过了化学能转化为热能,热能转化为动能,动能转化为电能的过程。( )
(2)原电池工作时电子从正极流出。( )
(3)原电池中的阴离子移向正极。( )
(4)HCl+NaOH===NaCl+H2O是放热反应,可以设计成原电池。( )
(5)原电池中的负极反应一定是电极材料失电子。( )
(6)任何氧化还原反应都可设计成原电池。( )
答案:(1)√ (2)× (3)× (4)× (5)× (6)×
2.下列装置中,能构成原电池的是( )
A.只有甲 B.只有乙
C.只有丙 D.除乙均可以
解析:选C。甲装置不能构成闭合回路,乙装置两极材料相同,丁装置酒精是非电解质,只有丙装置具备原电池的构成条件。
学习任务1 原电池的构成条件及正负极的判断方法
1.原电池的构成条件
记忆口诀:两极一液一连线,自发的氧化还原反应定中心。
2.原电池的工作原理
(1)两反应:正极——还原反应;负极——氧化反应。
(2)三方向
①电流方向:正极→负极;
②电子流动方向(导线中):负极→正极;
③阴阳离子移动方向(电解质溶液或熔融电解质中)
阳离子:负极→正极;
阴离子:正极→负极。
[名师点拨]
在原电池中,电子在导线中定向移动(由负极流出,流入正极),离子在溶液中定向移动(阳离子移向正极,阴离子移向负极),即“电子不下水,离子不上岸”或“电子走陆路,离子走水路”,它们共同组成了一个完整的闭合回路。
3.原电池正负极的判断方法
[易错提醒]
(1)构成原电池的两电极材料不一定都是金属,正极材料可以为导电的非金属,如石墨。两极材料可能参与反应,也可能不参与反应。
(2)两个活泼性不同的金属电极用导线连接,共同插入电解质溶液中不一定构成原电池,还必须有能自发进行的氧化还原反应。
(3)在判断原电池正负极时,既要考虑金属活泼性的强弱,也要考虑电解质溶液的性质。例如:MgAlHCl溶液构成的原电池中,负极为Mg,正极为Al;但是MgAlNaOH溶液构成的原电池中,负极为Al,正极为Mg。
(2020·淄博高一检测)如图所示电流表的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A.B极为原电池的正极
B.A、B、C可分别为Zn、Cu和稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
[思维建模] 解答有关原电池问题的思维流程如下:
[解析] 原电池中,负极金属失去电子,发生氧化反应,溶解,质量减小,故A极为负极,B极为正极,A、D项正确;A、B、C分别为Zn、Cu和稀盐酸时,可以构成原电池,且现象符合题意,B项正确;电解质溶液中阳离子移向正极,C项错误。
[答案] C
[延伸探究] (1)若将“B极上有气泡产生”改为“B极上有金属析出”,答案选什么?
(2)将例题中B项改为“A、B、C分别为Fe、Cu和浓硝酸”,能否构成原电池?若能,正、负极分别是什么?
答案:(1)选BC。“B极上有金属析出”说明在正极上电解质溶液中的金属阳离子发生还原反应,B项也错误。
(2)能构成原电池。由于Fe遇浓硝酸钝化,Cu常温下可与浓硝酸反应,故Fe做正极,Cu做负极。
1.下列各个装置中能构成原电池的是( )
解析:选B。该装置两电极的活泼性相同,不能构成原电池,A错误;该装置符合原电池的构成条件,能构成原电池,B正确;酒精是非电解质,该装置不能自发地进行氧化还原反应,不能构成原电池,C错误;该装置没有形成闭合回路,不能构成原电池,D错误。
2.如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中描述合理的是( )
①Zn为正极,Cu为负极 ②H+向负极移动 ③电子流动方向为由Zn经外电路流向Cu ④Cu极上有H2产生 ⑤若有1 ml电子流过导线,则产生H2的物质的量为0.5 ml ⑥正极的电极反应式为Zn-2e-===Zn2+
A.①②③B.③④⑤
C.④⑤⑥ D.②③④
解析:选B。在该原电池中,Zn比Cu活泼,故Zn做负极,Cu做正极,电子由Zn流出经外电路流向Cu,负极反应为Zn-2e-===Zn2+,正极反应为2H++2e-===H2↑,故每转移1 ml电子时,产生H2 0.5 ml,在溶液中H+向正极移动,SOeq \\al(2-,4)向负极移动,故①②⑥错误,③④⑤正确。
学习任务2 原电池原理的应用
1.加快化学反应进行
一个自发进行的氧化还原反应,设计成原电池可以加快反应进行。
2.比较金属活动性强弱
两种金属分别做原电池的两极时,一般做负极的金属比做正极的金属活泼。
3.用于金属的防护
将被保护的金属与比其活泼的金属连接。
4.设计原电池
(1)依据:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂为电解质溶液中的阳离子(或在正极上被还原)。
(2)步骤(以Fe+CuSO4===FeSO4+Cu为例)
(2020·岳阳高一检测)把A、B、C、D四块金属浸在稀H2SO4中,用导线两两相连可以组成多种原电池。若A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极。则四种金属的活泼性顺序由大到小的排列是( )
A.A>C>D>BB.A>C>B>D
C.B>D>C>A D.A>B>C>D
[解析] A、B相连时,A为负极,说明A与B相比较,A更加活泼;C、D相连,D上有气泡逸出,则C为电源的负极,C比D活泼;A、C相连时,A极减轻,A参与了电极反应,被消耗,则A为负极,A比C活泼;B、D相连,B为正极,则D是活泼金属,做电源的负极,D比B活泼。故有A>C>D>B。
[答案] A
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:
________________________________________________________________。
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图并标出正、负极,在下列横线上写出电极反应式。
正极反应式:____________________________________________________;
负极反应式:____________________________________________________。
[思维建模] 解答“设计原电池”类试题思维流程如下:
[解析] 依据反应:2Fe3++Cu===2Fe2++Cu2+可得,氧化反应为Cu-2e-===Cu2+,还原反应为2Fe3++2e-===2Fe2+,则设计思路明确:
原电池组成为Cu是负极,正极材料选用比铜不活泼的铂或导电的非金属石墨棒,电解质溶液选用FeCl3溶液。
[答案] (1)2Fe3++Cu===2Fe2++Cu2+
(2)装置图如下:
2Fe3++2e-===2Fe2+ Cu-2e-===Cu2+
[误区警示] 设计原电池装置的两个易错点
(1)能设计成原电池的反应一般是自发的放热的氧化还原反应,吸热反应不可能将化学能转化为电能。
(2)设计原电池时,负极材料确定之后,正极材料的选择范围较广,只要合理都可以。
1.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
有由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
解析:选C。装置一是原电池,a极质量减小,说明a极金属易失去电子形成离子,故a极金属比b极金属活泼;装置二没有形成原电池,由现象可知b比c活泼,且c位于金属活动性顺序中氢的后面;装置三和四均形成原电池,由现象易知d比c活泼,d比a活泼。 因此四种金属的活动性顺序为d>a>b>c。
2.某原电池的总反应离子方程式为Zn+Cu2+===Zn2++Cu,则下列关于该原电池的装置中正确的是( )
解析:选C。该原电池的负极为锌,正极是比锌活泼性弱的金属或导电的非金属,电解质溶液中含有Cu2+,故选C。
学习任务3 原电池电极反应式的书写
1.电极反应式的书写规律
(1)负极反应式的书写
①较活泼金属做负极时,电极本身被氧化
若生成的金属阳离子不与电解质溶液反应,其产物可直接写为金属阳离子,如Zn-2e-===Zn2+,Cu-2e-===Cu2+;
若生成的金属阳离子与电解质溶液反应,其电极反应为两反应合并后的反应,如铅酸蓄电池的负极反应为Pb+SOeq \\al(2-,4)-2e-===PbSO4;
②负极本身不反应
氢氧(酸性)燃料电池,负极反应为H2-2e-===2H+;
氢氧(碱性)燃料电池,负极反应为H2+2OH--2e-===2H2O。
(2)正极反应式的书写
书写时的总原则:首先根据元素化合价变化或氧化性强弱判断得电子的微粒,其次确定该微粒得电子后生成什么物质。
氢氧(酸性)燃料电池,正极反应为O2+4H++4e-===2H2O。
氢氧(碱性)燃料电池,正极反应为O2+2H2O+4e-===4OH-。
(3)书写复杂电极反应式的方法——加减法
①写出总反应,如Li+LiMn2O4===Li2Mn2O4;
②写出其中较为简单的一个半反应(正极或负极),如Li-e-===Li+(负极);
③利用总反应与上述一极的反应相减,即得另一电极的反应式,如LiMn2O4+Li++e-===Li2Mn2O4(正极)。
2.一般电极反应式的书写思路
燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是( )
A.负极反应式:O2+2H2O+4e-===4OH-
B.负极反应式:CH4+8OH--8e-===CO2+6H2O
C.随着放电的进行,溶液的氢氧根浓度不变
D.放电时溶液中的阴离子向负极移动
[解析] O2+2H2O+4e-===4OH-应为正极反应式,A错误;燃料氧化生成的二氧化碳不可能从强碱溶液中逸出,它将进一步反应转化成碳酸根,所以负极反应式为CH4+10OH--8e-===COeq \\al(2-,3)+7H2O,B错误;由于部分强碱和二氧化碳反应,所以溶液的c(OH-)将减小,C错误。
[答案] D
[方法总结] 燃料电池电极反应式的书写
(1)写出电池总反应式。燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应则总反应为加合后的反应。如甲烷燃料电池(电解质溶液为NaOH溶液)的总反应为CH4+2O2+2NaOH===Na2CO3+3H2O。
(2)写出正极反应式。无论负极燃料是H2还是含碳燃料(CO、CH4、CH3OH、C4H10、C2H5OH等),正极一般都是O2发生还原反应,若在碱性条件下,正极反应式为O2+2H2O+4e-===4OH-,若在酸性条件下,正极反应式为O2+4H++4e-===2H2O。
(3)写出负极反应式。负极反应式=总反应式-正极反应式。
1.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化为氢气,氢气进入以磷酸为电解质的燃料电池中发电,电池负极反应式为( )
A.H2+2OH--2e-===2H2O
B.O2+4H++4e-===2H2O
C.H2-2e-===2H+
D.O2+2H2O+4e-===4OH-
解析:选C。根据题给信息可知,该燃料电池的总反应式为2H2+O2===2H2O;电解液为酸性溶液,电极反应式中不能出现OH-,A错误;又因为燃料电池中负极通入氢气,正极通入氧气,B、D错误。
2.锂电池是一代新型高能电池,它以能量密度大而受到普遍重视,目前已成功研制多种锂电池。某种锂电池的总反应为Li+MnO2===LiMnO2,下列说法正确的是( )
A.Li是正极,电极反应为Li-e-===Li+
B.Li是负极,电极反应为Li-e-===Li+
C.MnO2是负极,电极反应为MnO2+e-===MnOeq \\al(-,2)
D.Li是负极,电极反应为Li-2e-===Li2+
解析:选B。根据原电池中,负极发生氧化反应,正极发生还原反应,再结合总反应可知,Li失去电子生成Li+被氧化,为负极;MnO2得到电子被还原,为正极。
1.(2020·北京海淀区高一检测)下列设备工作时,将化学能转化为电能的是( )
解析:选A。A项,锂离子电池是把化学能转化为电能的设备,故正确;B项,太阳能集热器是把太阳能转化为热能的设备,故错误;C项,燃烧是放热反应,燃气灶是把化学能转化为热能的设备,故错误;D项,硅太阳能电池是把太阳能转化为电能的设备,故错误。
2.下列有关电池的叙述不正确的是( )
A.水果电池是方便实用的家用电池
B.铅酸蓄电池是一种常用的二次电池
C.氢氧燃料电池是一种高效、无污染的发电装置
D.锌锰干电池工作一段时间后,锌外壳逐渐变薄
解析:选A。水果电池产生的电流非常微弱且不能连续长时间放电,不能作为家用电池;铅酸蓄电池是一种常用的二次电池;氢氧燃料电池产物为水,无污染;锌锰干电池工作时,Zn放电被消耗,故工作一段时间后锌外壳会逐渐变薄,B、C、D项正确,A项错误。
3.下列各装置能构成原电池的是( )
解析:选B。A项中两电极相同,错误;C项中蔗糖溶液是非电解质溶液,错误;D项中两烧杯中溶液是分开的,没有形成闭合回路,错误。
4.(2020·白山第十九中学高一月考)a、b的活动性均比氢强,a还可以从b的硝酸盐中置换出b。将a、b用导线相连放入CuSO4溶液中,下列叙述中不正确的是( )
A.导线上有电流,电流方向由b到a
B.a极质量减少,b极质量增加
C.a极析出氢气
D.a极发生氧化反应,b极发生还原反应
解析:选C。将a、b用导线相连放入CuSO4溶液中,构成原电池,a是负极,b是正极,导线上有电流,电流方向由b到a,故A正确;在原电池中,负极a发生失电子的氧化反应,质量减轻,相对不活泼金属b为正极,发生得电子的还原反应,质量增加,故B、D正确,C错误。
5.(2020·北海高一期末)某锂离子电池的工作原理如图所示(a极材料为金属锂和石墨的复合材料,b极材料为FePO4和石墨的复合材料),其电池反应为Li+FePO4===LiFePO4。
(1)a为________极,电极反应式为________________;b为________极,电极反应式为________________________________________。
(2)电池内部Li+由________侧移向________侧。(填“左”或“右”)
(3)能否用磷酸溶液做电解质?________(填“能”或“否”)。
答案:(1)负 Li-e-===Li+ 正 FePO4+e-+Li+===LiFePO4 (2)左 右 (3)否
6.如图是氢氧燃料电池工作原理的示意图。通常氢氧燃料电池有酸式(电解质溶液为硫酸)和碱式[电解质溶液为NaOH(aq)或KOH(aq)]两种。试回答下列问题:
(1)酸式氢氧燃料电池中:
负极反应式为___________________________________________________;
正极反应式为___________________________________________________;
电池总反应为___________________________________________________。
(2)碱式氢氧燃料电池中:
负极反应式为___________________________________________________;
正极反应式为___________________________________________________;
电池总反应为___________________________________________________。
解析:(1)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,酸性条件下与H+结合成H2O;负极上,H2失电子变为H+,H+进入电解质溶液。(2)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,碱性条件下与H2O结合成OH-;负极上,H2失电子变为H+,碱性条件下H+不能大量存在,与OH-结合成H2O。
答案:(1)2H2-4e-===4H+ O2+4e-+4H+===2H2O 2H2+O2===2H2O
(2)2H2-4e-+4OH-===4H2O O2+4e-+2H2O===4OH- 2H2+O2===2H2O
[合格考检测]
1.下列对于原电池的电极名称叙述错误的是( )
A.发生氧化反应的为负极
B.正极为电子流入的一极
C.比较不活泼的金属为负极
D.电流的方向由正极到负极
解析:选C。原电池中相对活泼的金属为负极,相对不活泼的金属为正极,C项错误;负极发生氧化反应,正极发生还原反应,A项正确;原电池工作时,外电路中电子由负极流出,由正极流入,电流方向与电子流动方向相反,B、D两项正确。
2.下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
解析:选B。锂离子电池是可充电电池,属于二次电池,A项正确;铜锌原电池中,Cu为正极,Zn为负极,外电路中电子由负极流向正极,B项错误;燃料电池将化学能转化为电能,C项正确;锌锰干电池中,锌电极为负极,D项正确。
3.汽车的启动电源常用铅酸蓄电池,其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O。根据此反应判断下列叙述中正确的是( )
A.PbO2是电池的负极
B.Pb是负极
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
解析:选B。根据电池反应可知,放电过程中Pb失去电子,因此Pb电极是原电池的负极,其电极反应式为Pb+SOeq \\al(2-,4)-2e-===PbSO4,故B项正确;PbO2在放电过程中得到电子被还原,为原电池的正极,故A、C两项错误;由于原电池放电的过程中消耗硫酸,所以溶液的酸性减弱,故D项错误。
4.(2020·宁县高一检测)如图为水果电池的示意图,下列说法正确的是( )
A.锌片做负极,质量逐渐减小
B.电子由铜片沿导线流向锌片
C.铜电极逐渐溶解
D.该装置能将电能转化为化学能
解析:选A。锌比铜活泼,则Zn做负极,发生氧化反应,失去电子,进入溶液,所以质量减小,A正确;Zn为负极,则Cu为正极,所以电子从锌片沿导线流向铜片,B错误;铜电极发生还原反应,水果中的氢离子发生还原反应生成氢气,所以Cu不溶解,C错误;该装置是原电池,将化学能转化为电能,D错误。
5.(2020·三明第一中学月考)某原电池的电池反应为Fe+2Fe3+===3Fe2+,与此电池反应不符的原电池是( )
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片、锌片、Fe2(SO4)3溶液组成的原电池
D.铜片、铁片、Fe(NO3)3溶液组成的原电池
解析:选C。由总反应可知,负极应为铁,被氧化,电解质溶液应为含有Fe3+的溶液,A、B、D中铁都为负极,C中铁片、锌片、Fe2(SO4)3溶液构成的原电池中,锌片为负极,铁片为正极,原电池反应为Zn+2Fe3+===2Fe2++Zn2+。
6.(2020·南京外国语高一检测)如图所示,两电极分别为碳棒和铁片,若电流计的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
解析:选C。两电极分别为碳棒和铁片,若电流计的指针发生偏转,则说明形成了原电池,由于活动性:Fe>C,所以Fe为负极,C为正极,且a极上有大量气泡生成,则溶液是硫酸溶液。b是Fe,做负极,在负极上发生反应:Fe-2e-===Fe2+;a是正极,正极材料是C,在正极上发生反应:2H++2e-===H2↑。
7.(2020·忻州第一中学月考)将编号为①②③④的四种金属片两两相连浸入稀硫酸中都可构成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属的活动性由强到弱的顺序是( )
A.①③②④ B.①③④②
C.③④②① D.③①②④
解析:选B。在两种金属片相连浸入稀硫酸的原电池中,较活泼的金属做负极、较不活泼的金属做正极,电子从负极流向正极,负极上金属失电子而导致质量减少,正极上氢离子得电子生成氢气,①②相连时,外电路电流从②流向①,则②是正极,①是负极,金属活动性:②<①;①③相连时,③为正极,则金属活动性:①>③;②④相连时,②上有气泡逸出,④为负极,②为正极,则金属活动性:④>②;③④相连时,③的质量减少,③为负极,④为正极,则金属活动性:③>④。通过以上分析可知,金属活动性强弱顺序是①③④②。
8.将两根质量相同的铜棒和锌棒用导线相连接后插入CuSO4溶液中,经过一段时间后,取出洗净后干燥并称重,两棒质量相差6.45 g,导线中通过的电子的物质的量为 ( )
A.0.1 ml B.0.2 ml
C.0.3 ml D.0.4 ml
解析:选A。负极:Zn-2e-===Zn2+,1 ml Zn失去2 ml e-时减重65 g;正极:Cu2++2e-===Cu,1 ml Cu2+得到2 ml e-时增重64 g,则两极质量相差:65 g+64 g=129 g,现在两棒质量相差6.45 g,计算可得应转移0.1 ml e-。
9.某同学为了探究原电池产生电流的过程,设计了如图实验。
(1)打开K,观察到的现象为_______________________________________。
(2)关闭K,观察到的现象为_______________________________________,
此电池负极的电极反应式为_______________________________________,
总反应式为_____________________________________________________。
(3)关闭K,溶液中阳离子向________(填“Zn”或“C”)极移动,外电路中,电子流动方向是____________________________________________(用Zn、C表示)。
解析:(1)打开K,锌与硫酸铜溶液接触,置换出铜,所以可以看到锌棒上附着有红色固体。(2)关闭K,形成原电池,锌做负极,碳做正极,溶液中的铜离子在碳棒上得到电子生成铜,可以看到碳棒上附着有红色固体;其正极反应为Cu2++2e-===Cu,负极反应式为Zn-2e-===Zn2+,总反应式为Zn+Cu2+===Zn2++Cu。 (3)关闭K,溶液中的阳离子向正极移动,即向碳棒移动;电子从锌极出来经过导线流向碳极。
答案:(1)锌棒上附着有红色固体
(2)碳棒上附着有红色固体 Zn-2e-===Zn2+
Zn+Cu2+===Zn2++Cu
(3)C Zn→C
[等级考检测]
10.固体氧化物燃料电池是由美国西屋(Westinghuse)公司研制开发的。它以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
A.有O2放电的a极为电池的负极
B.O2-移向电池的正极
C.b极对应的电极反应为2H2-4e-+2O2-===2H2O
D.a极对应的电极反应为O2+2H2O+4e-===4OH-
解析:选C。在该燃料电池中,有O2放电的a极为电池的正极,A错误;O2-移向电池的负极,B错误;在该燃料电池中,有H2放电的b极为电池的负极,电极反应为2H2-4e-+2O2-===2H2O,C正确;a极是正极,氧气在正极得电子,则对应的电极反应为O2+4e-===2O2-,D错误。
11.研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法中不正确的是 ( )
A.水既是氧化剂又是溶剂
B.放电时负极上有氢气生成
C.放电时OH-向负极移动
D.总反应为2Li+2H2O===2LiOH+H2↑
解析:选B。由题意知此电池名称为锂水电池,可推测其总反应为2Li+2H2O===2LiOH+H2↑,再依据原电池原理写出其电极反应如下:负极为2Li-2e-===2Li+,正极为2H2O+2e-===2OH-+H2↑,在原电池内部,放电时OH-向负极移动,故A、C、D项正确,B项错误。
12.有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
试根据上表中的实验数据回答下列问题:
(1)实验2中负极是________,电极反应式为_________________________。
(2)实验1和5电流方向相反的原因是_______________________________。
(3)由实验1~实验4可知,影响水果电池的电压的因素为_____________。
(4)根据实验2、6和实验1、5的比较可发现水果电池的电压还与________有关。
答案:(1)Zn Zn-2e-===Zn2+
(2)水果类型(或电解质溶液)相同时,实验1中锌的还原性大于铜,锌是负极,实验5中锌的还原性小于铝,锌是正极
(3)水果的类型(或电解质溶液)
(4)电极材料
13.(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向,可知氧气从________(填“a”或“b”)口通入,X极为电池的________(填“正”或“负”)极。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷做电解质,两极上发生的电极反应如下:
A极——2H2+2O2--4e-===2H2O
B极——O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)微型纽扣电池在现代生活中有广泛应用,有一种银锌纽扣电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应如下:
Zn+2OH--2e-===ZnO+H2O
Ag2O+H2O+2e-===2Ag+2OH-
总反应为Ag2O+Zn===ZnO+2Ag
①Zn是________极,Ag2O发生________反应;
②电子由________极流向________极(填“Zn”或“Ag2O”),当电路中通过1 ml电子时,负极消耗物质的质量是________g;
③在使用过程中,电解质溶液中KOH的物质的量________(填“增大”“减小”或“不变”)。
解析:(1)氢氧燃料电池中,电子从负极向正极移动,由题图可知,X是负极,Y是正极,氧气应通入正极。(2)根据电极反应可知,A极发生氧化反应,为电池的负极,电子从该极流出。(3)①根据电极反应可知Zn失电子被氧化而溶解,Ag2O得电子被还原,发生还原反应;②发生原电池反应时,电子由负极经外电路移向正极,即电子从Zn极经外电路移向Ag2O极,当电路中通过1 ml电子时,负极消耗Zn的质量是32.5 g;③电池中KOH只起到增强导电性的作用,不参与反应,故电池使用过程中KOH的物质的量不变。
答案:(1)b 负 (2)负 流出
(3)①负 还原 ②Zn Ag2O 32.5 ③不变课程标准
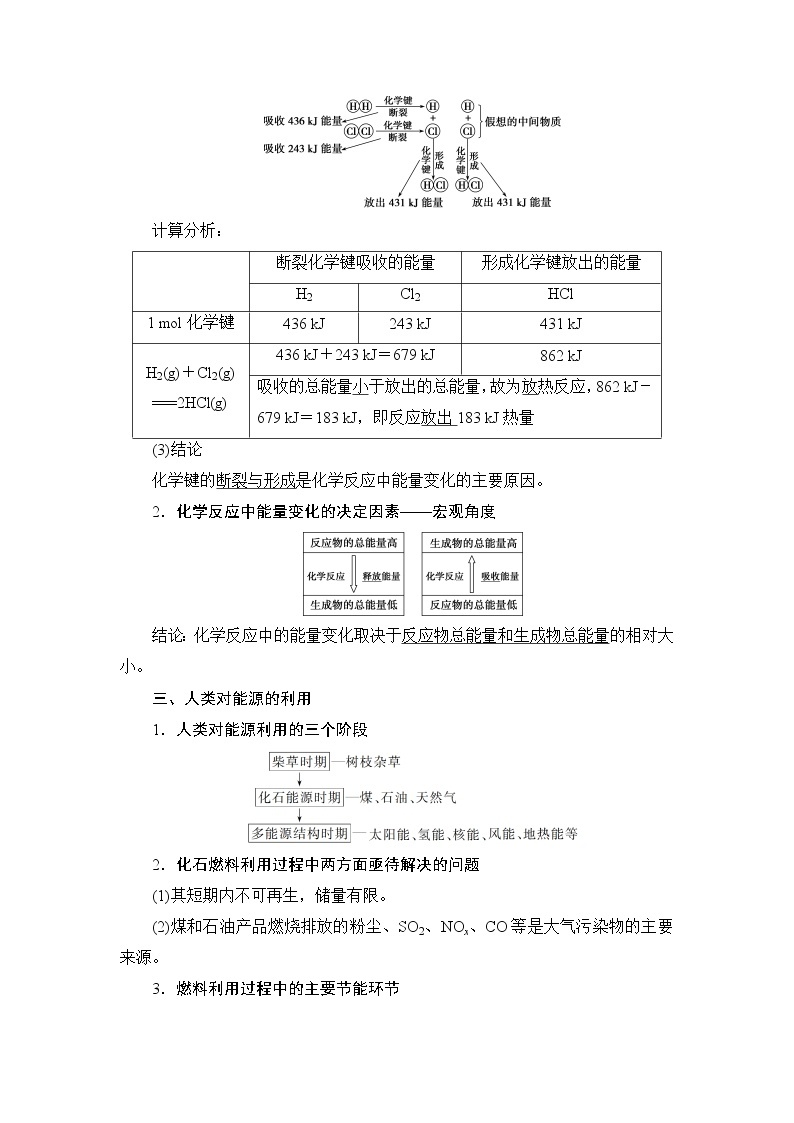
核心素养
1.以原电池为例认识化学能可以转化为电能。
2.从氧化还原反应的角度初步认识原电池的工作原理。
3.能举出化学能转化为电能的实例,能辨识简单原电池的构成要素。体会研制新型电池的重要性。
1.宏观辨识与微观探析:能从宏观(能量变化)和微观(电子转移)相结合的视角分析原电池的组成和工作原理。
2.科学探究与创新意识:能从有关原电池的问题和假设出发,依据探究目的,设计探究方案,运用化学实验进行实验探究。
实验装置
实验现象
实验结论
锌片上有气泡产生,铜片上无气泡产生
锌与稀硫酸反应生成H2,铜与稀硫酸不反应
锌片上无气泡产生,铜片上有气泡产生
产生H2(还原反应)的位置发生了改变
锌片上无气泡产生,铜片上有气泡产生,电流表指针发生偏转
该装置将化学能转化为电能
电极材料
电极名称
电子转移
电极反应式
反应类型
锌
负极
失电子
Zn-2e-===Zn2+
氧化反应
铜
正极
得电子
2H++2e-===H2↑
还原反应
电池反应的离子方程式
Zn+2H+===Zn2++H2↑
构造示意图
工作
原理
负极
锌筒
锌被氧化逐渐消耗
电解质
氯化铵糊
正极
石墨棒
二氧化锰被还原
特点
放电后不能充电;便于携带,价格低
步骤
实例
将反应拆分为电极反应
↓
选择电极材料
↓
选择电解质
↓
画出装置图
负极反应
Fe-2e-===Fe2+
正极反应
Cu2++2e-===Cu
负极:较活泼金属,一般为发生氧化反应的金属
Fe
正极:活泼性弱于负极材料的金属或石墨
Cu或C
一般为与负极反应的电解质
CuSO4溶液
实验装置
部分实
验现象
a极质量减小,b极质量增大
b极有气泡产生,c极无变化
d极溶解,c极有气泡产生
电流从a极流向d极
A
B
C
D
锂离子电池
太阳能集热器
燃气灶
硅太阳能电池
实验次数
电极材料
水果品种
电极间距cm
电压/mV
1
锌
铜
菠萝
3
900
2
锌
铜
苹果
3
650
3
锌
铜
柑橘
3
850
4
锌
铜
西红柿
3
750
5
锌
铝
菠萝
3
650
6
锌
铝
苹果
3
450
化学必修 第二册第一节 化学反应与能量变化导学案及答案: 这是一份化学必修 第二册第一节 化学反应与能量变化导学案及答案,共7页。学案主要包含了教学目标,重点难点,实验6-1,实验6-2,思考与交流等内容,欢迎下载使用。
人教版 (2019)必修 第二册第三节 无机非金属材料优秀学案设计: 这是一份人教版 (2019)必修 第二册第三节 无机非金属材料优秀学案设计,共15页。学案主要包含了教材梳理,自我检测等内容,欢迎下载使用。
人教版 (2019)必修 第二册第二节 氮及其化合物优质学案: 这是一份人教版 (2019)必修 第二册第二节 氮及其化合物优质学案,文件包含第1课时氮气与氮的固定一氧化氮和二氧化氮doc、第2课时氨和铵盐doc、第3课时硝酸酸雨及防治doc等3份学案配套教学资源,其中学案共61页, 欢迎下载使用。