










人教版 (2019)必修 第二册第一节 化学反应与能量变化优秀作业课件ppt
展开如何表示化学反应的反应热呢?
③1个H2与1个Cl2在点燃的条件下反应生成2个HCl
①1 ml H2与1 ml Cl2在点燃的条件下反应生成2 ml HCl
②2 g的H2与71 g的Cl2在点燃的条件下反应生成73 g的HCl
H2 (g) + Cl2 (g) = 2HCl (g) ∆H= -184.6kJ/ml
1 ml气态H2与1 ml气态Cl2反应生成2 ml气态HCl, 放出184.6kJ 的热量。
表示参加反应的物质的量与反应热的关系的化学方程式。
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
在25℃和101kPa下,1ml气态H2与0.5ml气态O2反应生成1ml气态H2O时,放出241.8kJ的热量;
在25℃和101kPa下,1ml气态H2与0.5ml气态O2反应生成1ml液态H2O时,放出285.8kJ的热量。
在25℃和101kPa下,1ml气态H2与0.5ml气态O2反应生成1ml气态H2O时,放出241.8kJ的热量;
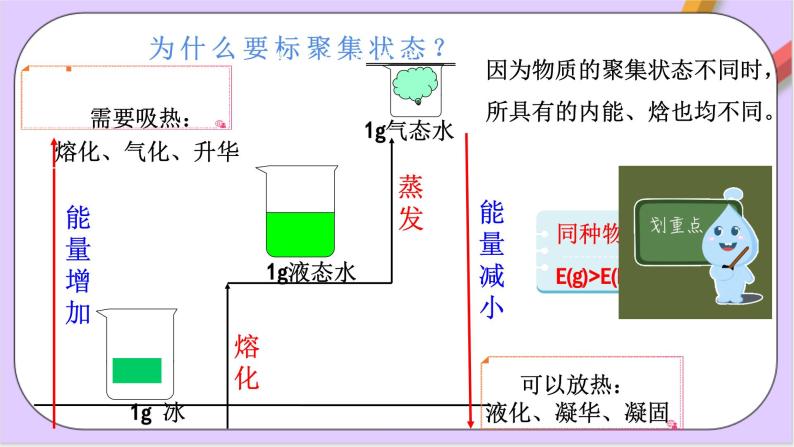
因为物质的聚集状态不同时,所具有的内能、焓也均不同。
2H2 (g) + O2 (g) = 2H2O (g) ∆H=-483.6kJ/ml
2H2O (g) = 2H2 (g) + O2 (g) ∆H=+483.6kJ/ml
(1)热化学方程式需注明反应时的温度和压强,如不注明条件,即指: 25℃和101 kPa。其他反应条件可省略
(2)热化学方程式中各物质需标聚集状态(s、l、g、aq)
(3)化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”,单位是kJ/ml 。
(4)热化学方程式中各物质前的化学计量数不表示微粒数目,只表示物质的量,它可以是整数也可以是分数。若化学方程式中各物质的系数加倍,则△H 的数值也加倍。若反应逆向进行,则△H 改变符号,但绝对值不变。
101kPa时,1ml纯物质完全燃烧生成指定产物时所放出的热量。
燃烧热通常可利用量热计由实验测得。
例如,实验测得在25℃和101kPa时,1mlH2完全燃烧生成液态水,放出285.8kJ的热量,这就是H2的燃烧热。
煤、石油、天然气是当今世界重要的化石燃料。煤的主要成分是碳单质(C),石油加工产品——汽油的成分之一是辛烷(C8H18),天然气的主要成分是甲烷(CH4),它们燃烧的热化学方程式分别表示如下:
C(s)+)O2(g) ===CO2(g) ΔH=-393.5 kJ·ml-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·ml-1
某些物质的燃烧热(25 ℃,101 kPa)
下列热化学方程式中ΔH的值能表示可燃物的燃烧热的是( )A.2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·ml-1B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·ml-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·ml-1D.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·ml-1
1.下图分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )A. 石墨转变为金刚石是吸热反应B.白磷比红磷稳定C. S(g)+O2(g)=SO2(g) △H1= - Q1 kJ/ml S(s)+O2(g)=SO2(g) △H2= - Q2 kJ/ml △ H1>△H2D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
2.已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-Q1②H2(g)+2(1)O2(g)===H2O(g) ΔH2=-Q2③H2(g)+2(1)O2(g)===H2O(l) ΔH3=-Q3取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况下),经完全燃烧恢复到常温,放出的热量是( )A.0.4Q1+0.05Q2 B.0.4Q1+0.1Q2C.0.4Q1+0.05Q3 D.0.4Q1+0.1Q3
3.已知1 ml燃料完全燃烧的数据分别为:
使用上述燃料最能体现“低碳经济”理念的是( )A.一氧化碳 B.甲烷C.异辛烷 D.乙醇
热化学方程式的正误判断
高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸精品作业课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸精品作业课件ppt,文件包含732乙酸课件pptx、732乙酸分层作业含解析docx、732乙酸分层作业无答案docx等3份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
化学必修 第二册第三节 乙醇与乙酸优秀作业课件ppt: 这是一份化学必修 第二册第三节 乙醇与乙酸优秀作业课件ppt,文件包含731乙醇课件pptx、731+乙醇课件pptx、731乙醇分层作业含解析docx、731乙醇分层作业无答案docx等4份课件配套教学资源,其中PPT共38页, 欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 乙烯与有机高分子材料优质作业课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第二节 乙烯与有机高分子材料优质作业课件ppt,文件包含722烃课件pptx、722烃分层作业含解析docx、722烃分层作业无答案docx等3份课件配套教学资源,其中PPT共36页, 欢迎下载使用。













