高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素优质学案
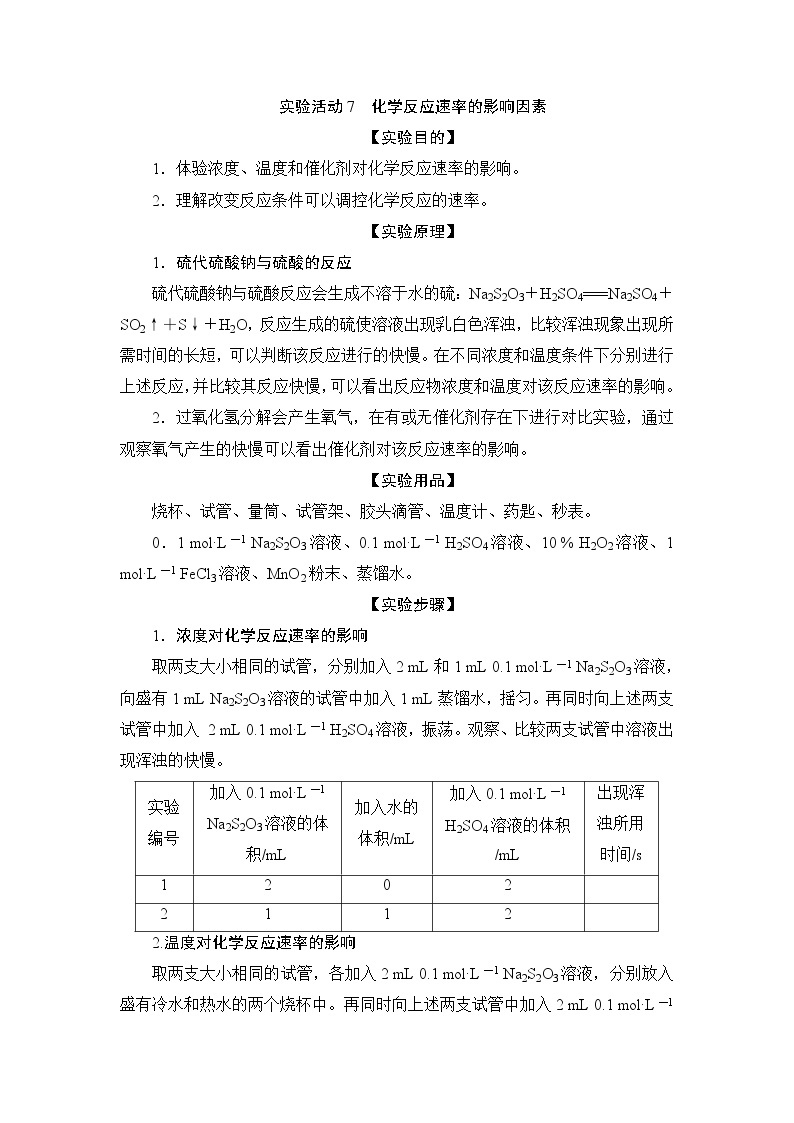
展开1.体验浓度、温度和催化剂对化学反应速率的影响。
2.理解改变反应条件可以调控化学反应的速率。
【实验原理】
1.硫代硫酸钠与硫酸的反应
硫代硫酸钠与硫酸反应会生成不溶于水的硫:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,反应生成的硫使溶液出现乳白色浑浊,比较浑浊现象出现所需时间的长短,可以判断该反应进行的快慢。在不同浓度和温度条件下分别进行上述反应,并比较其反应快慢,可以看出反应物浓度和温度对该反应速率的影响。
2.过氧化氢分解会产生氧气,在有或无催化剂存在下进行对比实验,通过观察氧气产生的快慢可以看出催化剂对该反应速率的影响。
【实验用品】
烧杯、试管、量筒、试管架、胶头滴管、温度计、药匙、秒表。
0.1 ml·L-1 Na2S2O3溶液、0.1 ml·L-1 H2SO4溶液、10 % H2O2溶液、1 ml·L-1 FeCl3溶液、MnO2粉末、蒸馏水。
【实验步骤】
1.浓度对化学反应速率的影响
取两支大小相同的试管,分别加入2 mL和1 mL 0.1 ml·L-1 Na2S2O3溶液,向盛有1 mL Na2S2O3溶液的试管中加入1 mL蒸馏水,摇匀。再同时向上述两支试管中加入 2 mL 0.1 ml·L-1 H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
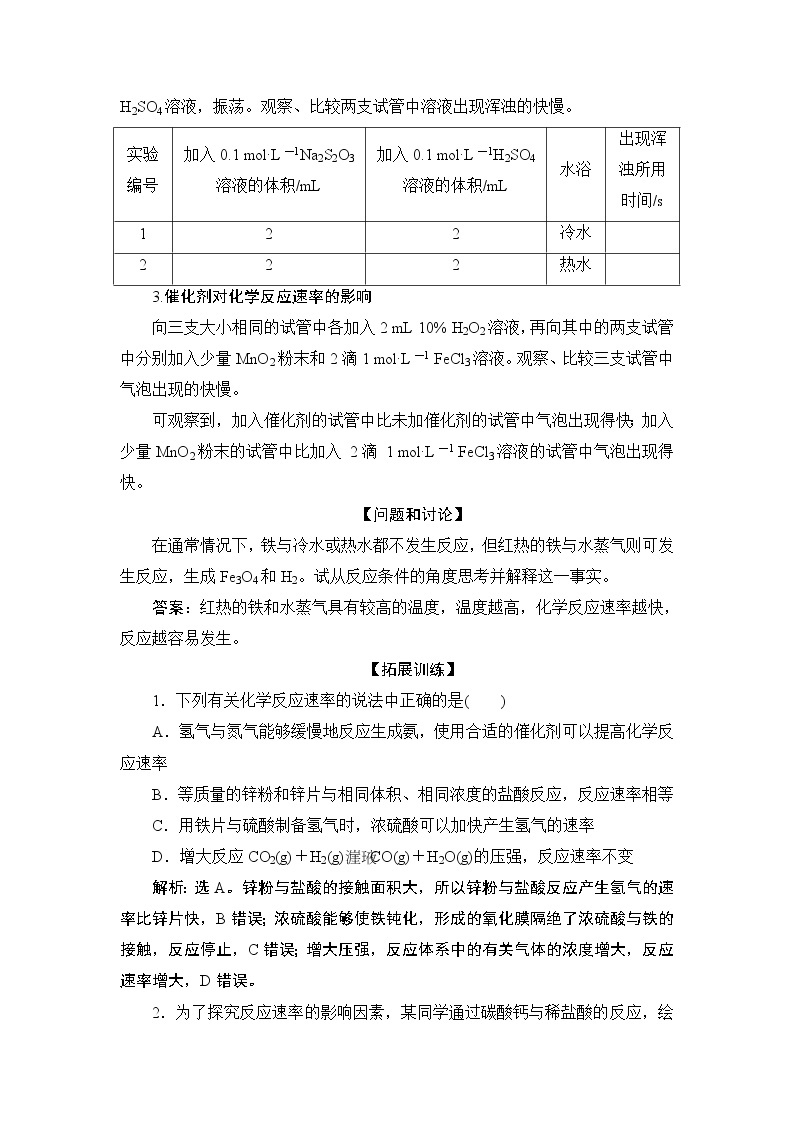
2.温度对化学反应速率的影响
取两支大小相同的试管,各加入2 mL 0.1 ml·L-1 Na2S2O3溶液,分别放入盛有冷水和热水的两个烧杯中。再同时向上述两支试管中加入2 mL 0.1 ml·L-1 H2SO4溶液,振荡。观察、比较两支试管中溶液出现浑浊的快慢。
3.催化剂对化学反应速率的影响
向三支大小相同的试管中各加入2 mL 10% H2O2溶液,再向其中的两支试管中分别加入少量MnO2粉末和2滴1 ml·L-1 FeCl3溶液。观察、比较三支试管中气泡出现的快慢。
可观察到,加入催化剂的试管中比未加催化剂的试管中气泡出现得快;加入少量MnO2粉末的试管中比加入 2滴 1 ml·L-1 FeCl3溶液的试管中气泡出现得快。
【问题和讨论】
在通常情况下,铁与冷水或热水都不发生反应,但红热的铁与水蒸气则可发生反应,生成Fe3O4和H2。试从反应条件的角度思考并解释这一事实。
答案:红热的铁和水蒸气具有较高的温度,温度越高,化学反应速率越快,反应越容易发生。
【拓展训练】
1.下列有关化学反应速率的说法中正确的是( )
A.氢气与氮气能够缓慢地反应生成氨,使用合适的催化剂可以提高化学反应速率
B.等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等
C.用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率
D.增大反应CO2(g)+H2(g)CO(g)+H2O(g)的压强,反应速率不变
解析:选A。锌粉与盐酸的接触面积大,所以锌粉与盐酸反应产生氢气的速率比锌片快,B错误;浓硫酸能够使铁钝化,形成的氧化膜隔绝了浓硫酸与铁的接触,反应停止,C错误;增大压强,反应体系中的有关气体的浓度增大,反应速率增大,D错误。
2.为了探究反应速率的影响因素,某同学通过碳酸钙与稀盐酸的反应,绘制出收集到的CO2体积与反应时间的关系图(0~t1、t1~t2、t2~t3的时间间隔相等)。下列说法正确的是( )
A.0~t1时间段,CO2的化学反应速率v=eq \f(V1,t1) ml·L-1·min-1
B.t1~t2与0~t1比较,反应速率加快的原因可能是产生的CO2气体增多
C.根据(V3-V2)<(V2-V1),推测反应速率减慢的原因可能是盐酸浓度减小
D.在t4后,收集到的气体的体积不再增加,说明碳酸钙消耗完全
解析:选C。A项,0~t1时间段,CO2的体积变化量为V1L,则CO2的化学反应速率v=eq \f(V1,t1) L·min-1,故A错误;B项,t1~t2与0~t1比较,反应速率加快的原因可能是反应放热,使反应温度升高,故B错误;C项,根据(V3-V2)<(V2-V1)可知,随着反应进行,盐酸浓度减小,反应速率减慢,故C正确;D项,在t4后,收集到的气体的体积不再增加,说明至少有一种反应物已经消耗完全,但不能确定是否为碳酸钙,故D错误。
3.比较推理是学习化学常用的方法,根据化学反应事实可以推导出影响化学反应速率的因素。下列推理不合理的是 ( )
解析:选B。A.同质量的铜片变为铜粉,表面积大大增加,与空气接触面积大大增加。B.产生无色气体与产生红棕色气体的原因是硝酸浓度不同。C.FeCl3(Fe3+)对H2O2的分解有催化作用。D.金属活动性Mg>Zn,Zn与MgSO4溶液不反应;金属活动性Zn>Fe,Zn与FeSO4溶液发生反应Zn+Fe2+===Zn2++Fe,溶液颜色变浅。实验
编号
加入0.1 ml·L-1
Na2S2O3溶液的体
积/mL
加入水的
体积/mL
加入0.1 ml·L-1
H2SO4溶液的体积
/mL
出现浑
浊所用
时间/s
1
2
0
2
2
1
1
2
实验
编号
加入0.1 ml·L-1Na2S2O3
溶液的体积/mL
加入0.1 ml·L-1H2SO4
溶液的体积/mL
水浴
出现浑
浊所用
时间/s
1
2
2
冷水
2
2
2
热水
选项
化学反应事实
影响化学反应速率的因素
A
铜片在空气中很难燃烧,同质量的铜片变为铜粉在空气中能燃烧
反应物间接触面积
B
铜粉放入稀硝酸中产生无色气体;铜片放入浓硝酸中产生红棕色气体
反应物间接触面积
C
双氧水在常温下不易分解,加入三氯化铁溶液后迅速分解
使用催化剂
D
锌片放入硫酸镁溶液中,不反应;锌片放入硫酸亚铁溶液中,溶液变色
反应物不同
高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素学案设计: 这是一份高中化学人教版 (2019)必修 第二册<a href="/hx/tb_c4000043_t4/?tag_id=42" target="_blank">实验活动7 化学反应速率的影响因素学案设计</a>,共8页。
高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素导学案: 这是一份高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素导学案,共3页。
人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素导学案: 这是一份人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素导学案,共2页。