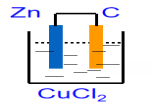



高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化精品ppt课件
展开《化学反应与能量变化》第二课时教学设计
课题 | 《化学反应与能量变化》第二课时 | 单元 | 6 | 学科 | 化学 | 年级 | 高一 |
教材 分析 | 本节教学内容是人教版高中化学必修第二册第六章《化学反应与能量》第一节《化学反应与能量变化》的第二课时。本章教材给学生建立一个重要的思想,化学反应中不仅有物质的变化同时伴随有能量变化,让学生能从物质和能量两个角度认识物质世界的变化规律,然后展开对化学变化相关理论的学习。让学生知道物质在相互转化的过程中,也可以通过化学能转化为电能,化学能和电能的转化是需要一定的条件的,就是需要原电池装置。而原电池的研究也是电化学的一部分,电化学在工业生产中也有十分重要的应用,比如电池的制造工程。 本节教材,学生在前面的学习过程中,已经知道了氧化还原的理论和金属活动性的知识,并初步知道了化学能可以实现能量转化,转化为电能。本届通过探究性的实验,对化学能转化为电能进一步的研讨。通过原电池闭合回路的分析,引出电池、内电路、外电路等概念,要求学生掌握电极反应式和化学方程式的书写,让学生对原电池的基本原理有一个基本的认识。 本节安排了“化学能与电能的相互转化”,“原电池”,“常见的化学电池”,这三部分内容。学生通过学习这部分知识,掌握原电池的反应原理,并且能够知道生活中常用电池的电极反应式,同时也要对电池的未来发展有一个基本认识。 | ||||||
教学目标与核心素养 | 宏观辨识与微观探析:通过原电池的原理探究实验,让学生直观的感觉化学能转化为电能的变化,进一步激发学生学习化学的兴趣和求知欲望,启发学生分析产生有关现象的因果关系和本质联系,从而使学生了解学习和研究化学问题的一般方法和思维过程 证据推理与模型认知:通过揭示问题、讨论释疑、动手实验,学习对比、推断等多种科学探究方法,学会由事物的表象分析事物的本质和变化,提高学生的实验能力、观察能力和对实验现象的分析、推理及归纳总结能力。 科学探究与创新意识:从现象和结构出发,设计探究方案,探究化学能转化为电能的反应原理,在探究中互利合作,培养团队精神。 科学精神与社会责任:激发学生透过现象探究本质的兴趣,尊重科学,认真学习科学的学习方法;通过参与探究过程,培养自身严谨的科学态度和辩证分析能力。 | ||||||
重点 难点 | 原电池的形成条件;各种电池和燃料电池的电极反应式。 | ||||||
教学过程 |
教学环节 | 教师活动 | 学生活动 | 设计意图 | ||||||||||||||||||
导入新课 | 在我们生活中由很多的电池,那么大家知道这些电池都是怎么工作的吗? |
|
| ||||||||||||||||||
讲授新课 | 第一节化学反应与能量变化 一、化学能与电能的相互转化 化学能→热能→机械能→电能 二、原电池
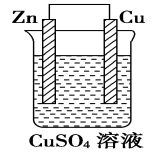
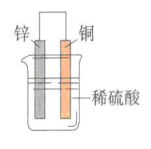
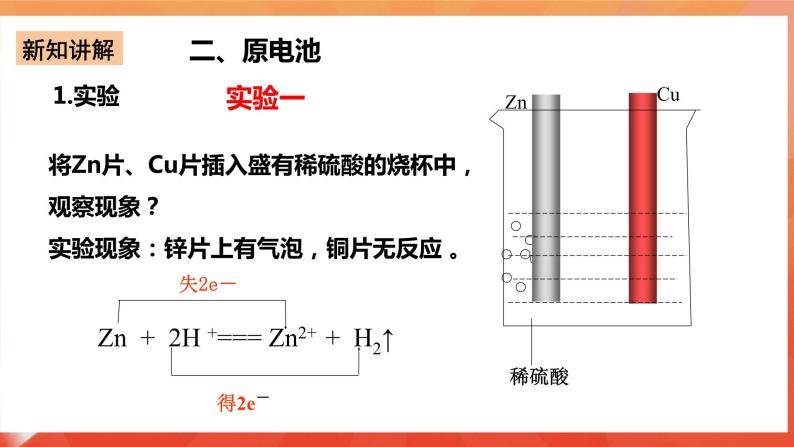
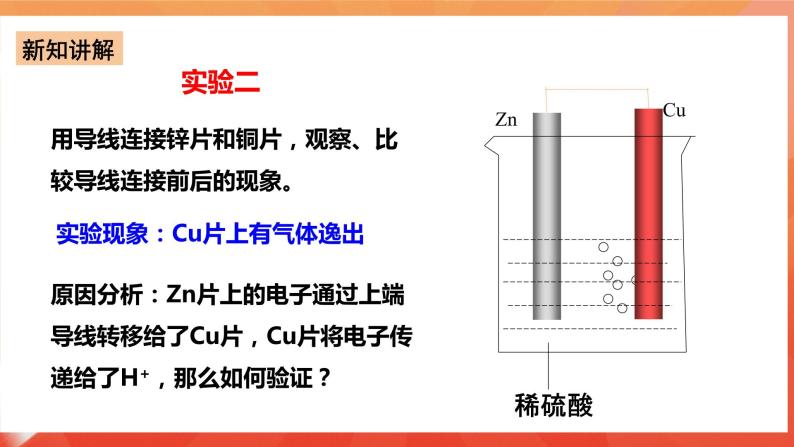
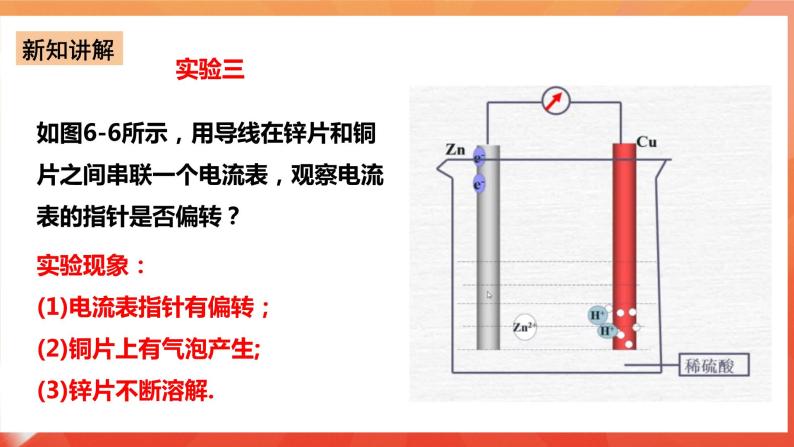
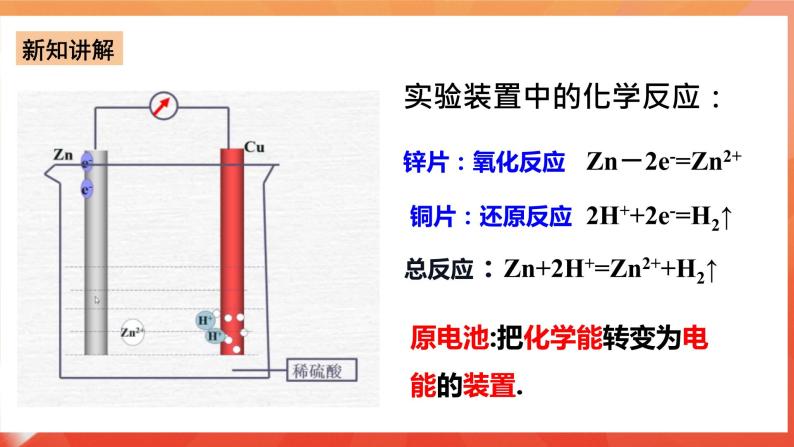
实验一:将Zn片、Cu片插入盛有稀硫酸的烧杯中,观察现象? 实验现象:锌片上有气泡,铜片无反应 。 Zn+2H+===Zn2++H2↑ 实验二:用导线连接锌片和铜片,观察、比较导线连接前后的现象。 实验现象:Cu片上有气体逸出。 原因分析:Zn片上的电子通过上端导线转移给了Cu片,Cu片将电子传递给了H+,那么如何验证? 实验三:如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转? 实验现象: (1)电流表指针有偏转; (2)铜片上有气泡产生; (3)锌片不断溶解。 实验装置中的化学反应: 锌片:氧化反应Zn-2e-=Zn2+ 铜片:还原反应2H++2e-=H2↑ 总反应:Zn+2H+=Zn2++H2↑ 原电池:把化学能转变为电能的装置. 2.原电池形成条件探究 条件一:有活泼性不同的两个电极(两种金属或非金属导体); 形成条件二:电极需插进电解质溶液中; 形成条件三:必须形成闭合回路; 条件4:自发的氧化还原反应。
⑴原电池定义:把化学能转变为电能的装置. ⑵原电池原理:负极失电子,发生氧化反应,负极反应: Zn-2e-= Zn2+; 正极得电子,发生还原反应,正极反应:2H++ 2e-= H2↑; “负极出电子,电子回正极”,阴离子向负极移动,阳离子向正极移动。 总反应:Zn+ 2H+ = Zn2+ + H2↑ 负极:一般活泼金属→向外线路提供电子→发生氧化反应; 正极: 一般不活泼金属(或石墨)→接受外线路提供的电子→该电极上发生还原反应。 ⑶原电池的构成条件 ①两种活泼性不同电极.(活泼性不同的金属或一种金属和另一种非金属导体) ②电极必须插入电解质溶液 。 ③能自发的发生氧化还原反应。 ④电极用导线相连构成闭合回路。 ⑷内外电路和电流流向 外电路:负极、导线、电流表、正极构成外电路; 内电路:负极、电解质溶液、正极构成内电路; 外电路:电子由负极流向正极,电流由正极 流向负极; 内电路:阴离子移向负极,阳离子移向正极。 ⑸原电池的正负极的判断方法 Ⅰ.根据电子流动方向,电子流出的极-----负极;电子流入的极----正极。 Ⅱ.①根据电极材料,较活泼的电极材料-----负极;较不活泼的电极材料----正极。 ②根据原电池电极发生的反应,发生氧化反应的极---负极;发生还原反应的极---正极。 ③根据电极增重还是减重,质量增加的电极---正极;质量减少的电极----负极。 ④根据电极有气泡冒出,有气泡冒出的电极为----负极。 课后探究-----简易电池的设计和制作 请同学们,回家后利用水果(苹果、柑橘或柠檬等)。食盐水,滤纸,通篇、铁片、铝片等金属片,石墨棒,导线,小型用电器(发光二极管、电子音乐卡或小电机等),电流表,制作简单的原电池。 问题与讨论: 1.在水果电池中,水果的作用是什么? 水果起到了电解质溶液的作用。 2.通过比较不同材料作电极的简易电池,你是否发现电极材料的选择有一些值得注意的问题?请与同学交流你的经验。 a.活泼性不同的金属;b.金属和非金属(非金属必须能导电);c.金属与化合物;d.惰性电极—氢氧燃料电池,电极均为铂。电解液的选择:负极材料一般要能与电解液自行发生氧化还原反应。 3.在以上实验中,电池不可或缺的构成部分由哪些? 电解质溶液、活泼性不同的电极、电流表,水果必须具有一定的酸碱性并且必须可以和电极发生反应。 三、常见的化学电池 1.锌锰干电池(一次性电池) 电极:Zn为负极,碳棒为正极 电解液:NH4Cl、ZnCl2和淀粉糊 电极方程式:负极(Zn):Zn-2e-=Zn2+ 正极(C):2MnO2 + 2NH4+ + 2e-= Mn2O3+2NH3+H2O 方程式: 4NH4Cl+2Zn+2MnO2=[Zn(NH3)4]Cl2+ZnCl2+Mn2O3+H2O 缺点:使用寿命短,易泄露 2、充电电池—铅蓄电池(二次电池)
Pb+PbO2+2H2SO4 2PbSO4+2H2O
(1)原电池的电极材料:电解质:H2SO4,正极为:PbO2,负极:Pb. (2)两极的电极反应式: 正极:PbO2+2e-+SO42-+4H+=PbSO4+2H2O; 负极:Pb-2e-+SO42-=PbSO4。 特点:电压高稳定,可反复使用,安全、方便、可靠。铅易产生氢气损耗,充电时需加水。 用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还广泛用于国防、生产、生活等领域。 其他蓄电池:镍-氢蓄电池、锂离子电池等。 3、燃料电池——高效、环境友好的化学电池 H-O燃料电池曾在1967年首次被用作阿波罗宇宙飞船的电源。
甲烷燃料电池: ①碱性介质下的:负极:CH4+10OH--8e-=CO32- +7H2O 正极:2O2+8e-+4H2O==8OH- 总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O ②酸性介质下:负极:CH4-8e-+2H2O=CO2+8H+ 正极:2O2+8e-+8H+=4H2O 总反应方程式为:2O2+CH4=2H2O+CO2 大有发展前景的燃料电池 燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。目前燃料电池的能量转化率可达近80%,约为火力发电的2倍。这是因为火力发电中放出的废热太多。燃料电池的噪声及硫氧化物、氮氧化物等废气污染都接近0。 问题讨论: 作为一个电池的消费者,你希望使用怎样的电池?假如你是一个电池的研究生产者,你应该开发生产怎样的电池? 职业规划: 阅读课本化学与职业----电池研发人员,希望将来你成为一个出色的电池研究员。 研究与实践-------了解车用能源
H2热值123KJ/g 2H2+O2 2H2O
CH4热值56KJ/g CH4+2O2 CO2+2H2O
C8H18热值48KJ/g 2C8H18 + 25O2 16CO2 + 18H2O
C2H5OH+3O2 2CO2↑+3H2O 从反应和热值来考虑:H2放出热量最多,而且不会产生温室气体CO2,是最理想的能源。
随堂练习 1.利用反应Zn+ CuSO4 ===ZnSO4+Cu设计一个原电池。在图中方格内画出实验装置图,并指出正极为_______________,电极反应式为_______________________;负极为___________,电极反应式为_____________________。
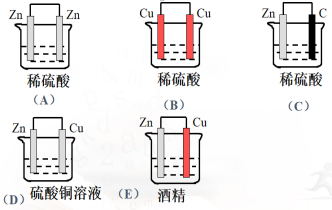
2.(课本41页第5题)下列关于如图所示装置的叙述,错误的是( ) A、锌是负极、其质量逐渐减小 B、氢离子在铜表面被还原,产生气泡 C、电流从锌片经导线流向铜片 D、电子从锌片经导线流向铜片 答案为:C 【解析】锌铜稀硫酸原电池中,锌为负极,铜为正极,电流由铜经导线流向锌,电子从锌经导线流向铜,故C错误 3.(课本41页第6题)下列说法正确的是( ) A、图1所示装置能将化学能转化为电能 B、图2所示反应为吸热反应 C、锌锰干电池中,锌筒做正极 D、蓄电池充电时也发生了氧化还原反应
答案为:D 【解析】A、图1不能形成闭合回路,不能构成原电池; B、图2反应物能量高于生成物,为放热反应;‘ C锌锰干电池中,锌作负极; D、蓄电池放电和充电均发生了氧化还原反应。
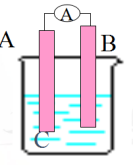
A、A是锌,B是铜,C为稀H2SO4 B、A是铜,B是锌,C为稀硫酸 C、A是铁,B是银,C为AgNO3溶液 D、A是Ag,B是铁,C为AgNO3溶液 5.下列图片可构成原电池的是( )
答案为:C、D 6.写出电极反应式和总反应式 正极:(C) Cu2+ + 2e - = Cu(还原反应) 负极:(Zn) Zn -2e - = Zn2+ (氧化反应) 总反应:Zn+Cu2+=Zn2++Cu
正极 :(Cu)2Ag+ + 2e - = Ag (还原反应) 负极 :(Fe)Fe -2e - = Fe2+ (氧化反应) 总反应:Fe+2Ag+=Fe2++2Ag |
|
| ||||||||||||||||||
课堂小结 | 一、与原 电 池 相 关 的 概 念(Zn--Cu,稀H2SO4)
正极:电子流入的一极(Cu)
内电路:阴离子流动方向与电子流动方向一致; 阳离子流动方向与电流方向一致 3.电极反应式 负极: Zn-2e-= Zn2+ 正极: 2H++ 2e-= H2↑ 4.总反应式:Zn+ 2H+ = Zn2+ + H2↑ 二.发展中的化学电源 一次性电池——干电池:普通锌锰电池、碱性锌锰电池。 二次电池(充电电池):铅蓄电池、镍镉充电电池、锂电池。 燃料电池:氢氧燃料、CH4燃料电池
|
|
| ||||||||||||||||||
板书 | 一、化学能与电能的相互转化 二、原电池 三、常见的化学电池 |
|
| ||||||||||||||||||
高中人教版 (2019)第一节 化学反应与能量变化背景图课件ppt: 这是一份高中人教版 (2019)<a href="/hx/tb_c4000040_t3/?tag_id=26" target="_blank">第一节 化学反应与能量变化背景图课件ppt</a>,共1页。
高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化试讲课ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化试讲课ppt课件,文件包含新人教版必修2化学61《化学反应与能量变化》课件pptx、61化学反应和能量变化1教案doc等2份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
化学第一节 化学反应与能量变化精品课件ppt: 这是一份化学第一节 化学反应与能量变化精品课件ppt,共60页。PPT课件主要包含了原电池原理,化学电源,微判断,尝试解答,微训练等内容,欢迎下载使用。