





- 《电离平衡》第二课时课件PPT+教学设计 课件 24 次下载
- 《电离平衡》第三课时课件PPT+教学设计 课件 22 次下载
- 《水的电离和溶液的PH》第二课时课件+教学设计 课件 18 次下载
- 《水的电离和溶液的PH》第三课时课件+教学设计 课件 17 次下载
- 《盐类的水解》第一课时课件PPT+教学设计 课件 21 次下载
《水的电离和溶液的PH》第一课时课件PPT+教学设计
展开(人教版高中化学选择性必修1)
《水的电离和溶液的PH》第一课时 教学设计
课题名 | 《水的电离和溶液的PH》第一课时 |
教材分析 | 本节课要求学生认识水的电离,了解水的离子积常数,理解水的电离平衡及影响因素,认识pH与c(H+)之间的关系,了解pH的简单测定方法,了解溶液pH的调控在工农业生产和科学研究中的应用。 |
教学目标 | 宏观辨识与微观探析:认识水的电离,了解水的离子积常数,理解水的电离平衡及影响因素。 证据推理与模型认知:认识水的电离存在电离平衡,了解水的电离平衡的影响因素,知道水的离子积常数,会分析水的电离平衡移动。 科学精神与社会责任:认识pH与c(H+)之间的关系,了解pH的简单测定方法,了解溶液pH的调控在工农业生产和科学研究中的应用。 |
教学重点 | 认识水的电离,了解水的离子积常数,理解水的电离平衡及影响因素,认识pH与c(H+)之间的关系。 |
教学难点 | 水的离子积常数的有关计算,理解水的电离平衡及影响因素。 |
教学方法 | 讲解,举例 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
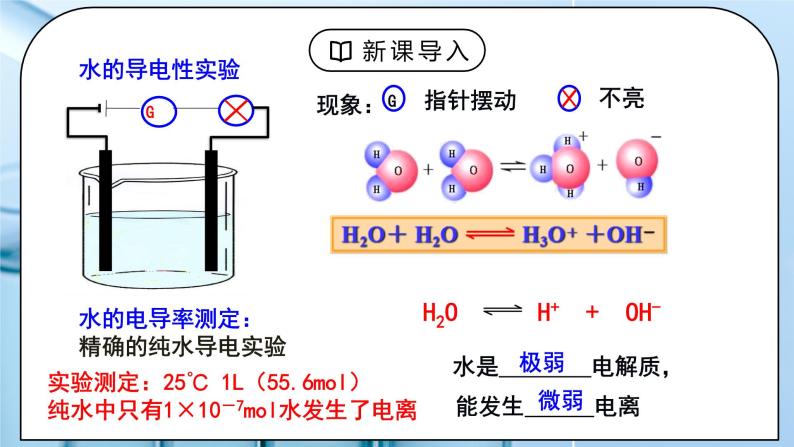
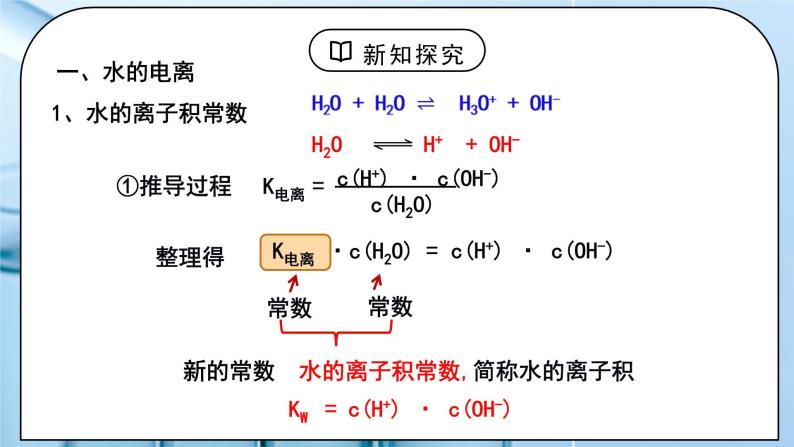
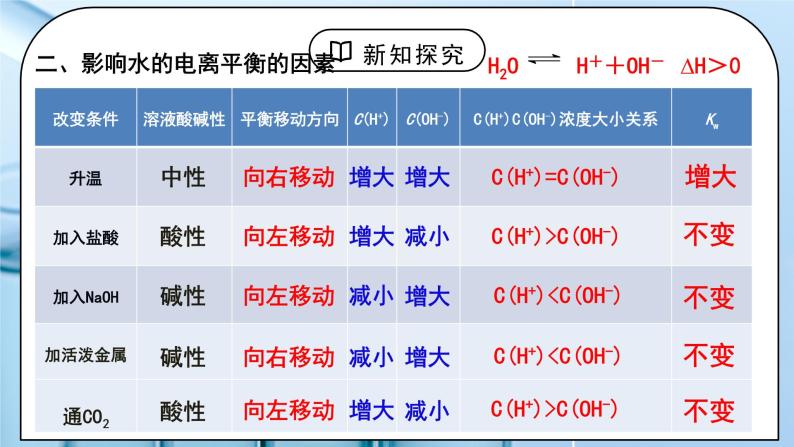
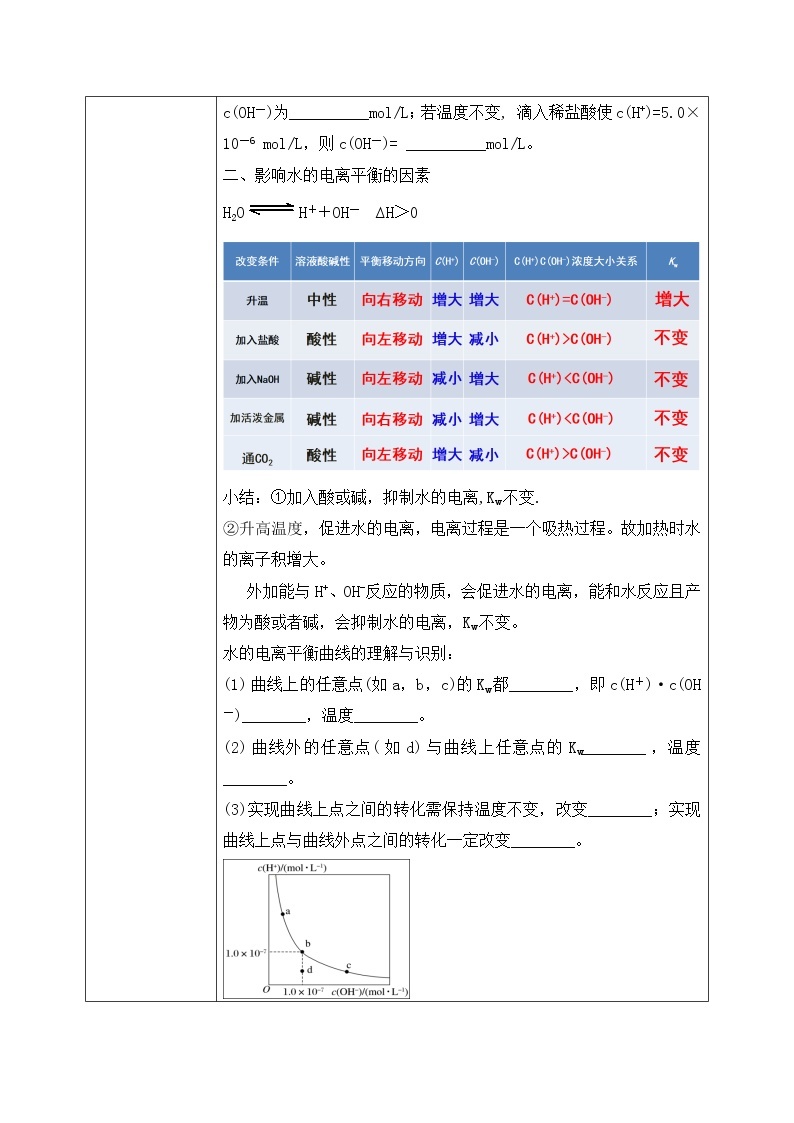
教学过程 | 一、新课导入 1.水的导电性实验 教师:水的电导率测定:精确的纯水导电实验 实验测定:25℃ 1L(55.6mol),纯水中只有1×10-7mol水发生了电离 H2OH++OH- 水是极弱电解质,能发生微弱电离。 学生:体会水是极弱电解质,能发生微弱电离。 [设计意图]让学生体会水是极弱电解质,能发生微弱电离。为学习水的离子积常数和影响水电离的因素做准备。 二、探究新知 1.一、水的电离 教师:1、水的离子积常数 ①推导过程 ②定义:当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,叫做水的离子积常数,简称水的离子积,记作KW。 ③表达式:Kw =c(H+)·c(OH-) ④影响因素:室温时,纯水中:c(H+)=c(OH-)=10-7 25℃,Kw =10-14 KW 只受温度影响 100℃: Kw = 54.5×10-14 ≈ 1.0×10-12 【思考与讨论】1.试分析酸(或碱)溶液中c(H+)、c(OH-)的来源,并确定Kw满足的关系式。 酸溶液中:如HCl溶液: KW = [c酸(H+) +c水(H+)]·c水(OH-)≈ c酸(H+) ·c水(OH-) 碱溶液中:如NaOH溶液: KW = c水(H+) ·[c碱(OH-) +c水(OH-)]≈ c水(H+) ·c碱(OH-) 结论:KW =C(H+)溶×C(OH-)溶 适用于中性、酸、碱、盐溶液 2. 在酸(或碱)溶液中水电离出的c(H+)与c(OH-)还相等吗? 任何中性、酸、碱、盐溶液中都满足:c水(H+) =c水(OH-) ⑤Kw的定量计算 1)25℃时,某溶液中,c(H+)=1x10-6mol/L,问c(OH-)是多少? 2)25℃时,某溶液中,c(OH-)=1x10-1mol/L,问c(H+)是多少? 3)常温下,0.1mol/L的HCl溶液中,水电离出的c(H+)和c(OH-)各是多少? 4)常温下,0.1mol/L的NaOH溶液中,水电离出的c(H+)和c(OH-)各是多少? 5)某温度下,纯水中的c(H+)=2.0×10-7mol/L, 则此时溶液的 c(OH-)为__________mol/L;若温度不变, 滴入稀盐酸使c(H+)=5.0×10-6 mol/L,则c(OH-)= __________mol/L。 二、影响水的电离平衡的因素 H2OH++OH- ∆H>0 小结:①加入酸或碱,抑制水的电离,Kw不变. ②升高温度,促进水的电离,电离过程是一个吸热过程。故加热时水的离子积增大。 外加能与H+、OH-反应的物质,会促进水的电离,能和水反应且产物为酸或者碱,会抑制水的电离,Kw不变。 水的电离平衡曲线的理解与识别: (1) 曲线上的任意点(如a,b,c)的Kw都________,即c(H+)·c(OH-)________,温度________。 (2)曲线外的任意点(如d)与曲线上任意点的Kw________,温度________。 (3)实现曲线上点之间的转化需保持温度不变,改变________;实现曲线上点与曲线外点之间的转化一定改变________。 三、溶液的酸碱性与c(H+)、c(OH-)的关系 1、水的离子积 Kw 不仅适用于纯水,也适用于稀的电解质水溶液。 常温时:KW=c(H+) · c(OH-) =1×10-14 中性溶液:c(H+) = c(OH-)c(H+) =1×10-7mol/L 酸性溶液:c(H+) > c(OH-)c(H+) >1×10-7mol/L 碱性溶液:c(H+) < c(OH-)c(H+) <1×10-7mol/L 【思考与讨论】同学们,我们是否可以用pH=7来判断溶液的酸碱性? pH的使用是有条件的 pH定义:c(H+)的负对数 关系式:pH=-lgc(H+) c(H+)=10-pH 2、室温下水溶液中pH、 c(H+)与酸碱性的关系 室温下:pH=7, c(H+) = c(OH-),溶液显中性; pH<7, c(H+) > c(OH-),溶液显酸性; pH>7, c(H+) < c(OH-),溶液显碱性。 适用范围:c(H+)和c(OH-)都较小的稀溶液(<1 mol/L 3、溶液pH的测定 ①定性测量:酸碱指示剂 只能粗略测定溶液的pH范围,不能准确测定出pH的具体值 ②定量测量: (1) pH试纸 使用方法:取一小段pH试纸于干燥洁净的玻璃片(或表面皿)上, 用干燥洁净的玻璃棒蘸取待测液点在干燥试纸的中央,当试纸颜色变化稳定后与标准比色卡对照,读出pH。 类型:广泛pH试纸:其pH范围是1~14,可以识别的pH差约为1。 精密pH试纸:可判别0.2或0.3的pH差值。 专用pH试纸:用于酸性、中性或碱性溶液。 (2)pH计 pH计,又叫酸度计,可用来精密测量溶液的pH,其量程为1~14,可识别的pH差:0.01。 四、pH的应用 人体各种体液都有一定的pH,血液的pH是诊断疾病的一个重要参数。 洗发的护发素可以调节头发pH使之达到适宜酸碱度。 环保领域,酸性或碱性的废水处理常常利用酸碱中和反应,中和过程中可用pH自动测定仪进行检测和控制。 农业生产中,土壤的pH会影响植物对不同形态养分的吸收及养分的有效性。 科学实验和工业生产中,溶液pH的控制会影响实验结果或产品质量、产量等。 酸碱中和滴定中,溶液pH的变化可作为判断滴定终点的依据。 学生:练习1:一定温度下,水存在H2O⇌H+ + OH-的平衡,下列叙述一定正确的是( ) 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 B. 将水加热,Kw增大,pH减小 C. 向水中加入少量冰醋酸,平衡逆向移动,c(H+)降低 D. 向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L,Kw不变 练习2:下表是不同温度下水的离子积数据:试回答下列问题: (1)若25<t1<t2,则Kw_____(填“>”“<”或“=”)1×10-14,做出此判断的理由是_______________________________________ (2)在t1℃时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为_________________。该温度下,测得某H2SO4溶液中 c(H+)=5×10-6mol·L-1,该溶液中c(OH-)=_______________mol·L-1。 练习3:一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( ) A.该温度下,a点溶液呈碱性 B.该温度下,0.01 mol·L-1NaOH溶液中c(H+) =1.0×10-12 mol·L-1 C.该温度下,加入NaOH可能引起由d向b的变化 D.b点时,升高温度,可能引起由b向c的变化 练习4:(1)常温下,某溶液中由水电离出来的c(H+)=1.0×10-11 mol·L-1,该溶液可能是________。 ①二氧化硫的水溶液 ②氯化钠水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液 (2)某温度下,纯水的c(H+)=2×10-7 mol·L-1,则此时纯水的c(OH-)为__________________。若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·L-1,则溶液中c(OH-)为________________,此时温度______(填“高于”“低于”或“等于”)25 ℃。 练习5:常温下,在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( ) ① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42- ④ Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3- A.①③ B.③⑤ C.③④ D.②⑤ [设计意图]让学生知道水的离子积常数,会分析影响水的电离平衡的因素,掌握溶液的酸碱性与c(H+)、c(OH-)的关系。 |
板书设计 | 一、水的电离 1、水的离子积常数 K W =C(H+)溶×C(OH-)溶 25℃,Kw =10-14 c水(H+) =c水(OH-) 二、影响水的电离平衡的因素 三、溶液的酸碱性与c(H+)、c(OH-)的关系 酸性溶液: c(H+) > c(OH-) 中性溶液: c(H+) = c(OH-) 碱性溶液: c(H+) < c(OH-) |
课后作业 |
练习册上相关习题 |
教学反思 | 亮点:本课从水的导电性实验入手,深入讲解了水的离子积常数的推导,定义,表达式和计算。补充了水的电离平衡曲线的理解与识别。 课堂教学建议:本节课理论知识较多,教师应多总结,采用讲练结合的方法,让学生理解透彻,学会解题。 |










