





- 3.3.1盐类水解课件 课件 2 次下载
- 4.1.1 原电池课件 课件 2 次下载
- 4.1.2 化学电源课件 课件 3 次下载
- 4.3第三节金属的腐蚀与防护 课件 课件 2 次下载
- 第4章 化学反应与电能 实验活动4 课件 课件 2 次下载
人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律获奖ppt课件
展开生成使湿润碘化钾淀粉试纸变蓝色的气体
电解CuCl2 溶液生成单质Cu和Cl2。
CuCl2 溶液在直流电的作用下为什么会生成单质Cu和Cl2呢?
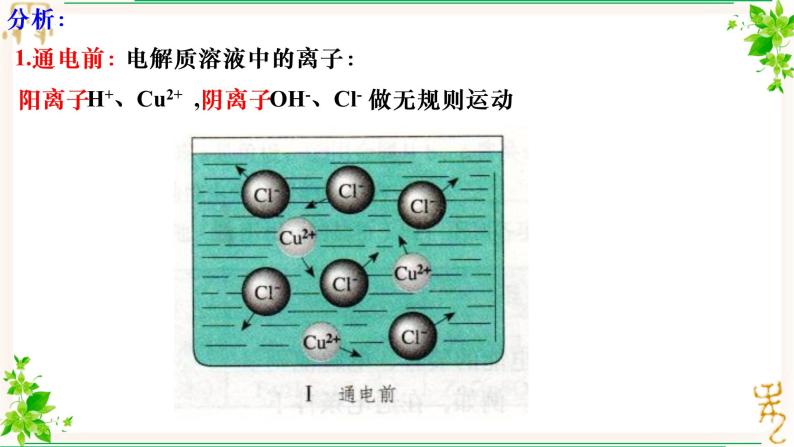
1.通电前:电解质溶液中的离子:
阳离子H+、Cu2+ ,阴离子OH-、Cl- 做无规则运动
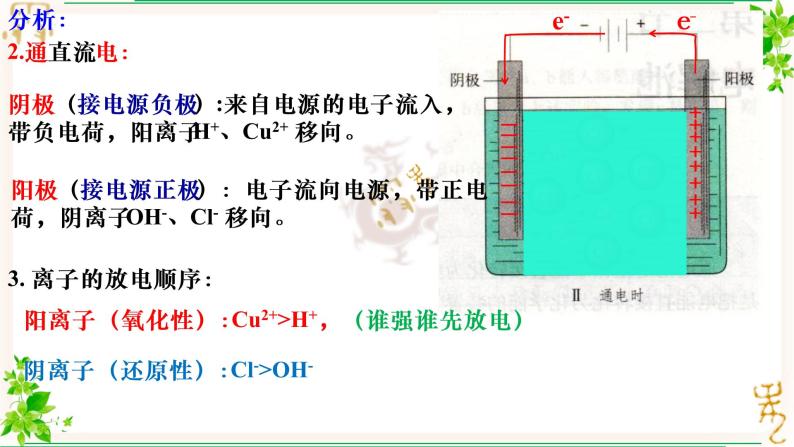
2.通直流电:
阴极(接电源负极):来自电源的电子流入,带负电荷,阳离子H+、Cu2+ 移向。
阳极(接电源正极):电子流向电源,带正电荷,阴离子OH-、Cl- 移向。
3. 离子的放电顺序:
阳离子(氧化性):Cu2+>H+,
阴离子(还原性):Cl->OH-
5. 电解质溶液的变化:
氯化铜溶液浓度_______。
Cu2++2e- = Cu
2Cl-- 2e- =Cl2 ↑
使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程。
(1)外加直流电源(2)与电源相连的两个电极:阳极(氧化反应)、阴极(还原反应)(3)电解质溶液或熔化的电解质
把电能转化为化学能的装置.
离子在电极上得、失电子,发生氧化还原的过程。
电解质溶液的导电过程就是电质溶液的电解过程。
电子从外加电源的负极流出,流到电解池的阴极,再从阳极流回电源正极。(注:电子只在外电路定向移动,不能从溶液中移动)
阳离子移向阴极, 阴离子移向阳极.
惰性(铂、金、石墨):
活性(除铂、金外的金属):
一般只导电,不参与反应
活性阳极>S 2->SO32->I->Br->Cl->OH->NO3->SO42-(氧酸根)>F-
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>(H+)(水)>Al3+>Mg2+>Na+>Ca+>K+
9.电解规律(惰性电极)
4OH--4e-=O2↑+2H2O
4H+ + 4e- = 2H2↑
2Cl- -2e-=Cl2↑
2H+ +2e- =H2↑
2Cl- - 2e-= Cl2↑
Cu2++2e- = Cu
2Cl- - 2e- = Cl2↑
2H++2e- = H2↑
4OH- - 4e- = O2↑+2H2O
2Cu2++4e- =2Cu
由相互联系、相互作用的若干部分组成并具有一定功能的整体称为系统。作为事物的一种普遍存在形式,系统无处不在。例如,原电池、电解池各自都可以看作一个系统。基于系统思想的研究方法,注重分析与综合、局部与整体、结构与功能、系统与环境等方面的相互联系和作用。例如,在比较原电池和电解池的异同时,可以认识到:作为一个系统,原电池和电解池的装置构成是基本相同的;工作时,它们都涉及电极上发生的氧化还原反应及中解质溶液中阴、阳离子的定向迁移;不同之处在于,原电池是系统发生化学反应对环境做电功,电解池则是环境对系统做电功并使其发生化学反应;等等。学会运用系统思想与方法,会对你今后的学习带来启发和帮助。
阴极:
(2H2O +2e- = H2↑ +2OH-)-
有气泡产生,滴加酚酞溶液变红
产生使湿润淀粉-KI溶液变蓝的气体
2H++2e- =H2↑
2Cl--2e- =Cl2↑
氯碱工业:离子交换膜法制烧碱
(2)阳离子交换膜的作用:
阴极:碳钢 , 阳极:钛
只允许阳离子通过(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室,防止氢气和氯气混合而引起爆炸;避免氯气和氢氧化钠反应生成 ,而影响氢氧化钠的产量。
H2O(含少量NaOH)
电 解 饱 和 食 盐 水
图4-1 氯碱工业产品及其应用
粗铜:含杂质(Zn Fe Ni Ag Au 等)
Zn-2e- = Zn2+Fe -2e- = Fe2+Ni -2e-= Ni2+Cu-2e-= Cu2+
Zn Fe Ni CuAg Au
Cu2+ + 2e- =Cu
问题:电解完后,CuSO4溶液的浓度有何变化?
溶液中CuSO4的浓度保持不变
现象:阴极(Fe):阳极(Cu):
Cu2++2e- = Cu
Cu -2e- =Cu2+
利用电解原理在某些金属表面镀上一薄层其他金属或合金的过程。
电镀可以使金属更加美观耐用,增强防锈抗腐能力。例如,钢铁是人们最常用的金属,但钢铁有个致命的缺点,就是它们易被腐蚀。防止钢铁发生腐蚀的一种最常用方法就是在其表面镀上其他金属,如锌、铜、铬、镍等。
阴极——待镀金属制品
含有镀层金属离子的电解质溶液
阴极:2Na+ + 2e- =2Na阳极:2Cl--2 e- =Cl2↑
4Al3+ + 12e- =4Al
6O2--12 e- =3O2↑
Mn++ne- =M(还原反应)
电解池、电解精炼池、电镀池的比较
将电能转变成化学能的装置。
应用电解原理在某些金属表面镀上一层其它金属的装置。
①两电极接直流电源②电极插人电解质溶液③形成闭合回路
①镀层金属接电源正极待镀金属接电源负极②电镀液须含有镀层金属的离子
阳极:电源正极相连阴极:电源负极相连
阳极:镀层金属;阴极:镀件
阳极:氧化反应阴极:还原反应
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极②电解质溶液须待提纯金属的离子
阳极:不纯金属;阴极:纯金属
1.为下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是A.X是正极,Y是负极B.X是负极,Y是正极C.CuSO4溶液的PH值逐渐减小D.CuSO4溶液的PH值不变
2 .铂电极电解1LCu(NO3)2和KNO3混合溶液,通电一段时间,两极均产生11.2L(标况)气体.求电解后溶液的pH,并确定析出铜的物质的量.
阳极转移电子的物质的量为: 11.2L ÷ 22.4L/ml×4 = 2ml, 产生H+ :2ml. 阴极生成0.5mlH2,消耗H+ 1ml;所以溶液中c(H+)=1ml/L, pH=0 生成H2转移的电子:0.5 ×2=1ml,故还有1mle- 用于还原Cu2+,可析出铜为0.5ml.
电解计算——电子守恒法
2H2O-4e-= 4H+ +O2↑
Cu2++2e- =Cu↓
(4OH - -4e - =2H2O + O2 ↑)
O2~2Cu~4Ag~4H+~2H2~2Cl2~4OH- ~4e-
3. 用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为( ) A. 1ml/L B. 2ml/L C. 3ml/L D. 4ml/L
阳极O2为0.1ml,转移电子0.4ml
H2为0.1ml,转移电子0.2ml,所以Cu转移电子0.2ml, 所以c(Cu2+)为1ml/L,浓度为A.
4.2000年希腊化学家斯佳在《科学》杂志上公布了他的新发明在常压下把氢气与氮气通入一加热到570℃的电解池(如图)氢氮在电极上合成氨,而且转化率高于哈伯法的五倍,达到80%.
该电解池采用了能传导某种离子( H+、 Li+、F-、 O2- )的固体复合氧化物为电解质(简称SCY),吸附在SCY内外侧表面的金属钯多孔多晶薄膜为电极。写出上文中电解池的阴阳极反应式和电解池总反应式。
N2+6e-+6H+=2NH3
3H2-6e-=6H+
人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池一等奖课件ppt: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002435_t3/?tag_id=26" target="_blank">第四章 化学反应与电能第二节 电解池一等奖课件ppt</a>,文件包含43电解池ppt、实验4-2电解氯化铜溶液mp4等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
人教版 (2019)选择性必修1第二节 电解池一等奖ppt课件: 这是一份人教版 (2019)选择性必修1第二节 电解池一等奖ppt课件,共21页。PPT课件主要包含了学习目标,实验4-2,析出金属铜,产生了氯气,实验原理分析,通电后,②电极反应,←e-,e-←,Cu2+>H+等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 电解池优秀ppt课件: 这是一份人教版 (2019)选择性必修1第二节 电解池优秀ppt课件,共24页。PPT课件主要包含了思考上述装置的缺点,电解精炼,精铜精炼,电冶金等内容,欢迎下载使用。













