






初中课题 1 质量守恒定律优质教学ppt课件
展开人教版九年级化学上册
《质量守恒定律》教学设计
课题名称 | 质量守恒定律 | ||||||||||||||||||||||||||||||
教学目标 | 1.知道实验探究的一般步骤,能正确描述实验现象并做出分析得出结论。 2.正确理解质量守恒定律的内容并解释生活中现象,了解化学方程式的含义及其表示的意义。 3.会从质、量、数等方面读化学方程式,利用化学方程式求出化学反应中各物质的质量比。 | ||||||||||||||||||||||||||||||
教学重点 | 质量守恒定律的意义,利用化学方程式求出化学反应中各物质的质量比。 | ||||||||||||||||||||||||||||||
教学难点 | 认识质量守恒定律的微观本质 | ||||||||||||||||||||||||||||||
教学准备 | 教师准备:课件,托盘天平、烧杯、锥形瓶、试管、镊子、药匙、铁钉、硫酸铜溶液、碳酸钠粉末、稀盐酸、镁带、火柴、坩埚钳、酒精灯等。 学生准备:复习化学表达式。 | ||||||||||||||||||||||||||||||
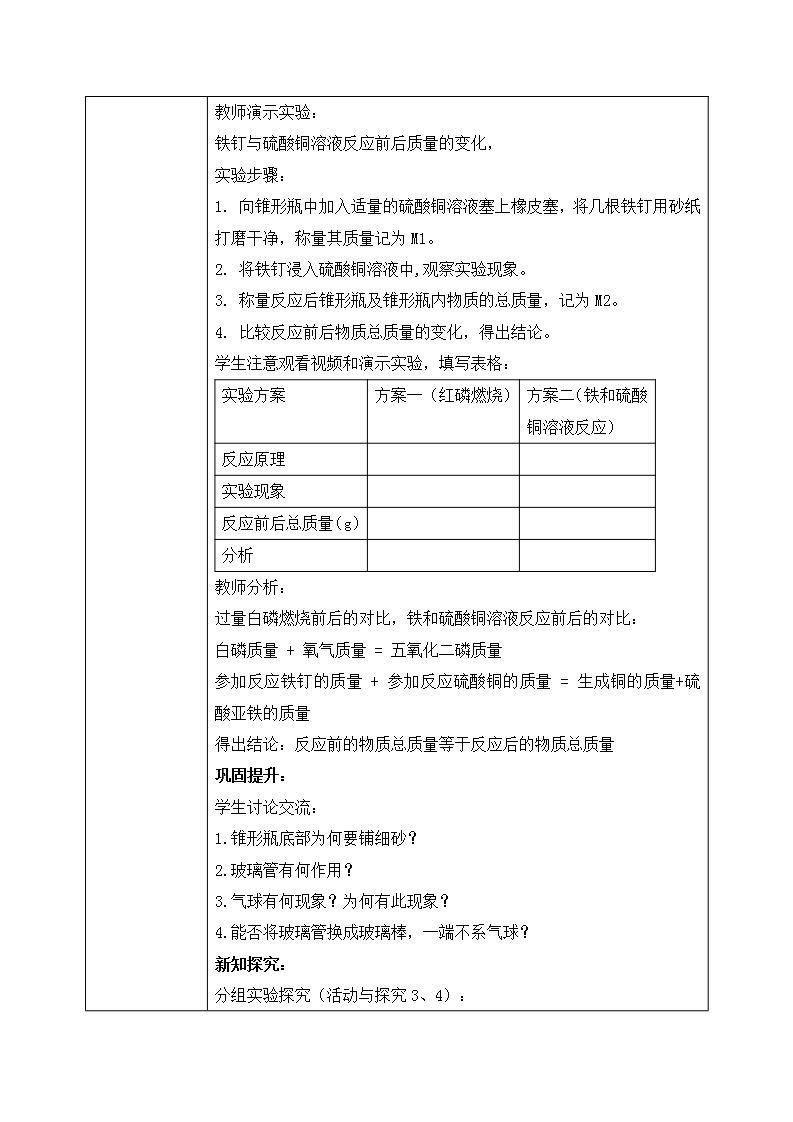
教学过程 | 新课导入: 教师播放拉瓦锡与质量守恒,引入新课。 新知探究: 一、质量守恒定律 实验探究活动的一般步骤:提出假设,设计方案,进行实验,实验分析,得出结论。 【实验探究】:参加反应的物质总质量和生成的物质总质量有什么关系呢? 提出假设:可能大于? 小于? 等于?。。。 活动与探究1: 教师播放红磷燃烧前后质量的测定(视频) 活动与探究2: 教师演示实验: 铁钉与硫酸铜溶液反应前后质量的变化, 实验步骤: 1. 向锥形瓶中加入适量的硫酸铜溶液塞上橡皮塞,将几根铁钉用砂纸打磨干净,称量其质量记为M1。 2. 将铁钉浸入硫酸铜溶液中,观察实验现象。 3. 称量反应后锥形瓶及锥形瓶内物质的总质量,记为M2。 4. 比较反应前后物质总质量的变化,得出结论。 学生注意观看视频和演示实验,填写表格:
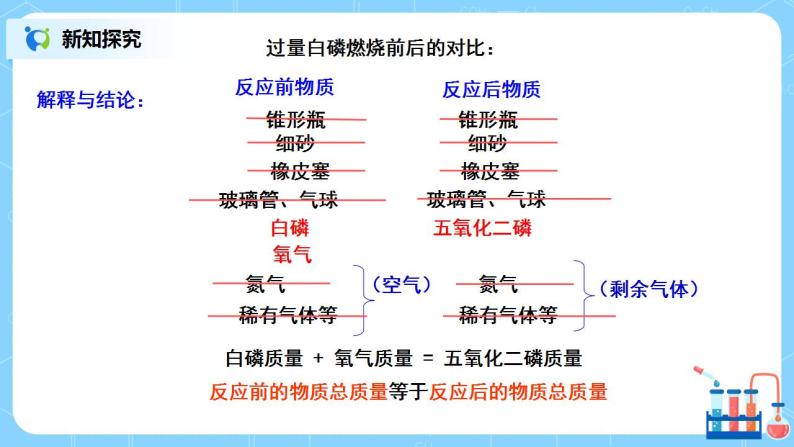
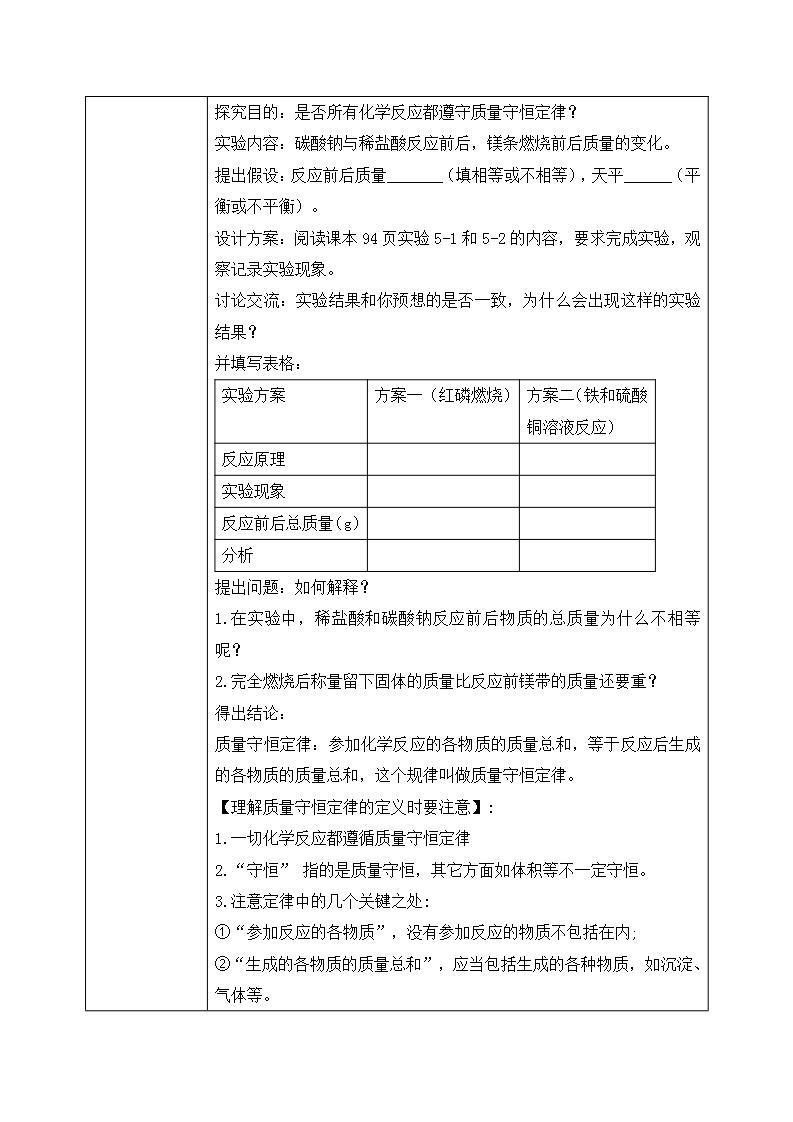
教师分析: 过量白磷燃烧前后的对比,铁和硫酸铜溶液反应前后的对比: 白磷质量 + 氧气质量 = 五氧化二磷质量 参加反应铁钉的质量 + 参加反应硫酸铜的质量 = 生成铜的质量+硫酸亚铁的质量 得出结论:反应前的物质总质量等于反应后的物质总质量 巩固提升: 学生讨论交流: 1.锥形瓶底部为何要铺细砂? 2.玻璃管有何作用? 3.气球有何现象?为何有此现象? 4.能否将玻璃管换成玻璃棒,一端不系气球? 新知探究: 分组实验探究(活动与探究3、4): 探究目的:是否所有化学反应都遵守质量守恒定律? 实验内容:碳酸钠与稀盐酸反应前后,镁条燃烧前后质量的变化。 提出假设:反应前后质量_______(填相等或不相等),天平______(平衡或不平衡)。 设计方案:阅读课本94页实验5-1和5-2的内容,要求完成实验,观察记录实验现象。 讨论交流:实验结果和你预想的是否一致,为什么会出现这样的实验结果? 并填写表格:
提出问题:如何解释? 1.在实验中,稀盐酸和碳酸钠反应前后物质的总质量为什么不相等呢? 2.完全燃烧后称量留下固体的质量比反应前镁带的质量还要重? 得出结论: 质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。 【理解质量守恒定律的定义时要注意】: 1.一切化学反应都遵循质量守恒定律 2.“守恒” 指的是质量守恒,其它方面如体积等不一定守恒。 3.注意定律中的几个关键之处: ①“参加反应的各物质”,没有参加反应的物质不包括在内; ②“生成的各物质的质量总和”,应当包括生成的各种物质,如沉淀、气体等。 ③审题时要注意关键的字,如“充分反应”、“恰好完全反应” 、“足量反应”等字所表示的意义。 微观解释:—反应前后原子种类没有改变 —反应前后原子数目没有增减 —反应前后原子质量没有变化 巩固提升: 归纳:化学反应前后不变:宏观:元素种类、质量、物质的总质量 微观:原子的种类、数目、质量不变。 化学反应前后改变:宏观:物质种类 微观:分子种类 化学反应前后可能变:宏观:化合价 微观:分子数目 新知探究: 二、化学方程式 教师讲解引导学生分析完成填空: 1.化学方程式的定义: 这种用化学式表示化学反应的式子,叫做化学方程式。 2.化学方程式的意义: (1)表示出了反应物、生成物以及反应条件。 (2)表示出了反应物与生成物间的质量比。 (3)从微观上看,还能表示化学反应中各物质之间的微粒个数比。 3.化学方程式的读法:(以木炭燃烧为例) (1)宏观读法:_____和_____在点燃的条件下生成了_______。 (2)质量读法:每___份质量的碳与____份质量的氧气完全反应,生成 _____份质量的二氧化碳。 (3)微观读法:每___个碳原子和___个氧分子在点燃时生成 ____个二氧化碳分子。 课堂练习: 1.克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有______克氧气参加了反应。 2.某种化合物完全燃烧,生成CO2和H2O,则此化合物中一定含有的元素是?可能含有的元素是? 3.某发电厂烟气处理的新工艺:CH4十2X= N2+CO2+2H2O, 则X的化学式为( ) A. NO2 B.CO C. O2 D. N2 4.下列叙述符合质量守恒定律的是( ) A.水加热变成水蒸气,变化后质量相等 B.50mL水与50ml酒精混合不等于100mL C.在90g水中含有10g氢气和80g氧气 D.1g硫与1g氧气化合生成2g二氧化硫 课堂小结: 一、质量守恒定律 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。 二、化学方程式 1.化学方程式的含义及其表示的意义。 2.从质、量、数等方面读化学方程式。 3.如何利用化学方程式求出化学反应中各物质的质量比。 | ||||||||||||||||||||||||||||||
布置作业 | 1.完成同步练习 2.课后习题:1.2.3.4 | ||||||||||||||||||||||||||||||
板书设计 | 课题1质量守恒定律 一、质量守恒定律 1.定义:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。 2.注意问题 3.质量守恒定律的微观解释。 二、化学方程式 1.化学方程式的含义及其表示的意义。 2.从质、量、数等方面读化学方程式。 3.如何利用化学方程式求出化学反应中各物质的质量比 | ||||||||||||||||||||||||||||||
教学反思 | 本节课设计了许多化学实验探究活动,由于学生们的参与,使得课堂气氛活跃,培养了学生的探究兴趣,在获得化学知识的同时,受到了科学方法的训练,体验了探究的乐趣,同时使学生认识到了定量研究的重要性,形成和发展了学生的科学素养. 由化学反应的实质的分析,在理论依据上支持了质量守恒定律。给学生理论结合实际的科学体验。这样的教学,增强了本节课的色彩,教学效果明显。 |
2021学年第五单元 化学方程式课题 1 质量守恒定律背景图ppt课件: 这是一份2021学年第五单元 化学方程式课题 1 质量守恒定律背景图ppt课件,共25页。PPT课件主要包含了二氧化碳,微观质量比,实际质量比,H2O,CO2,Cl2,CH4,质量守恒定律,点石成金,变水为油等内容,欢迎下载使用。
九年级上册课题 1 质量守恒定律授课免费ppt课件: 这是一份九年级上册课题 1 质量守恒定律授课免费ppt课件,共26页。PPT课件主要包含了提出问题,有空气进来啦,讨论一下等内容,欢迎下载使用。
初中化学人教版九年级上册课题 1 质量守恒定律精品ppt课件: 这是一份初中化学人教版九年级上册课题 1 质量守恒定律精品ppt课件,文件包含511质量守恒定律ppt、镁条燃烧mp4等2份课件配套教学资源,其中PPT共29页, 欢迎下载使用。