

高中化学人教版 (2019)必修 第一册第二节 元素周期律第2课时导学案及答案
展开第2课时 元素周期表和元素周期律的应用
课程解读
课标要点 | 学科素养 |
元素周期表 | 认识元素周期表是学习、研究和应用化学的一种重要工具 |
元素周期律的应用 | 通过掌握元素周期表的结构和元素在周期表中的位置培养学生的证据推理与模型认知能力 |
(见学生用书P78)
1.金属和非金属元素分区规律
虚线附近的元素既能表现出一定的__金属__性,又能表现出一定的__非金属__性。
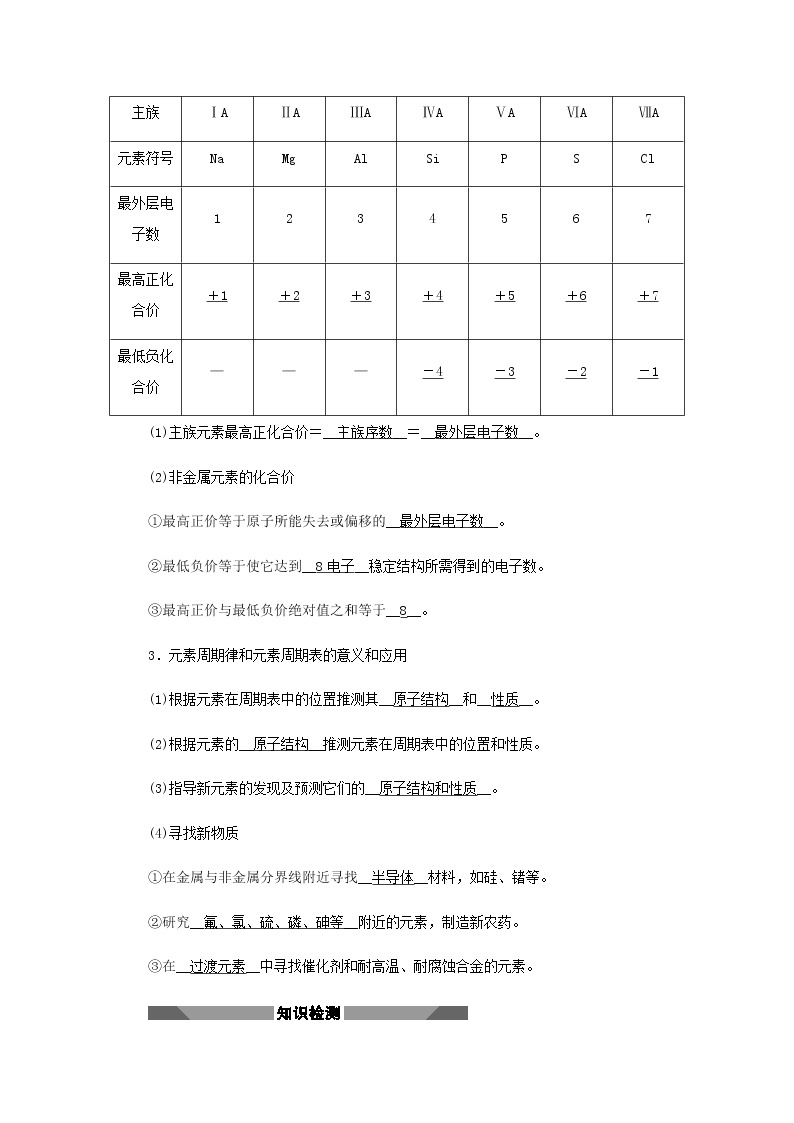
2.元素化合价与元素在周期表中位置的关系
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
元素符号 | Na | Mg | Al | Si | P | S | Cl |
最外层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
最高正化合价 | +1 | +2 | +3 | +4 | +5 | +6 | +7 |
最低负化合价 | — | — | — | -4 | -3 | -2 | -1 |
(1)主族元素最高正化合价=__主族序数__=__最外层电子数__。
(2)非金属元素的化合价
①最高正价等于原子所能失去或偏移的__最外层电子数__。
②最低负价等于使它达到__8电子__稳定结构所需得到的电子数。
③最高正价与最低负价绝对值之和等于__8__。
3.元素周期律和元素周期表的意义和应用
(1)根据元素在周期表中的位置推测其__原子结构__和__性质__。
(2)根据元素的__原子结构__推测元素在周期表中的位置和性质。
(3)指导新元素的发现及预测它们的__原子结构和性质__。
(4)寻找新物质
①在金属与非金属分界线附近寻找__半导体__材料,如硅、锗等。
②研究__氟、氯、硫、磷、砷等__附近的元素,制造新农药。
③在__过渡元素__中寻找催化剂和耐高温、耐腐蚀合金的元素。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)根据元素周期律可知金属性最强的是铯,非金属性最强的是氦。( × )
(2)锗元素属于金属元素,但也具有一定的非金属性。( √ )
(3)主族元素最高正价与最低负价的绝对值之和等于8。( × )
(4)金属元素只表现金属性,非金属元素只表现非金属性,不表现金属性。( × )
(5)高氯酸(HClO4)是酸性最强的含氧酸,所以氯元素是非金属性最强的元素。( × )
(6)在周期表中的氯、磷、硫元素附近探索研制农药的材料,所以这几种元素的化合物都有毒。( × )
2.下列说法中不正确的是( D )
A.19世纪中叶,门捷列夫的突出贡献是发现元素周期律
B.在金属元素和非金属元素交界处最容易找到半导体材料
C.在过渡元素中容易找到制造优良催化剂和耐高温、耐腐蚀合金的元素
D.根据硼在元素周期表中的位置,推测硼的最高价含氧酸的化学式可能是HBO3
【解析】A项,19世纪中叶,门捷列夫的突出贡献是发现元素周期律,正确;B项,在金属元素和非金属元素交界处的元素具有一定的金属性和非金属性,因此最容易找到半导体材料,正确;C项,过渡元素都是金属元素,从中可以找到制造优良催化剂和耐高温、耐腐蚀合金的元素,正确;D项,硼与铝同主族,铝的最高价氧化物对应的水化物为Al(OH)3或H3AlO3,则硼的最高价含氧酸的化学式可能是H3BO3,错误。
3.(1)短周期元素R的氢化物的化学式为H2R,则该元素最高价氧化物对应水化物的化学式是什么?
(2)为什么说元素周期表是元素周期律的具体表现形式?
(3)从第ⅢA族的硼到第ⅦA族的砹连成一条斜线,即为金属元素和非金属元素的分界线,分界线附近元素的性质有何特点?这些元素可制取什么材料?
(4)如何比较氢氧化钙和氢氧化铝的碱性强弱?
答:(1)该元素最高价氧化物对应水化物的化学式为H2RO4。
(2)元素周期表的编排是按元素原子序数递增的顺序进行的,元素在周期表中的位置反映了元素的原子结构和元素的性质,我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。
(3)分界线附近的元素既有一定的金属性,又有一定的非金属性,这些元素可以制取半导体材料。
(4)钙与铝既不在同一周期也不在同一主族,可借助镁来比较,金属性:Ca>Mg>Al,故碱性:Ca(OH)2>Mg(OH)2>Al(OH)3。
(见学生用书P79)
元素的原子结构、元素在周期表中的位置和元素的主要性质三者之间的关系如图所示:
(1)原子结构元素在周期表中的位置
结构→位置
(2)原子结构元素的化学性质
最外层电子数越少,电子层数越多―→越易失电子,金属性越强;
最外层电子数越多,电子层数越少―→越易得电子,非金属性越强。
(3)位置原子结构和元素性质
如图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素。下列说法不正确的是( D )
A.原子半径:Y>X
B.最高价氧化物对应水化物的酸性:R>W
C.简单气态氢化物的稳定性:X>W
D.单质与水(或酸)反应的剧烈程度:Z>Y
【解析】由图可知,X的化合价为-2价,没有正化合价,故X为O元素;Y的化合价为+1价,没有负化合价,原子序数大于O元素,故Y为Na元素;Z的化合价为+3价,没有负化合价,原子序数大于Na元素,故Z为Al元素;W的化合价为+6价、-2价,故W为S元素;R的最高正价为+7价,应为Cl元素。Na的电子层比O多一个,故原子半径:Na>O,故A正确;S、Cl同周期,自左而右非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强,故B正确;O、S同主族,自上而下非金属性逐渐减弱,简单气态氢化物的稳定性逐渐减弱,故C正确;Na、Al同周期,自左而右金属性逐渐减弱,单质与水或酸反应的剧烈程度逐渐减弱,故D错误。
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是( C )
W |
|
|
|
X |
| Y | Z |
A.原子半径大小:X>Y>Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.氧化物对应水化物的酸性:Z>Y>W
D.Y能形成化合物H2Y、H2YO4
【解析】根据题意及元素在周期表中的位置,设W的最外层电子数为n,则n+n+n+2+n+3=21,得n=4,则W为C,X为Si,Y为S,Z为Cl, 同周期元素从左向右原子半径减小,则原子半径大小:X>Y>Z,故A正确;W、Y两种元素与氧元素分别形成化合物CO2、SO2,故B正确;非金属性越强,最高价氧化物对应水化物的酸性越强,故C错误;Y能形成化合物H2S、H2SO4,故D正确。
1.四种短周期元素在周期表中的位置如图所示,其中只有M为金属元素。下列说法不正确的是( D )
A.原子半径:Z<M
B.Z位于元素周期表中第二周期第ⅥA族
C.X的最简单气态氢化物的热稳定性比Z的弱
D.Y的最高价氧化物对应水化物的酸性比X的弱
【解析】根据元素在周期表中的位置可知,M为Al,X为Si,Y为N,Z为O。电子层数越多,原子半径越大,因此原子半径:Z<M,故A正确;O原子含有2个电子层,最外层含有6个电子,因此O位于元素周期表中第二周期第ⅥA族,故B正确;非金属性:O>Si,所以气态氢化物的稳定性:H2O>SiH4,故C正确;非金属性:N>Si,所以最高价氧化物对应水化物的酸性:HNO3>H2SiO3,故D错误。
2.已知Xn-、Yn+、Z三种单核粒子具有相同的核外电子层结构,下列分析中正确的是( B )
A.离子半径:Xn-<Yn+
B.Z一定是稀有气体元素的原子
C.原子序数:Z>Y>X
D.原子半径:Y<X
【解析】题给三种单核粒子电子层结构相同,Xn-、Yn+为离子,最外层电子达到稳定结构,Z为稀有气体元素。根据“阴上阳下”的规律可知Y在X的下一周期,故三种元素的相对位置如图:,则元素的原子序数大小关系为Y>Z>X,原子半径:Y>X,电子层结构相同的离子,原子序数越大,离子半径越小,则离子半径:Xn->Yn+。
3.部分短周期元素的性质或原子结构如表所示:
元素编号 | 元素性质或原子结构 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可用于测定文物年代,这种同位素的符号是__C__。
(2)元素Z与元素T相比,非金属性较强的是__Cl__(填元素符号),下列表述中能证明这一事实的是__b__(填字母)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(3)探寻物质性质的差异性是学习化学的重要方法之一,T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是__H2CO3__,理由是__H2CO3属于弱酸,其他都属于强酸__。
【解析】(1)由X的原子结构“最外层电子数是次外层电子数的2倍”,且其中一种同位素可用于测定文物年代推知X为碳元素,该同位素符号是C。(2)由T的M层上有6个电子可推知T为硫元素;Z属于短周期元素,其最高正价为+7价,则可推知Z为氯元素,它的非金属性比硫强,可以通过b来证实。(3)由题意知,Y为氮元素,T、X、Y、Z四种元素的最高价氧化物对应的水化物分别为H2SO4、H2CO3、HNO3和HClO4,H2CO3是弱酸,其他三种都是强酸,性质与其他三种明显不同。
1.原子结构决定元素的性质,下列说法中正确的是( B )
A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小
B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的是H2O
C.第二周期元素的最高化合价都等于其原子的最外层电子数
D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
【解析】Na+、Al3+的电子层结构相同,Al的核电荷数大,离子半径较小,Cl-的电子层数最多,离子半径最大,故离子半径:Cl->Na+>Al3+,A错误;第ⅥA族中O元素的非金属性最强,对应的氢化物最稳定,B正确;O元素没有最高化合价,F元素没有正价,C错误;元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,不是最高价氧化物对应的水化物,其酸性不一定符合此规律,如非金属性:Cl>S,次氯酸是弱酸,硫酸是强酸,D错误。
2.元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( B )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
【解析】第三周期的Al元素,既有金属性,又有非金属性,A错误;H+最外层无电子,Li+最外层有2个电子,因此并非所有的短周期元素原子形成离子后,最外层都达到8电子稳定结构,C错误;同主族元素的原子,最外层电子数相同,化学性质相似,但并不完全相同,D错误。
3.如图所示,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( D )
A.元素b位于第ⅥA族,有+6价、-2价两种常见化合价
B.五种元素中,元素e的性质最稳定
C.元素c和d的最高价氧化物对应水化物的酸性:c>d
D.元素c和e的气态氢化物的稳定性:c>e
【解析】图中各元素在元素周期表中的位置可知,a为稀有气体元素氦,是5种元素中最稳定的;b是氧元素,没有+6价;c的非金属性比d弱,因此c的最高价氧化物对应水化物的酸性比d的弱;c的非金属性比e强,因此c的气态氢化物的稳定性比e的强。
4.下列各组元素性质递变情况错误的是( C )
A.H、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
【解析】B、C、N、O、F是同周期元素的原子,从左到右,原子半径依次减小,C项错误。
5.铊是超导材料的组成元素之一,铊在元素周期表中位于第六周期,与铝是同主族元素,元素符号是Tl。以下对铊的单质及其化合物的性质推断中,不正确的是( C )
A.铊是易导电的银白色金属
B.铊能生成+3价的离子
C.Tl3+的氧化能力比Al3+强
D.氢氧化铊的碱性比氢氧化铝强
【解析】铝为银白色金属,Tl与Al同主族,则铊是易导电的银白色金属,故A正确;第ⅢA族元素的最高价为+3价,且为金属元素,则能生成+3价离子,故B正确;同主族元素从上到下金属性逐渐增强,金属性:Tl>Al,则Tl3+的氧化能力比Al3+弱,故C错误;同主族元素从上到下金属性增强,最高价氧化物对应的水化物的碱性逐渐增强,则Tl(OH)3的碱性比Al(OH)3强,故D正确。
6.比较硫、碳、硅的非金属性强弱。请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:H2SiO3难溶于水)。
实验试剂:浓盐酸、稀硫酸、饱和H2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液。
实验装置(如图所示):
(1)甲仪器中盛__稀硫酸__,乙仪器中盛__Na2CO3粉末__,丙仪器中盛__Na2SiO3溶液__。
(2)乙仪器中的现象是__产生大量气泡__。
(3)结论:酸性__H2SO4>H2CO3>H2SiO3__(用化学式和“>”表示)。
【解析】根据硫、碳、硅的气态氢化物的稳定性强弱或它们的最高价氧化物对应水化物的酸性强弱,比较这三种元素的非金属性强弱。结合题目中提供的试剂可知,应通过比较最高价氧化物对应水化物的酸性强弱验证三种元素的非金属性强弱。
高中人教版 (2019)第二节 元素周期律导学案: 这是一份高中人教版 (2019)第二节 元素周期律导学案,共12页。
高中人教版 (2019)第四章 物质结构 元素周期律第二节 元素周期律第2课时学案: 这是一份高中人教版 (2019)第四章 物质结构 元素周期律第二节 元素周期律第2课时学案,共9页。
高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律第二课时学案设计: 这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律第二课时学案设计,共8页。













