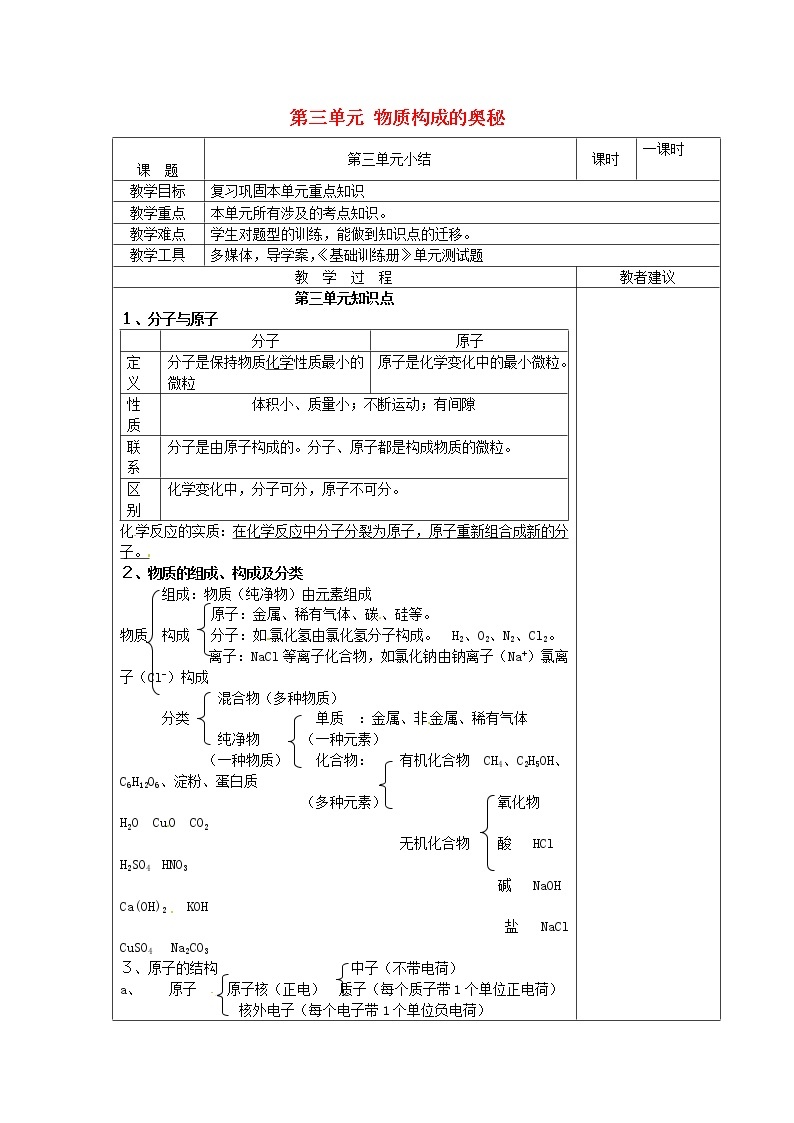
第三单元知识点 1、分子与原子 | 分子 | 原子 | 定义 | 分子是保持物质化学性质最小的微粒 | 原子是化学变化中的最小微粒。 | 性质 | 体积小、质量小;不断运动;有间隙 | 联系 | 分子是由原子构成的。分子、原子都是构成物质的微粒。 | 区别 | 化学变化中,分子可分,原子不可分。 |
化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。 2、物质的组成、构成及分类 组成:物质(纯净物)由元素组成 原子:金属、稀有气体、碳、硅等。 物质 构成 分子:如氯化氢由氯化氢分子构成。 H2、O2、N2、Cl2。 离子:NaCl等离子化合物,如氯化钠由钠离子(Na+)氯离子(Cl-)构成 混合物(多种物质) 分类 单质 :金属、非金属、稀有气体 纯净物 (一种元素) (一种物质) 化合物: 有机化合物 CH4、C2H5OH、C6H12O6、淀粉、蛋白质 (多种元素) 氧化物 H2O CuO CO2 无机化合物 酸 HCl H2SO4 HNO3 碱 NaOH Ca(OH)2 KOH 盐 NaCl CuSO4 Na2CO3 3、原子的结构 中子(不带电荷) a、 原子 原子核(正电) 质子(每个质子带1个单位正电荷) 核外电子(每个电子带1个单位负电荷)
b、原子核内质子数 = 核电荷数 = 核外电子数
c、不是所有的原子中都有中子(氢原子中没有中子) ; d.质子数不一定等于中子数。 e、不同的原子质子数不同。
f、原子的质量主要集中在原子核上。
4、相对原子质量
a、定义式: x原子的相对原子质量=
b、相对原子质量≈ 质子数 +中子数
5、元素:元素就是具有相同核电荷数(即核内质子数)的一类原子的总称
A、不同种元素质子数(核电荷数)不同。【决定元素种类的是:质子数】
B、元素之最:地壳:O、Si、Al、Fe 细胞:O、C、H、N
C、元素与原子的关系:
(1).概念 :元素是具有相同核电荷数的同一类原子的总称。 原子是化学变化中的最小微粒。
(2).区别:元素着眼于种类不表示个数,没有数量多少的含义; 原子既表示种类又讲个数,有数量的含义。
(3).使用领域: 元素是用来描述物质的宏观组成(习惯上说组成),如:水里含有氢元素和氧元素,水是由氢元素和氧元素组成的。但不能说“水是由二个氢元素和一个氧元素所组成的”。
原子是用来描述物质的微观构成(习惯上说构成),如:一个水分子是由两个氢原子和一个氧原子构成的。但不能说“一个水分子是由氢元素和氧元素所组成。”
(4)、联系:元素是同一类原子的总称;原子是构成元素的基本单元。
E、元素的分类:
元素分为:金属元素、 非金属元素、 稀有气体元素; 非金属具体又可分为:固态非金属、气态非金属和液态非金属
6、元素符号:
a、表示:采用拉丁文名称的第一个大写字母表示,若第一个字母相同,第二个字母小写
b、意义:①表示一种元素;②表示该元素的一个原子
如:H:①氢元素;②表示一个氢原子
【注】:1、在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O:只表示3个氧原子
c、金属元素、稀有气体元素、非金属固态金属元素(除碘)的元素符号除了有以上含义外,还能表示该物质。如:Fe:(1)铁元素(2)一个铁原子(3)铁这种物质。
7、元素周期表 a.发现:门捷列夫
b.周期:每个横行称为一个周期(7个横行);族:每一个纵行称为一个族 c.原子序数=核电荷数=质子数=核外电子数
d.每一族的元素的化学性质相似
8、核外电子的排布
A、排布特点:(1)电子运动没有固定的轨道,但却有经常出现的区域;(2)电子在原子核外是分层排布的;
(3)电子排布时依据电子层能量的高低,由里向外能量由低到高排布 ;(4)最外层电子数最多不超过8个(只有1层的不超过2个)
B、原子结构示意图
(1)含义: ①圆圈表示原子核 ②圆圈内数字表示核内质子数 ③弧线表示电子层 ④弧线上的数字表示该电子层上排布的电子数
(2)1~18号元素原子核外电子排布规律 (3)原子结构与元素性质的关系 元素分类 | 最外层电子数 | 结构的稳定性 | 化学性质 | 金属元素 | 一般<4 | 不稳定 | 易失最外层电子,达到稳定结构 | 非金属元素 | 一般>4 | 不稳定 | 易得电子,达到稳定结构 | 稀有气体元素 | 8(He为2) | 稳定 | 一般不参加化学反应 |
9、离子的形成
a、离子:带电荷的原子和原子团叫离子 ;
b、离子的分类 a.阳离子:带正电荷的原子;b.阴离子:带负电荷的原子
c、离子符号的表示:An+或An- (n=1时省略不写)
d、离子符号的含义(以Mg2+为例):Mg2+表示镁离子或表示1个镁离子。
注意:离子符号前面的数值表示离子的个数。如:2 Mg2+表示2个镁离子。
e、原子形成离子之后:一定变:电子数 一定不变:质子数 可能变: 电子层数
f、离子与原子的比较 区别 粒子种类 | 粒子结构 | 粒子电性 | 符号表示 | 原 子 | 核内质子数=核外电子数 | 中性 | 如Na、S | 离 子 | 核内质子数≠核外电子数 | | | 阳离子 | 核内质子数>核外电子数 | 正电性 | 如Na+、Mg2+ | 阴离子 | 核内质子数<核外电子数 | 负电性 | 如Cl- |
联系 失电子 得电子 阳离子←------ 原子------→阴离子
10、物质的构成
(1)由原子构成的物质:金属、稀有气体、金刚石、石墨、硅
(2)大部分物质由分子构成:如HCl、CO2、H2O、 H2、O2、N2、Cl2等。
(3)离子化合物由有离子构成。NaCl等离子化合物
11、三决定:a.最外层电子数决定元素化学性质; b.原子核(质子数、中子数)决定原子的质量; c. 质子数(核电荷数)决定元素种类; d. 最外层电子数一定程度上决定元素化学性质。但是注意:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2);最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构) |