初中化学人教版九年级下册第十单元 酸和碱综合与测试导学案及答案
展开【学习目标】
1.掌握常见酸和碱的性质及用途,理解酸和碱各有其相似性质的原因。
2.认识酸碱之间的中和反应及中和反应在实际中的应用。
3.会用酸碱指示剂和pH试纸检验溶液的酸碱性。
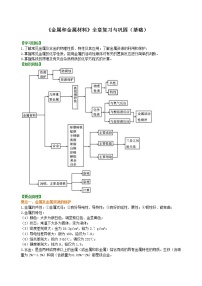
【知识网络】
【要点梳理】
要点一、酸碱指示剂和溶液酸碱度的表示方法—pH
1.常用的酸碱指示剂有紫色石蕊试液和无色酚酞试液,它们与酸、碱溶液作用时显示的颜色如下表:
2.pH的取值范围:0~14。
(1)pH<7时,溶液显酸性,pH越小,酸性越强。
(2)pH>7时,溶液显碱性,pH越大,碱性越强。
(3)pH=7时,溶液显中性。
【要点诠释】
1.测定溶液pH的方法:用玻璃棒蘸取待测溶液滴在pH试纸上,将试纸显示的颜色与标准比色卡对照便可知道待测溶液的pH值。
2.溶液的稀释与溶液pH的关系:
(1)酸性溶液pH小于7。向溶液中加入水,溶液的溶质质量分数减小,酸性减弱,溶液的pH增大,但不会增大到7(酸性溶液加水还是酸,不会变成中性,所以pH不会增大到7)。
(2)碱性溶液pH大于7。向溶液中加入水,溶液的溶质质量分数减小,碱性减弱,溶液的pH减小,但不会减小到7(碱性溶液加水还是碱,不会变成中性,所以pH不会减小到7)。
要点二、几种常见的酸和碱
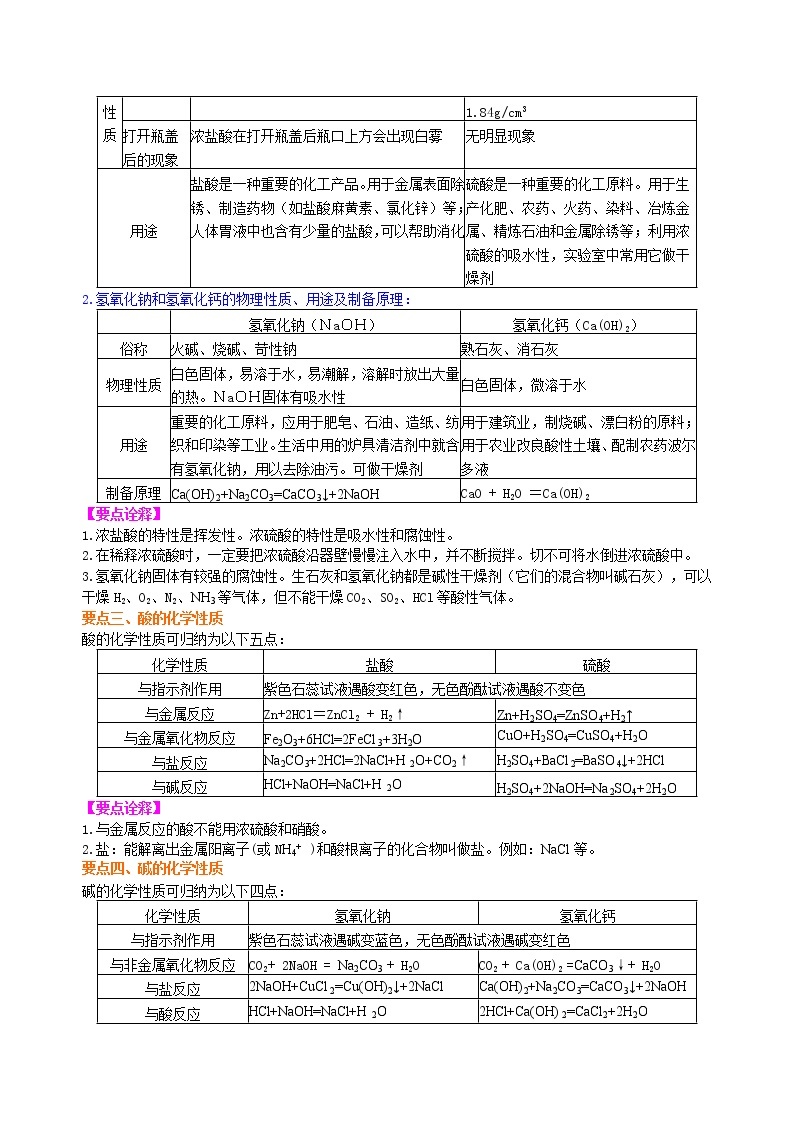
1.盐酸、硫酸的物理性质及用途:
2.氢氧化钠和氢氧化钙的物理性质、用途及制备原理:
【要点诠释】
1.浓盐酸的特性是挥发性。浓硫酸的特性是吸水性和腐蚀性。
2.在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中,并不断搅拌。切不可将水倒进浓硫酸中。
3.氢氧化钠固体有较强的腐蚀性。生石灰和氢氧化钠都是碱性干燥剂(它们的混合物叫碱石灰),可以干燥H2、O2、N2、NH3等气体,但不能干燥CO2、SO2、HCl等酸性气体。
要点三、酸的化学性质
酸的化学性质可归纳为以下五点:
【要点诠释】
1.与金属反应的酸不能用浓硫酸和硝酸。
2.盐:能解离出金属阳离子(或NH4+ )和酸根离子的化合物叫做盐。例如:NaCl等。
要点四、碱的化学性质
碱的化学性质可归纳为以下四点:
【要点诠释】
1.酸、碱溶于水形成溶液过程中会解离出自由移动的离子。酸具有相似的化学性质是因为酸溶液中都存在相同的氢离子;碱具有相似的化学性质是因为碱溶液中都存在相同的氢氧根离子。
2.因为在可溶性的酸、碱、盐的水溶液中存在自由移动的阴、阳离子,所以它们的水溶液均能导电。
要点五、中和反应及其应用
1.概念:酸与碱作用生成盐和水的反应,叫做中和反应。
2.实质:酸溶液中的H+和碱溶液中的OH-结合生成了中性的水。表达式为:H+ + OH-=H2O。
3.现象:有些中和反应进行时有明显的现象,生成的盐以沉淀的形式析出;有些中和反应没有明显的实验现象,所以要判断中和反应是否发生或是否恰好完全反应需要借助酸碱指示剂。
4.应用:中和反应原理常用于医药、改变土壤的酸碱性、处理工厂的废水等。
【要点诠释】
1.向滴有酚酞试液的氢氧化钠溶液中滴加稀盐酸时,一定要用滴管慢慢滴入稀盐酸,并不断搅拌溶液,直到溶液颜色恰好变成无色为止,否则容易使稀盐酸过量。从指示剂的变色情况分析,当红色恰好变为无色时,溶液由碱性变为中性,因此,可以利用中和反应改变溶液的酸碱性。
2.硫酸厂排放的污水中含有硫酸等杂质,可以用熟石灰进行中和处理。
3.服用某些碱性药物,可中和过多的胃酸,涂抹一些含碱性的物质(如氨水)的药水,可减轻蚊虫叮咬后所产生的痛痒感,但注意选择碱性物质时要选择弱碱,以防碱性物质腐蚀皮肤。
【典型例题】
类型一、考查酸、碱的性质及溶液的酸碱性
1.(2016•宁夏中考)浓硫酸和浓盐酸敞口放置在空气中一段时间后,溶液中( )
A.溶质的质量分数都变小
B.溶液的质量都增大
C.溶质的质量分数都变大
D.溶质的质量分数前者变大,后者变小
【思路点拨】浓盐酸具有挥发性,易挥发出溶质氯化氢而导致溶液变稀,浓硫酸具有吸水性,易吸收空气中的水分而使溶液变稀。
【答案】A
【解析】浓盐酸具有挥发性,易挥发出溶质氯化氢而导致溶液变稀,浓硫酸具有吸水性,易吸收空气中的水分而使溶液变稀;浓盐酸挥发出溶质而导致溶液质量减小,浓硫酸易吸水而使溶液质量增加。
【总结升华】解答此题时,可以依据已有的知识结合溶液的组成进行。
2.(2015•湖南中考)下列有关说法中不正确的是( )
A、酸溶液中都含有H+,所以有相似的化学性质
B、酸、碱在水溶液中都可解离出带电的粒子
C、在实验室,常用浓硫酸来干燥某些气体
D、医疗上的生理盐水是0.9%的纯碱溶液
【思路点拨】根据酸的化学性质、浓硫酸的性质及浓硫酸的稀释等知识分析解答。
【答案】D
【解析】在水溶液中电离出的阳离子全部是氢离子的化合物是酸,故A正确;在水溶液中电离出的阳离子全部是氢离子的化合物是酸,电离出的阴离子全部是氢氧根离子的混合物是碱,故B正确;浓硫酸具有吸水性,在实验室,常用来干燥某些气体,故C正确;医疗上的生理盐水是0.9%的氯化钠溶液,故D错误。
【总结升华】酸、碱溶于水形成溶液过程中会解离出自由移动的离子。酸具有相似的化学性质是因为酸溶液中都存在相同的氢离子;碱具有相似的化学性质是因为碱溶液中都存在相同的氢氧根离子。
3.今有①肥皂水 ②食盐水 ③杨梅汁 ④白糖水 ⑤蒸馏水五种液体,根据你的生活经验判断,其中pH<7的是 ,pH>7的是 (填序号)。①
③
【答案】③ ①
【解析】①肥皂水显碱性,pH>7;②食盐水、④白糖水、⑤蒸馏水均显中性,pH均等于7;③杨梅汁显酸性,pH<7。
【总结升华】掌握常见溶液的酸碱性和溶液pH大小之间的关系是顺利解题的关键。
4.过氧化钠(Na2O2)是一种淡黄色的粉末,遇水会发生如下反应:2Na2O2+2H2O=4NaOH+O2↑,该反应生成的碱可用 检验。
【答案】酚酞试液或紫色石蕊试液
【解析】碱能使无色酚酞试液变红,使紫色石蕊试液变蓝。
【总结升华】溶液酸碱性的测定方法有多种,最简单的是用酸碱指示剂来进行检验。要想解答好这类题目,首先要理解和熟记溶液酸碱性的测定方法等相关知识。
举一反三:
【变式1】(2014•广东中考)下列溶液曝露在空气中,可以使溶液质量增大的是( )
A.蔗糖溶液 B.浓盐酸 C.浓硫酸 D.饱和食盐水
【答案】C
【变式2】向一无色溶液中滴入无色酚酞试液,溶液变成红色。则该无色溶液是( )
A. 酸性溶液 B. 酸的水溶液 C. 碱性溶液 D. 碱的水溶液
【答案】C
【解析】碱的水溶液显碱性,部分盐溶液也显碱性,所以一定要记清能使无色酚酞试液变红的溶液显碱性,但不一定是碱的溶液。
【变式3】实验测得人体内一些液体的近似pH如下,其中酸性最强的是( )
A. 血浆: 7.35~7.45 B. 唾液: 6.6~7.1
C. 胃液: 0.9~1.5 D. 胆汁: 7.1~7.2
【答案】C
【解析】溶液pH小于7时,溶液显酸性;pH越小,酸性越强。
类型二、考查中和反应及其应用
5.正常人的胃液中含有约0.5%的盐酸。胃药“三九胃泰”中含有Al(OH)3,它能治疗胃酸过多的疾病,病人服用后发生反应的化学方程式是 。
【思路点拨】酸和碱反应生成盐和水的反应,叫做中和反应。
A1(OH)3+3HCl═A1Cl3 +3H2O
【答案】3HCl+Al(OH)3=AlCl3+3H2O
【解析】盐酸可以和氢氧化铝发生中和反应,反应后生成了氯化铝和水,从而可以治疗胃酸过多症。
【总结升华】本题考查中和反应的应用及化学方程式的书写。书写化学方程式时,必须依据客观事实、遵守质量守恒定律这两个原则。
6.家用铝壶使用长时间后会在铝壶内壁产生水垢,已知水垢的主要成分是CaCO3和Mg(OH)2,可以用盐酸除去。但如果盐酸使用过量则会损坏铝壶,请写出有关化学方程式 、
、 。
【思路点拨】酸可以和碱、盐、金属等发生反应。
【答案】 CaCO3+2HCl=CaCl2+H2O+CO2↑
Mg(OH)2+2HCl=MgCl2+2H2O
2Al+6HCl=2AlCl3+3H2↑
【解析】盐酸除了可以和水垢中的CaCO3和Mg(OH)2反应,还可以和铝反应。
【总结升华】要掌握酸碱的性质及有关化学方程式的书写方法。
举一反三:
【变式】下列物质的用途,是利用其物理性质的是( )
A.干冰用于人工降雨 B.盐酸用于除铁锈
C.氧气用于医疗急救 D.熟石灰用于改良土壤酸性
【答案】A
溶液
指示剂
酸性溶液(例:盐酸)
中性溶液(例:食盐水)
碱性溶液(例:氢氧化钠溶液)
紫色石蕊试液
变红色
不变色
变蓝色
无色酚酞试液
不变色
不变色
变红色
盐酸(HCl)
硫酸(H2SO4)
物
理
性
质
颜色、状态、气味、密度
无色液体,有刺激性气味。常用浓盐酸中HCl的质量分数为36%~37%,密度为1.19g/cm3
无色粘稠的油状液体。实验室常用浓硫酸的溶质质量分数为98%,密度为1.84g/cm3
打开瓶盖后的现象
浓盐酸在打开瓶盖后瓶口上方会出现白雾
无明显现象
用途
盐酸是一种重要的化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中也含有少量的盐酸,可以帮助消化
硫酸是一种重要的化工原料。用于生产化肥、农药、火药、染料、冶炼金属、精炼石油和金属除锈等;利用浓硫酸的吸水性,实验室中常用它做干燥剂
氢氧化钠(NaOH)
氢氧化钙(Ca(OH)2)
俗称
火碱、烧碱、苛性钠
熟石灰、消石灰
物理性质
白色固体,易溶于水,易潮解,溶解时放出大量的热。NaOH固体有吸水性
白色固体,微溶于水
用途
重要的化工原料,应用于肥皂、石油、造纸、纺织和印染等工业。生活中用的炉具清洁剂中就含有氢氧化钠,用以去除油污。可做干燥剂
用于建筑业,制烧碱、漂白粉的原料;用于农业改良酸性土壤、配制农药波尔多液
制备原理
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
CaO + H2O =Ca(OH)2
化学性质
盐酸
硫酸
与指示剂作用
紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色
与金属反应
Zn+2HCl=ZnCl2 + H2↑
Zn+H2SO4=ZnSO4+H2↑
与金属氧化物反应
Fe2O3+6HCl=2FeCl3+3H2O
CuO+H2SO4=CuSO4+H2O
与盐反应
Na2CO3+2HCl=2NaCl+H2O+CO2↑
H2SO4+BaCl2=BaSO4↓+2HCl
与碱反应
HCl+NaOH=NaCl+H2O
H2SO4+2NaOH=Na2SO4+2H2O
化学性质
氢氧化钠
氢氧化钙
与指示剂作用
紫色石蕊试液遇碱变蓝色,无色酚酞试液遇碱变红色
与非金属氧化物反应
CO2+ 2NaOH = Na2CO3 + H2O
CO2 + Ca(OH)2 =CaCO3↓+ H2O
与盐反应
2NaOH+CuCl2=Cu(OH)2↓+2NaCl
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
与酸反应
HCl+NaOH=NaCl+H2O
2HCl+Ca(OH)2=CaCl2+2H2O
初中第三单元 物质构成的奥秘综合与测试导学案及答案: 这是一份初中第三单元 物质构成的奥秘综合与测试导学案及答案,共5页。学案主要包含了学习目标,知识网络,要点梳理,要点诠释,典型例题,思路点拨,总结升华等内容,欢迎下载使用。
人教版九年级上册本单元综合和测试导学案: 这是一份人教版九年级上册本单元综合和测试导学案,共7页。学案主要包含了学习目标,知识网络,要点梳理,要点诠释,典型例题,思路点拨,总结升华,答案与解析等内容,欢迎下载使用。
初中化学人教版九年级下册课题2 化学元素与人体健康导学案: 这是一份初中化学人教版九年级下册课题2 化学元素与人体健康导学案,共7页。学案主要包含了学习目标,知识网络,要点梳理,要点诠释,典型例题,思路点拨,总结升华,提出问题等内容,欢迎下载使用。