


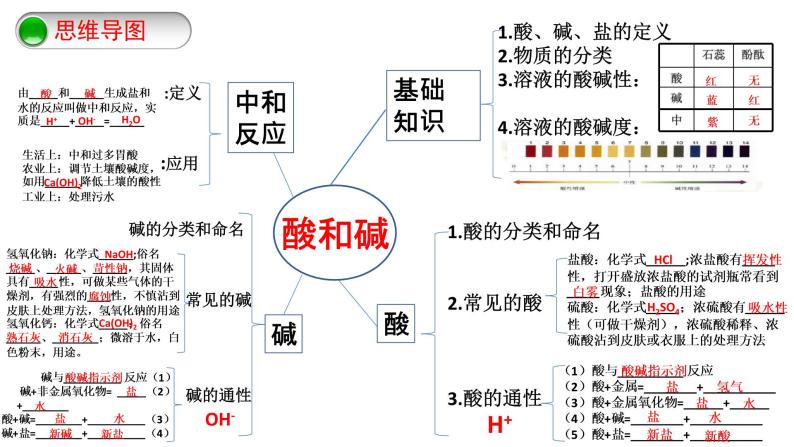




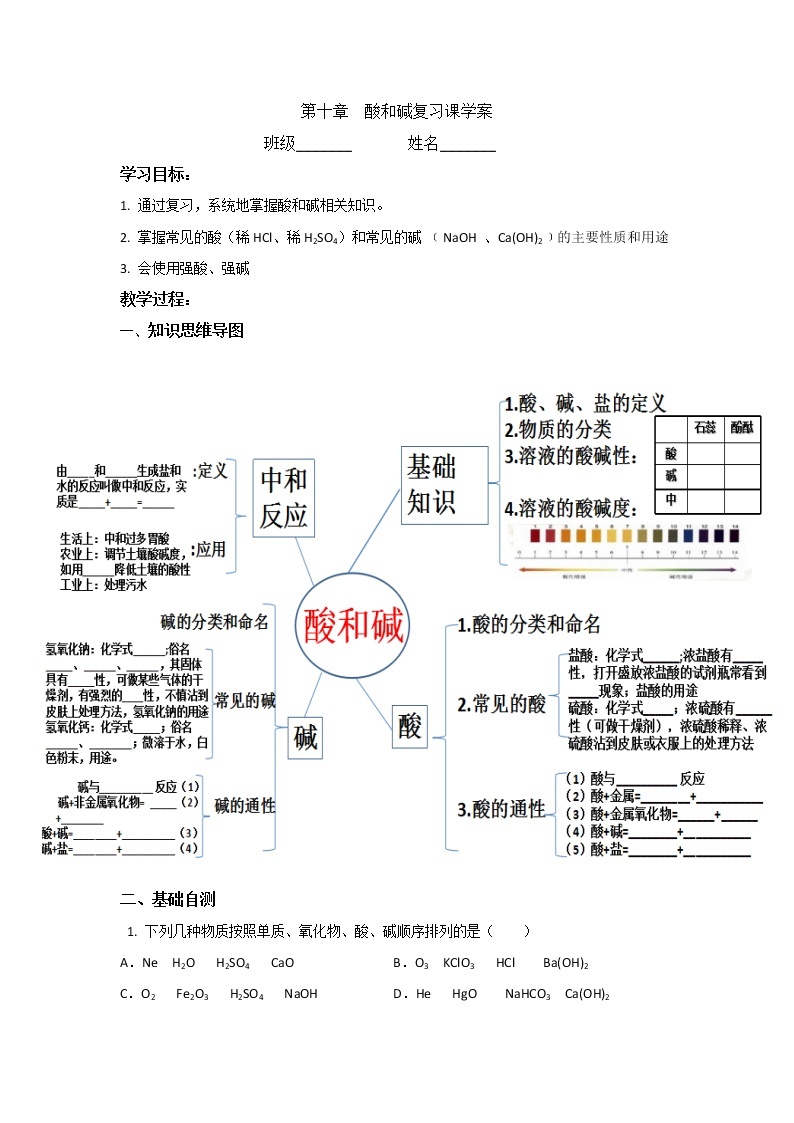
第十单元 酸和碱-复习课(课件+学案+练习)
展开第十单元 《酸和碱》复习题
参考答案与试题解析
一、选择题
1.(2分)推理是化学学习中常用的思维方法。下列推理正确的是( )
A.中和反应有盐和水生成,则生成盐和水的反应一定是中和反应
B.氢氧化铝可以治疗胃酸过多,因此氢氧化钠也可以治疗胃酸过多
C.单质是由同种元素组成的纯净物,则由同种元素组成的纯净物一定是单质
D.饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质
【考点】7I:饱和溶液和不饱和溶液;97:中和反应及其应用;A6:单质和化合物的概念.菁优网版权所有
【分析】A、根据中和反应定义分析;
B、根据氢氧化钠是强碱分析;
C、根据单质定义分析;
D、根据饱和溶液定义分析;
【解答】解:A、生成盐和水的反应不一定是中和反应,如金属氧化物与酸反应,A错误;
B、氢氧化钠是强碱,具有强腐蚀性,不能治疗胃酸过多,B错误;
C、单质是由同种元素组成的纯净物,则由同种元素组成的纯净物一定是单质,C正确;
D、饱和溶液不能溶解该溶液中的溶质,能继续溶解其他溶质,D错误;
故选:C。
【点评】本题难度不大,解答此类题时要根据不同知识的特点类推,不能盲目类推,并要注意知识点与方法的有机结合,做到具体问题能具体分析。
2.(2分)实验室里固体氢氧化钠必须密封保存,主要原因是( )
①有腐蚀性
②有吸水性,易潮解
③有挥发性
④能与空气中的CO2反应
A.①② B.①③ C.②④ D.③④
【考点】94:常见碱的特性和用途;95:碱的化学性质.菁优网版权所有
【分析】固体氢氧化钠在空气中易吸收水蒸气而潮解,且能与空气中的二氧化碳反应生成碳酸钠,利用这些知识对相关性质进行分析可解决此题。
【解答】解:由于固体氢氧化钠在空气中易吸收水蒸气而潮解,且能与空气中的二氧化碳反应生成碳酸钠,所以固体氢氧化钠必须密封保存,以防止其变质,因此相关的性质主要是潮解及能与二氧化碳反应。
故选:C。
【点评】此题是对固体烧碱的考查,解决的重点是能够对烧碱的变质特性有所了解,能知道其变化的实质,属常规性基础知识考查的题目。
3.(2分)下列食物的pH如下:
食物 | 苹果汁 | 葡萄汁 | 牛奶 | 鸡蛋清 |
pH | 2.9~3.3 | 3.5~4.5 | 6.3~6.6 | 7.6~8.0 |
其中胃酸过多的人最适合吃( )
A.牛奶 B.鸡蛋清 C.葡萄汁 D.苹果汁
【考点】99:溶液的酸碱性与pH值的关系.菁优网版权所有
【分析】当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;据此进行分析判断即可。
【解答】解:胃酸过多的人最适合吃显弱碱性的食物。
A、牛奶的pH为6.3~6.6,小于7,显酸性,故错误。
B、鸡蛋清的pH为7.6~8.0,大于7,显碱性,故正确。
C、葡萄汁的pH为3.5~4.5,小于7,显酸性,错误。
D、果汁的pH为2.9~3.3,小于7,显酸性,故错误。
故选:B。
【点评】本题难度不大,掌握溶液的酸碱性和溶液pH大小之间的关系是正确解题的关键。
4.(2分)下列应用与中和反应原理无关的是( )
A.洗洁精去除油污
B.用熟石灰改良酸性土壤
C.服用含氢氧化铝的药物治疗胃酸过多
D.用氢氧化钠溶液洗涤石油产品中的残留硫酸
【考点】97:中和反应及其应用.菁优网版权所有
【分析】根据中和反应的定义分析,中和反应是酸与碱作用生成盐和水的反应;
【解答】解:A、洗洁精去除油污是利用洗洁精的乳化功能,A符合题意;
B、熟石灰改良酸性土壤利用酸碱中和反应原理,B不符合题意;
C、氢氧化铝与胃酸(盐酸)发生中和反应,故可治疗胃酸过多,C不符合题意;
D、氢氧化钠能与硫酸发生中和反应,故用氢氧化钠溶液可洗涤石油产品中的残留硫酸,D不符合题意;
故选:A。
【点评】明确中和反应的定义是解答本题关键。
5.(2分)如图中两圆相交部分表示相部两种物质反应的现象。下列描述错误的是( )
A.a处无明显现象 B.b处形成浅绿色溶液
C.c处有红色物质析出 D.d处有气泡产生
【考点】85:金属的化学性质;93:酸的化学性质.菁优网版权所有
【分析】A、a处是铁在空气中锈蚀,进行分析判断。
B、b处铁与稀盐酸反应生成氯化亚铁溶液和氢气,进行分析判断。
C、c处是铁与硫酸铜溶液反应,进行分析判断。
D、根据d处是稀盐酸与碳酸钙反应,进行分析判断。
【解答】解:A、a处是铁在空气中锈蚀,会观察到铁逐渐变为红棕色,故选项说法错误。
B、铁与稀盐酸反应生成氯化亚铁溶液和氢气,b处形成浅绿色溶液,故选项说法正确。
C、c处是铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,c处有红色物质析出,故选项说法正确。
D、d处是稀盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,d处有气泡产生,故选项说法正确。
故选:A。
【点评】本题难度不大,熟练掌握酸和金属的化学性质、反应的现象是正确解答本题的关键。
6.(2分)构建知识网络是一种重要的学习方法。如图是关于盐酸化学性质的知识网络图:“﹣”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质。若A、B、C分别属于不同类别的化合物,则A、B、C可能是( )
A.CuO、Ba(OH)2、CuSO4 B.NaOH、HNO3、K2CO3
C.KOH、FeCl3、Na2CO3 D.NaOH、Ba(NO3)2、H2SO4
【考点】93:酸的化学性质.菁优网版权所有
【分析】盐酸和氧化铜反应生成氯化铜和水;
盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钾反应生成氯化钾、水和二氧化碳,和硝酸银反应生成氯化银沉淀和硝酸,硝酸和氢氧化钠反应生成硝酸钠和水,和碳酸钾反应生成硝酸钾、水和二氧化碳;
氯化铁和碳酸钠都属于盐;
硝酸钡和硫酸反应生成硫酸钡沉淀和硝酸。
【解答】解:A、盐酸不与硫酸铜反应,盐酸不能转化为氢氧化钡,氢氧化钡不与氧化铜反应;
B、盐酸和氢氧化钠、碳酸钾反应,和硝酸银反应生成硝酸,硝酸和氢氧化钠、碳酸钾反应;
C、氯化铁和碳酸钠均为盐,属于相同类别的化合物;
D、盐酸不能转化为硝酸钡,盐酸不与硫酸反应。
故选:B。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
7.(2分)向某盐酸和氯化铁的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法中正确的是( )
A.a点溶液中含有两种溶质
B.bc段发生反应的类型为置换反应
C.d点溶液中主要存在的离子为Na+、Cl﹣
D.据图可计算出混合溶液中FeC13的质量分数
【考点】95:碱的化学性质.菁优网版权所有
【分析】氢氧化钠和盐酸反应生成氯化钠和水,和氯化铁反应生成氢氧化铁沉淀和氯化钠
【解答】解:A、a点表示盐酸和氢氧化钠反应生成氯化钠和水,溶液中含有氯化钠、盐酸和氯化铁三种溶质,A说法不正确;
B、bc段中,氢氧化钠和氯化铁反应生成氢氧化铁和氯化钠,是复分解反应,B说法不正确;
C、d点时,氢氧化钠和稀盐酸、氯化铁恰好完全反应,因此溶液中存在的离子为Na+、Cl﹣,C说法正确;
D、由图中数据可知,沉淀质量是24.5g,根据氢氧化钠和氯化铁反应的化学方程式可以计算出氯化铁的质量,但混合溶液的总质量不知,无法计算混合溶液中FeC13的质量分数,D说法不正确。
故选:C。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
8.(2分)类推的思维方法在化学学习中应用广泛,下列类推正确的是( )
A.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
B.碱性溶液一定能使酚酞变红,能使酚酞变红的溶液一定是碱性溶液
C.中和反应一定有盐和水生成,生成盐和水的反应一定是中和反应
D.碳酸盐与酸反应放出气体,能与酸反应放出气体的物质一定是碳酸盐
【考点】7C:溶液的概念、组成及其特点;91:酸碱指示剂及其性质;93:酸的化学性质;97:中和反应及其应用.菁优网版权所有
【分析】A、根据溶液特征:均一、稳定、混合物分析;
B、根据酚酞变色情况分析;
C、根据中和反应定义分析;中和反应是指酸与碱作用生成盐和水的反应;
D、根据酸的化学性质分析;
【解答】解:A、具有均一性和稳定性的液体不一定是溶液,如水具有均一性、稳定性,但不是溶液,A错误;
B、碱性溶液一定能使酚酞变红,能使酚酞变红的溶液一定是碱性溶液,B正确;
C、生成盐和水的反应不一定是中和反应,如酸与金属氧化物反应生成盐和水,但不是中和反应,C错误;
D、能与酸反应放出气体的物质不一定是碳酸盐,如活泼金属与酸反应产生氢气,D错误;
故选:B。
【点评】该类型的题目只需举出反例论证即可。
9.(2分)室温时,向盛有稀H2SO4的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化)。下列分析错误的是( )
A.a点溶液中有一种溶质
B.d点溶液中溶质是Ba(OH)2和H2SO4
C.c点烧杯内液体的pH=7
D.b点溶液中滴加紫色石蕊溶液,溶液变红
【考点】97:中和反应及其应用;99:溶液的酸碱性与pH值的关系.菁优网版权所有
【分析】A、根据a点溶液是稀硫酸,进行分析判断。
B、根据d点溶液是硫酸与氢氧化钡溶液恰好完全反应后继续滴加氢氧化钡溶液,进行分析判断。
C、根据c点烧杯内液体溶质的质量为0,进行分析判断。
D、根据b点溶液中稀硫酸还没有完全反应,进行分析判断。
【解答】解:A、a点溶液是稀硫酸,a点溶液中有硫酸一种溶质,故选项说法正确。
B、硫酸与氢氧化钡溶液恰好完全反应反应生成硫酸钡沉淀和水,d点溶液是硫酸与氢氧化钡溶液恰好完全反应后继续滴加氢氧化钡溶液,d点溶液中溶质是Ba(OH)2,故选项说法错误。
C、c点烧杯内液体溶质的质量为0,是硫酸与氢氧化钡溶液恰好完全反应反应生成硫酸钡沉淀和水,c点烧杯内液体的pH=7,故选项说法正确。
D、b点溶液中稀硫酸还没有完全反应,溶液显酸性,b点溶液中滴加紫色石蕊溶液,溶液变红,故选项说法正确。
故选:B。
【点评】本题难度不是很大,主要考查了中和反应及其应用,从数形结合的角度理解中和反应是正确解答本题的关键。
10.图为A~G(初中常见物质)的转化关系,其中A是天然气的主要成分。
根据以上信息回答下列问题:
(1)写出A 的化学式: CH4 ,其常见用途为 作燃料 (任写一条)。
(2)反应①的现象为 固体溶解,溶液变蓝 。
(3)写出反应②的化学方程式 H2O+Na2O=2NaOH ,该反应属于 化合 反应(填基本反应类型)。
(4)写出反应③的化学方程式 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4 。
(5)Na2O与CaO的化学性质相似,下列物质中 c (填标号)能与Na2O发生化学反应。
a.Mg b.N2 c.稀盐酸 d.NaCl固体
声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布
日期:2020/3/10 22:26:41;用户:DN_ZS_NEW_2328313;邮箱:DN_ZS_NEW_2328313.20689995;学号:28003771









