





高中化学人教版 (2019)必修 第一册第三节 氧化还原反应多媒体教学ppt课件
展开【复习1】 在反应 MnO2 + 4HCl = MnCl2 + 2H2O + Cl2↑中, 元素化合价升高,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应; 元素化合价降低,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应。
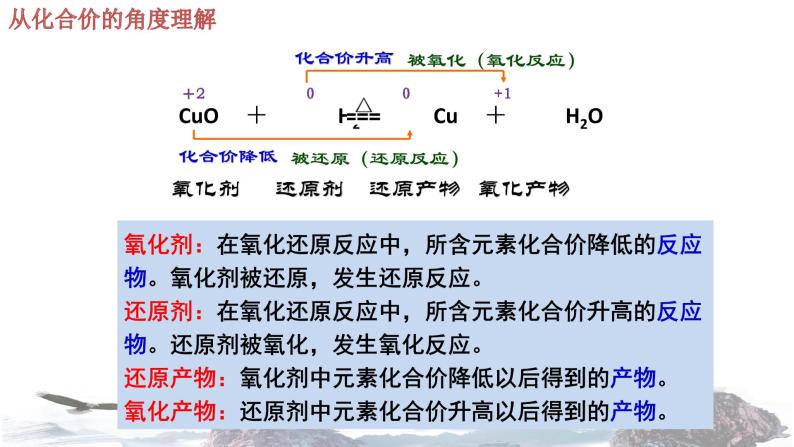
+4 -1 +2 0
[复习2] 下列叙述正确的是( )A、在氧化还原反应中,失去电子的物质,所含元素化合价降低B、凡有元素化合价升降的化学反应都是氧化还原反应C、在氧化还原反应中一定所有的元素化合价都发生变化D、氧化还原反应的本质是电子的得失或偏移
氧化剂:在氧化还原反应中,所含元素化合价降低的反应物。氧化剂被还原,发生还原反应。还原剂:在氧化还原反应中,所含元素化合价升高的反应物。还原剂被氧化,发生氧化反应。还原产物:氧化剂中元素化合价降低以后得到的产物。氧化产物:还原剂中元素化合价升高以后得到的产物。
氧化剂 还原剂 还原产物 氧化产物
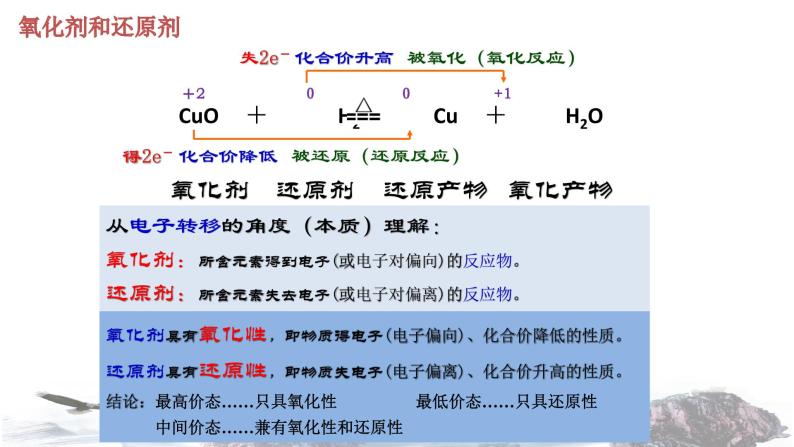
从电子转移的角度(本质)理解:氧化剂:所含元素得到电子(或电子对偏向)的反应物。还原剂:所含元素失去电子(或电子对偏离)的反应物。
氧化剂 还原剂 还原产物 氧化产物
氧化剂具有氧化性,即物质得电子(电子偏向)、化合价降低的性质。还原剂具有还原性,即物质失电子(电子偏离)、化合价升高的性质。结论:最高价态……只具氧化性 最低价态……只具还原性 中间价态……兼有氧化性和还原性
练习:从化合价角度分析下列微粒的性质 在Fe3+、Fe2+、Al3+、H+、S、Zn、Cl-等粒子中只有氧化性的是 ,只有还原性的是 ,兼有氧化性和还原性的是 。
Fe3+、Al3+、H+
高价氧化低价还,中间价态两性全。
元素常见化合价:Fe:0, +2, +3 S:-2, 0 ,+4, +6 H:0 ,+1Al:0 ,+3 Cl:-1 ,0, +1, +5, +7
还原剂 氧化剂 氧化产物 还原产物
氧化剂 还原剂 还原产物 氧化产物
氧化剂 还原剂 还原产物与氧化产物
还原剂与氧化剂 还原产物 氧化产物
练习: 指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物。
总结:四组概念,一个守恒
氧化剂 + 还原剂 → 还原产物 + 氧化产物
(氧化性) 氧化剂 还原剂(还原性)
化价升降须相等,电子转移要守恒。
氧化剂具有氧化性,即物质得电子(电子偏向)的性质。还原剂具有还原性,即物质失电子(电子偏离)的性质。
常见氧化剂:O2、Cl2;HNO3、浓硫酸、KMnO4、FeCl3 常见还原剂:Al、 Zn、 Fe; C、 H2、CO等
下列变化,必须加入还原剂才能实现的是( ) A.NaCl→AgCl B.H2O→O2 C.KClO3→KCl D.MnO2→MnCl2
某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( ) A.一定被氧化 B.一定被还原 C.可能被氧化,也可能被还原 D.以上都不是
+2 0 0 +1
得2e-,化合价降低,被还原
失2e-,化合价升高,被氧化
线桥两端同元素,箭头指向生成物,得失升降要注明,反应确定才完成,计算电子是关键,原(子)数乘上化价变。
练习:2. 用双线桥表示下列氧化还原反应。
单线相连失与得,方向电子要明确。
假设将CuSO4、FeSO4、Cu、Fe四种物质放在一起溶于水。问:哪些物质具有还原性?哪些物质具有氧化性?会发生什么反应?
Fe 比 Cu 容易失去电子,即 Fe 比 Cu 还原性强。
CuSO4 比 FeSO4 容易得到电子,即 CuSO4 比 FeSO4 氧化性强。
氧化性和还原性相对强弱的比较
K、 Ca、 Na、 Mg、 Al、 Zn、 Fe、Sn、Pb、(H)、 Cu、 Ag
失电子能力增强,还原性逐渐增强
K+ 、Ca2+ 、Na+ 、Mg2+ 、 Al3+ 、Zn2+ 、Fe2+ 、 H+ 、Cu2+ 、 Fe3+ 、Ag+
得电子能力增强,氧化性逐渐增强
CuSO4 + Fe = Cu + FeSO4
还原性:Fe﹥ Cu氧化性:CuSO4﹥ FeSO4 (Cu2+﹥ Fe2+)
还原性:还原剂﹥ 还原产物氧化性:氧化剂﹥ 氧化产物
氧化还原两性比,产物之性弱于剂。
方法二:依据反应方向判断
方法三:根据反应结果判断(产物的价态) 判断氧化性、还原性的强弱
同一物质在相同条件下,被不同氧化剂氧化的程度越大,氧化剂的氧化性越强。如2Fe+3Cl2=2FeCl3,Fe+S=FeS,则氧化性:Cl2>S。
方法四:从反应所需条件和反应的剧烈程度判断氧化性、还原性的强弱
例:己知反应: 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl 2FeCl2 + Cl2 = 2FeCl3 SO2 + I2 + 2H2O = H2SO4 + 2HI判断下列物质的还原能力由强到弱的顺序是( ) A. I- > Fe2+> Cl- >SO2 B. Cl-> Fe2+> SO2 > I-C. Fe2+>I- > Cl- > SO2 D. SO2>I- > Fe2+> Cl-
试判断下列物质Cl2、 Fe3+ 、I2 、SO2的氧化能力由强到弱的顺序是( )
Cl2 > Fe3+ > I2 > SO2
习题: 常温下,下列三个反应都能发生: 2D- + A2 = 2A- + D2 2B- + D2 = 2D- + B2 2A- + C2 = 2C- + A2由此得出正确结论是( )(A)A-、B-、C-、D-中C-还原性最强 (B)A2、B2、C2、D2中C2的氧化性最弱(C)2C-+B2 = 2B-+ C2不能发生(D)还原性A->B -
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( ) (A)无水硫酸铜、蔗糖 (B)硅胶、硫酸亚铁(C)食盐、硫酸亚铁 (D)生石灰、食盐
化学第三节 氧化还原反应教课课件ppt: 这是一份化学第三节 氧化还原反应教课课件ppt,共21页。PPT课件主要包含了为什么,新课引入,复习回顾,单线桥分析,探入新知,还原剂,氧化剂,氧化产物,还原产物,化合价升高的产物等内容,欢迎下载使用。
高中化学必修一 1.3.2 氧化剂和还原剂课件新: 这是一份高中化学必修一 1.3.2 氧化剂和还原剂课件新,共25页。
2020-2021学年第三节 氧化还原反应完美版课件ppt: 这是一份2020-2021学年第三节 氧化还原反应完美版课件ppt,共20页。PPT课件主要包含了氧化剂,还原剂,还原产物,氧化产物,化合价,反应类型,反应物,还原性,氧化性等内容,欢迎下载使用。













