



化学必修 第一册第三节 氧化还原反应背景图课件ppt
展开切开的苹果其表面的颜色会逐渐变深
喝红酒之前要先把红酒倒入醒酒器中,敞口放置一段时间,喝起来更加绵柔滑润,更加可口
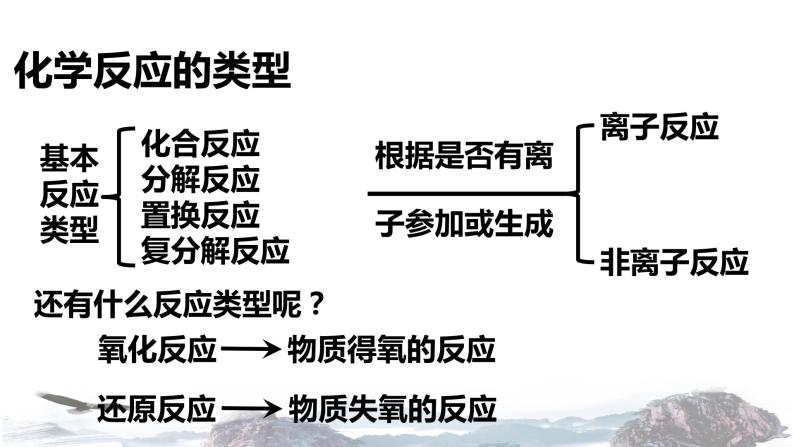
化合反应分解反应置换反应复分解反应
根据是否有离子参加或生成
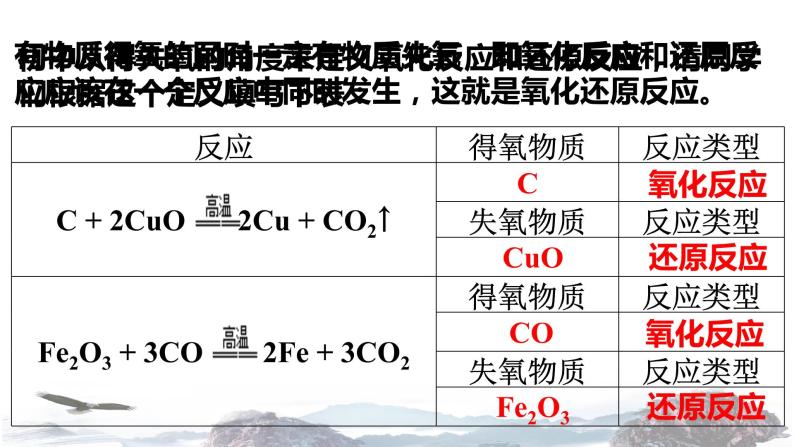
初中从得失氧的角度来定义氧化反应和还原反应,请同学们根据这个定义填写下表:
有物质得氧的同时一定有物质失氧,即氧化反应和还原反应应该在一个反应中同时发生,这就是氧化还原反应。
标出上表两个反应中各物质所含元素的化合价,比较反应前后化合价有无变化
反应中元素的化合价有变化
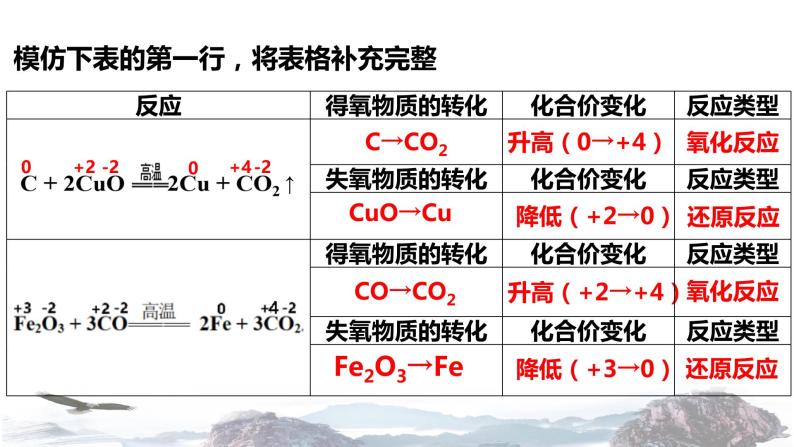
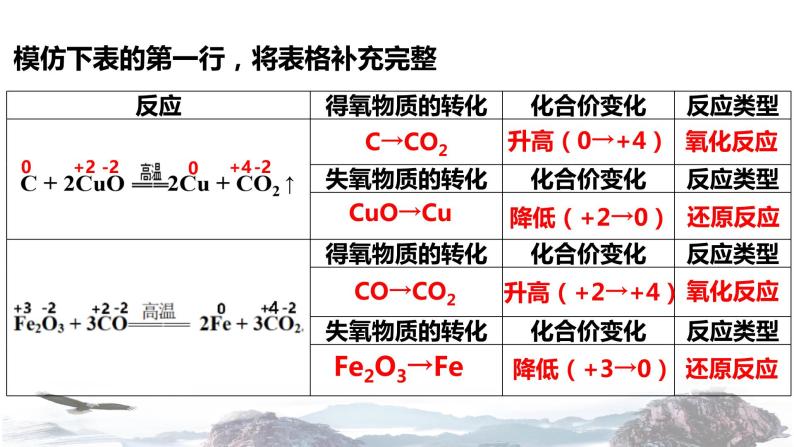
模仿下表的第一行,将表格补充完整
1、氧化反应和还原反应:
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
练习 判断下列过程是氧化反应还是还原反应:(1)Cu→CuO ( )(2)Cu→CuCl2 ( )(3)N2→NH3 ( )(4)FeCl2→FeCl3 ( )
+2 +3
Fe元素由0价升高到+2价,Fe发生氧化反应,被氧化
Fe + CuSO4=FeSO4 +Cu
化合价升高,被氧化,发生氧化反应
化合价降低,被还原,发生还原反应
Cu元素由+2价降低到0价,CuSO4发生还原反应,被还原
2、氧化还原反应:元素化合价发生变化的反应
反应中一定同时存在元素化合价的升高与降低
练习 模仿上面的图示,表示如下反应:
练习:下列反应中,属于非氧化还原反应的是 ( )A.Cl2+2KOH=KCl+KClO+H2OB.3NO2+H2O=2HNO3+NOC.Na2O2+SO2=Na2SO4D.2NaHCO3 Na2CO3+CO2↑+H2O
+1 +1 +4 -2
练习:下列反应转化关系(未配平)肯定不正确的是 ( )A.S+KOH→K2SO3+K2S+H2O B.FeO+HNO3→Fe(NO3)3+H2OC.Cu2O+H2SO4→CuSO4+Cu+H2OD.NH4NO3→N2O+H2O
氧化还原反应中一定同时存在元素化合价的升高与降低
切开的苹果中的某些化学物质与空气中的氧气接触,该化学物质被氧化,颜色发生了变化
红酒与氧气充分接触,使某些化学物质被氧化,从而使口感更柔和
3、氧化还原反应的本质
Na失去的电子去哪里了?
Na原子的最外层只有1个电子,Cl原子的最外层有7个电子
Cl原子得到Na原子失去的1个电子,转化为Cl-;Na失去最外层的1个电子转化为Na+
Na失电子,化合价升高,被氧化,发生氧化反应;Cl得电子,化合价降低,被还原,发生还原反应
反应的本质是电子的得失
反应的电子得失可以进行如下的表示:
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
反应中每个Na原子失去1个电子,一共有2个Na原子失电子,表示为失去2×e-,
反应中每个Cl原子得到1个电子,一共有2个Cl原子得电子,表示为得到2×e-,
得失电子要用m×ne-的形式进行表示,其中m代表发生电子得失的原子个数,n代表每个原子得失的电子数(当m或n为1时要省略)
练习:以上面的双线桥表示形式为例,对下面的反应进行双线桥分析:(1)Zn + 2H+ = Zn2+ + H2↑(2)2K + S = K2S
失去2e-,化合价升高,被氧化
Zn + 2H+ = Zn2+ + H2↑
得到2e-,化合价降低,被还原
2K + S = K2S
有的电解质是以分子的形式存在的,既然该物质不是以离子形式存在的,那么形成该物质的过程发生的就不会是电子的转移,
该反应中H的化合价由0价升高到+1价,被氧化;Cl的化合价由0价降低到-1价,被还原。
以H2和Cl2反应生成HCl为例,来分析此类物质形成过程中化合价变化的原因
以上过程中,元素化合价的变化是如何实现的呢?
H原子的最外层只有1个电子,Cl原子的最外层有7个电子
两者各以最外层1个电子组成一个共用电子对。该电子对受到两个原子核的共同吸引,两个原子可以共同占有这1对电子,从而使两个原子都达到了稳定结构
氯原子吸引共用电子对的能力强于氢原子,共用电子对偏向于氯原子而偏离于氢原子,所以在HCl中H的化合价为+1,Cl的化合价为-1
化合价变化的原因是:发生了共用电子对的偏移
根据上面的分析,同学们互相讨论回答下面的问题:NH3中N和H的化合价为什么分别是-3和+1?
NH3中N原子和H原子之间形成了3个共用电子对,其中3个共用电子对都偏向于N原子,所以N显-3价;3个H原子中每个H原子都有1个共用电子对偏离,所以3个H都显+1价
氧化还原反应的本质是电子的转移(电子得失或共用电子对偏移)。失电子(或电子对偏离),化合价升高,被氧化,发生氧化反应;得电子(或电子对偏向),化合价降低,被还原,发生还原反应。
氧化还原反应和之前学习的四个基本反应类型之间存在什么关系呢?如果以一个圆形表示氧化还原反应,同学们能不能画出四个基本反应类型与这个圆形的图示关系呢?
NaOH + HCl = NaCl + H2O
Zn + 2HCl = ZnCl2 + H2↑
高中人教版 (2019)第三节 氧化还原反应教课ppt课件: 这是一份高中人教版 (2019)第三节 氧化还原反应教课ppt课件,共16页。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教案配套ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教案配套ppt课件,共23页。PPT课件主要包含了课前思考,思考与交流1,分类标准得氧失氧,氧化反应,还原反应,氧化还原反应,得到氧化反应,失去氧还原反应,化合价升高,化合价降低等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应精品课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应精品课件ppt,共30页。PPT课件主要包含了氧化反应,物质得到氧的反应,还原反应,物质失去氧的反应,氧化还原反应,化学反应的分类,非氧化还原反应,置换反应,化合反应,分解反应等内容,欢迎下载使用。












