






高中化学人教版 (2019)必修 第一册第三节 氧化还原反应完美版ppt课件
展开1.通过探究,认识氧化还原反应中的几个重要规律。2.学会用得失电子守恒配平简单的氧化还原反应方程式。
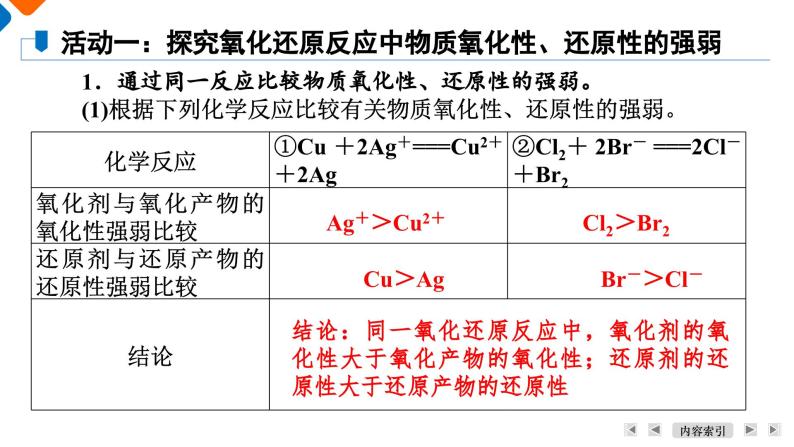
活动一:探究氧化还原反应中物质氧化性、还原性的强弱
1.通过同一反应比较物质氧化性、还原性的强弱。(1)根据下列化学反应比较有关物质氧化性、还原性的强弱。
结论:同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;还原剂的还原性大于还原产物的还原性
(2)已知氧化性:Cl2>Fe3+>I2。试判断下列氧化还原反应能否发生。①Cl2+2Fe2+===2Cl-+2Fe3+ ②2Fe2++I2===2Fe3++2I- ③Cl2+2I-===2Cl-+I2【答案】 ①和③能发生,②不能发生。
2.通过不同反应比较物质氧化性、还原性的强弱。(1)铜能溶于稀硝酸,不能溶于稀盐酸。比较氧化性:HCl______HNO3。(2)化学工作者分别用S、Cl2与Fe反应,其实验结果如下:比较氧化性:S______Cl2。
(3)某化学兴趣小组同学查得金属镁、铜分别与硝酸的反应:①5Mg+12HNO3(稀)===5Mg(NO3)2+N2↑+6H2O②3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O比较还原性:Mg______Cu。
活动二:探究氧化还原反应中元素化合价变化的规律
1.有化合价升高,一定有化合价降低。根据元素化合价变化的规律等知识,推测下列反应的部分产物(无须配平):(1)在催化剂作用下,汽车尾气的净化反应之一:NO2+CO―→N2+________。
2.同种元素不同价态之间发生氧化还原反应时,两种价态只可以向中间靠近,最多都变成中间的一个相同价态,化合价升降不可以出现“交叉”现象。(1)回答下列问题,体验同种元素不同价态之间发生氧化还原反应的化合价变化规律。①S+2H2SO4(浓)===3SO2↑+2H2O中:氧化产物是________,还原产物是________。②2K2S+K2SO3+3H2SO4===3S↓+3K2SO4+3H2O中:氧化产物是______,还原产物是______。③H2S+H2SO4(浓)===S↓+SO2+2H2O中:氧化产物是______,还原产物是________。
(2)根据上述你所发现的规律,写出下列反应的离子方程式。①向氯化铁溶液中加入铁粉:______________________。②酸性条件下,将氯化钠与次氯酸钠溶液混合:___________________________________。
Fe+2Fe3+===3Fe2+
ClO-+Cl-+2H+===Cl2↑+H2O
3.化合价升高(还原剂失电子)与化合价降低(氧化剂得电子)的定量关系。【答案】 均为6个。
【答案】 均为2个。(3)根据上述实例分析,请你对氧化还原反应中电子得失情况总结出一条规律。【答案】 在氧化还原反应中,还原剂失去的电子总数等于氧化剂得到的电子总数,简称“得失电子守恒”。
活动三:学习氧化还原反应基本规律的简单应用
1.氧化还原反应化学方程式的配平方法。(1)以____Cu+____HNO3(浓)===____Cu(NO3)2+____NO2↑+____H2O的配平为例:第一步:分析氧化剂、还原剂、氧化产物、还原产物的“纯粹”性。该反应中“纯粹”的物质有__________________________。说明:若氧化剂全部被还原或还原剂全部被氧化,则为“纯粹”的。否则为“不纯粹”的(如本例中HNO3中的N)。氧化产物和还原产物是否“纯粹”可以用同样的方法将反应逆过来看。
Cu、Cu(NO3)2、NO2
第二步:选择“纯粹”的氧化剂(或还原产物)、还原剂(或氧化产物)中任意2个,计算反应或生成1个该粒子时得失电子的数目。 -2e- +1e-____Cu+____HNO3(浓)===____Cu(NO3)2+____NO2↑+____H2O第三步:根据“电子得失总数相等”可知,n(Cu)∶n(NO2)=1∶2。_____Cu+____HNO3(浓)===____Cu(NO3)2+_____NO2↑+____ H2O第四步:根据“原子守恒”确定其他化学计量数,并检验。_____Cu+_____HNO3(浓)===_____Cu(NO3)2+_____NO2↑+_____ H2O
说明:实际书写方程式时,“1”可以省去。
2.氧化还原反应离子方程式的配平方法。
第四步:先配好所有氧化剂、还原剂、还原产物、氧化产物的系数,现得到如下结果: 第五步:计算方程式两边已配好系数物质的电荷总数。根据电荷守恒的原则配平OH-前的系数。最后根据元素守恒配平剩余物质的系数。
2.在KClO3+6HCl===KCl+3Cl2↑+3H2O反应中,被氧化与被还原的氯原子个数比为( )A.1∶6B.6∶1C.1∶5D.5∶1
3.根据下列反应判断,各组物质的氧化性由强到弱顺序正确的是( )①Cu+2FeCl3===2FeCl2+CuCl2②2FeCl2+Cl2===2FeCl3③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2OA.KMnO4、FeCl3、Cl2、CuCl2B.Cl2、FeCl3、KMnO4、CuCl2C.KMnO4、Cl2、FeCl3、CuCl2D.CuCl2、FeCl3、Cl2、KMnO4
4.在8NH3+3Cl2===N2+6NH4Cl反应中,如果有3 个Cl2分子参加了反应,则被氧化的NH3的分子数是( )A.1B.2C.6D.8
5.Fe与盐酸反应生成FeCl2,而Fe在Cl2中燃烧则生成FeCl3。下列说法正确的是( )A.反应中Fe均作氧化剂B.Cl2的氧化性比盐酸的氧化性强C.Fe在Cl2中燃烧,Fe和Cl2的化学计量数之比为3∶2D.反应等量的铁,两个反应转移电子的总数相等
(2)事实上,金属镁比铝能更快消除水体中氮的污染,其反应原理和金属铝相同。①写出镁和含氮废水反应的离子方程式:______________________ ___________________________。
②假设国际现货市场每吨镁粉为1 730美元左右,每吨铝粉的价格为3 585美元左右,从价效比的角度出发,请通过计算分析,应选用哪种金属清除水体中的氮元素经济上更合算?
消耗镁粉、铝粉的价格之比=(4×1 730)∶(3×3 585)<1故选用金属镁清除水体中的氮元素经济上更合算。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教学课件ppt,共26页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量优秀课件ppt: 这是一份人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量优秀课件ppt,共31页。PPT课件主要包含了内容索引,学习目标,活动方案,mol,无土栽培种植,000g,课堂反馈,1mol,85g,02×1022等内容,欢迎下载使用。
必修 第一册第二节 氯及其化合物精品课件ppt: 这是一份必修 第一册第二节 氯及其化合物精品课件ppt,共27页。PPT课件主要包含了内容索引,学习目标,活动方案,有白色沉淀生成,沉淀不溶解,无明显现象,沉淀溶解并放出气体,红色布条不褪色,起漂白作用的不是氯气,HClO等内容,欢迎下载使用。













