

高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素优秀学案设计
展开第二节 化学反应速率与限度
第2课时 化学反应的限度和化学反应条件的控制
1、了解可逆反应。
2、理解化学平衡状态和学会平衡状态的判断。
3、了解控制反应条件在生产生活和科学研究中的作用。
重点:可逆反应,化学平衡状态的建立和判断;
难点:化学反应平衡状态的判断。
化学反应速率
一、化学反应限度
思考:我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
1、可逆反应:
在相同条件下能向正反应方向进行同时又能向逆反应方向进行的反应称为可逆反应。
表示方法:书写可逆反应的化学方程式时不用“===”而用“”。
【思考与交流】
1、以下几个反应是否是可逆反应?为什么?
2、14CO2+CCO,达到化学平衡后,平衡混合物中含14C 的粒子有 。
2、化学平衡状态的建立
在一固定容积的密闭容器里,加 1 ml N2和3 ml H2(合适催化剂),能发生什么反应?2 ml NH3?
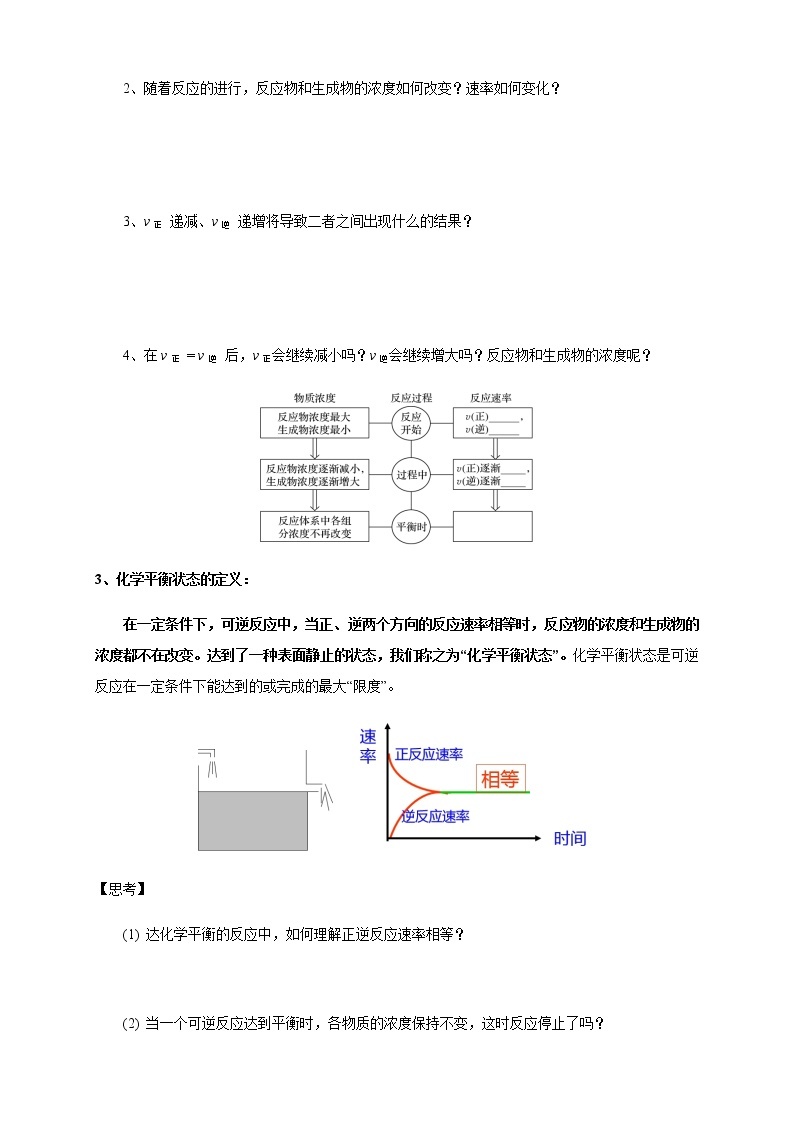
【思考】
1、反应刚开始时, v正 、v逆 为何值?
2、随着反应的进行,反应物和生成物的浓度如何改变?速率如何变化?
3、v正 递减、v逆 递增将导致二者之间出现什么的结果?
4、在v正 = v逆 后,v正会继续减小吗?v逆会继续增大吗?反应物和生成物的浓度呢?
3、化学平衡状态的定义:
在一定条件下,可逆反应中,当正、逆两个方向的反应速率相等时,反应物的浓度和生成物的浓度都不在改变。达到了一种表面静止的状态,我们称之为“化学平衡状态”。化学平衡状态是可逆反应在一定条件下能达到的或完成的最大“限度”。
【思考】
(1) 达化学平衡的反应中,如何理解正逆反应速率相等?
(2) 当一个可逆反应达到平衡时,各物质的浓度保持不变,这时反应停止了吗?
4、化学平衡状态的特征:
(1) 逆: 。
(2) 等: 。
(3) 动: 。
(4) 定: 。
(5) 变: 。
【课堂练习】
1、对于可逆反应M+NQ 达到平衡时,下列说法正确的是( )
A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. 反应物和生成物的浓度都保持不变
D. 反应已经停止
2、在一定温度下,可逆反应A(g)+3B (g)2C(g) 达到平衡状态的标志是( )
A. C的生成速率和C的分解速率相等.
B. 单位时间内生成1mlA同时生成了3mlB.
C. A、B、C浓度不再变化.
D. A、B、C的分子个数之比为1:3:2
5、化学平衡状态的判断
以mA(g)+nB(g)pC(g)+qD(g) 为例
【课堂练习】
1、以3H2+N22NH3为列分析,判断下列情形是否达到平衡状态?
(1) 若有1ml N2消耗,则有1ml N2生成。
(2) 若有1ml N2消耗,则有3ml H2生成。
(3) 若有1ml N2消耗,则有2ml NH3生成。
(4) 若有1ml N≡N键断裂,则有6ml N﹣H键断裂。
(5) 若有1ml N≡N键断裂,则有6ml N﹣H键生成。
(6) 若反应体系中N2、H2、NH3的百分含量不变。
(7) 反应体系中平均相对分子质量一定。
(8) 若体系的体积一定,气体的密度一定。
(9) 若体系的体积一定,气体的压强一定。
2、可逆反应2NO2(红棕色)2NO(无色)+O2(无色)在密闭容器中反应,达到化学平衡状态的是
A.单位时间内生成n ml O2同时生成2n ml NO2
B.单位时间内生成n ml O2同时生成2n ml NO
C.c(NO2):c(NO):c(CO2)= 2: 2: 1
D.混合气体的颜色不再改变
F.混合气体的密度不再改变
E.混合气体的平均相对分子质量不再改变
H.混合气体个组分的 体积分数不再改变
3、若换成H2(g)+I2(g)2HI(g)呢?
4、 3mlA和2.5mlB混合于2L的密闭容器中发生反应:3A(g)+B(g)aC(g)+2D(g),
5min后达到平衡,已知v(c)=0.05 ml /(min·L),生成D为1 ml。下列选项正确的是( )
A. v (A)=0.15 ml/(min·L) B. a=2
C.平衡时B的转化率为20% D.平衡时压强为起始时的0.8倍
【总结】
化学平衡状态的判断依据
(1)直接判断依据
eq \b\lc\ \rc\}(\a\vs4\al\c1(①v正A=v逆A>0,②各物质浓度保持不变))⇒达到平衡状态
(2)间接判断依据
以mA(g)+nB(g)pC(g)+qD(g)为例
二、化学反应条件的控制
合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在400~500℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。
【思考与讨论】
为提高燃料的燃烧效率,应如何调控燃烧反应的条件?(提示:可以从以下几方面考虑,如燃料的状态、空气用量、炉膛材料、烟道废气中热能的利用,等等。)
【总结】
【课堂练习】
1.下列关于化学反应限度的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的最大限度
B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零
C.平衡状态时,各物质的浓度保持相等
D.化学反应的限度不可以通过改变条件而改变
2.在体积不变的密闭容器中发生反应,下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1 ml N≡N键断裂时,有6 ml N—H键断裂
D.单位时间内生成2a ml NH3,同时消耗a ml N2
3.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面说法中错误的是( )
A.能够节约原料和能源
B.能够提高产品的产量
C.能够提高经济效益
D.能够提高化学反应速率
4.下列措施可以提高燃料燃烧效率的是_________(填序号)。
①提高燃料的着火点 ②降低燃料的着火点
③将固体燃料粉碎 ④将液体燃料雾化处理
⑤将煤进行气化处理 ⑥通入适当过量的空气
5.下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是_______(填序号)。
(1)步骤①中“净化”可以防止催化剂中毒
(2)步骤②中“加压”可以加快反应速率
(3)步骤②采用的压强是2×107 Pa,因为在该压强下铁触媒的活性最大
(4)步骤③,选择高效催化剂是合成氨反应的重要条件
(5)目前,步骤③一般选择控制反应温度为700 ℃左右
(6)步骤④⑤有利于提高原料的利用率,能节约生产成本类型
判断依据
平衡状态
混合物体系中各成分的含量
①各物质的物质的量或各物质的物质的量分数一定
②各物质的质量或各物质的质量分数一定
正、逆反应速率的关系
①在单位时间内消耗了m ml A同时生成m ml A,即v正=v逆
②在单位时间内消耗了n ml B同时生成p ml C,则v正不一定等于v逆
③在单位时间内生成n ml B,同时消耗q ml D,因二者变化均表示v逆,所以v正不一定等于v逆
温度
体系温度一定(其他不变)
颜色
反应体系内有色物质的颜色一定
高中化学人教版 (2019)必修 第二册第六章 化学反应与能量第二节 化学反应的速率与限度导学案: 这是一份高中化学人教版 (2019)必修 第二册第六章 化学反应与能量第二节 化学反应的速率与限度导学案,共6页。
高中化学人教版 (2019)必修 第二册第六章 化学反应与能量实验活动7 化学反应速率的影响因素精品学案: 这是一份高中化学人教版 (2019)必修 第二册第六章 化学反应与能量实验活动7 化学反应速率的影响因素精品学案,共6页。
高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸优质学案设计: 这是一份高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸优质学案设计,共5页。学案主要包含了乙醇的物理性质,乙醇的结构,乙醇的化学性质,用途等内容,欢迎下载使用。













