



第五单元化学方程式复习课件
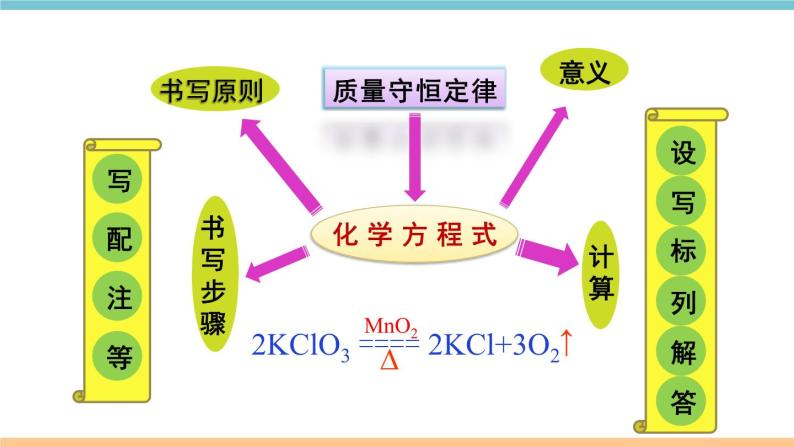
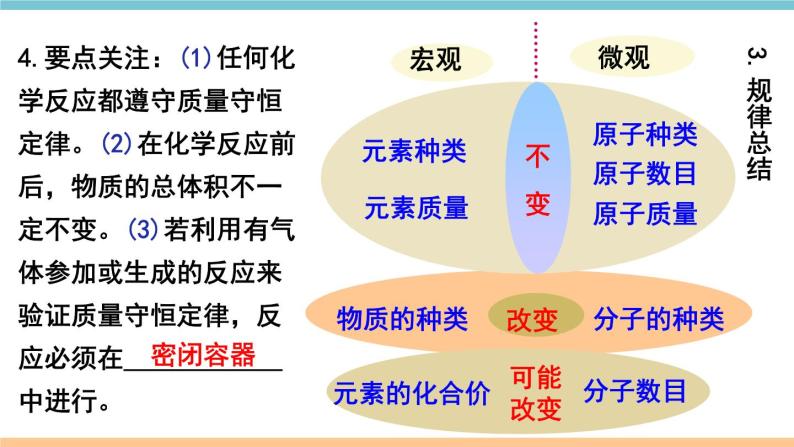
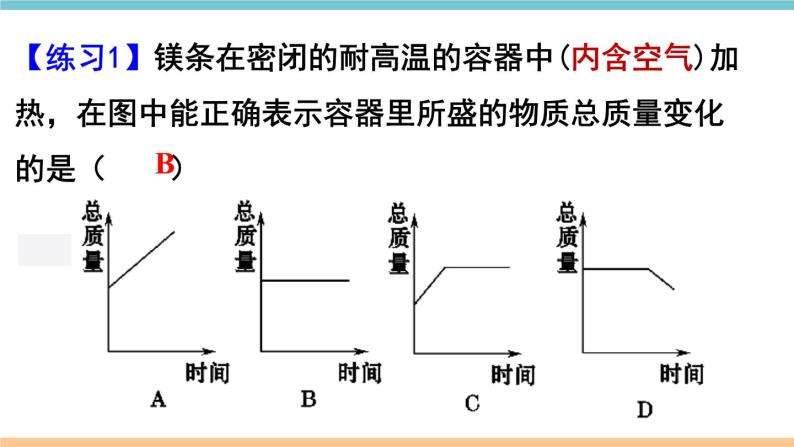
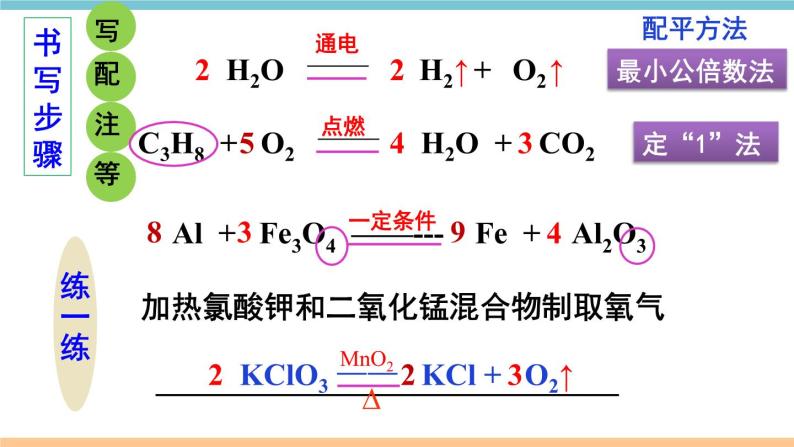
展开第五单元 化学方程式小结与复习质量守恒定律化学方程式书写步骤书写原则计算意义写等配注答解列标设写2KClO3 ==== 2KCl+3O2MnO2∆↑考点一 质量守恒定律1.质量守恒定律:参加化学反应的各物质________总和,________反应后生成的各物质的质量总和。等于质量 2.解释:化学反应的过程,实际上就是参加反应的各物质所含的______重新组合生成其他物质的过程,因此在化学反应前后原子的_____没有改变,原子的_____没有增减,原子的_____也没有改变(原子三不变),所以物质的总质量在反应前后保持不变。原子种类数目质量原子数目原子质量原子种类元素质量元素种类物质的种类分子的种类可能改变分子数目元素的化合价3.规律总结4.要点关注:(1)任何化学反应都遵守质量守恒定律。(2)在化学反应前后,物质的总体积不一定不变。(3)若利用有气体参加或生成的反应来验证质量守恒定律,反应必须在____________中进行。密闭容器 【例1】(2018湖北黄冈中考)一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是( )A. x 的值等于0.5 B. 甲一定是化合物C. 丙和丁的质量变化比为8:1 D. 该反应是化合反应解析思路:根据质量守恒定律,x=50+0.5-23-24-3=0.5。由此可见乙的质量不变,而甲的质量减少,丙、丁的质量增加。由此判断该反应是分解反应。那么,甲一定是化合物。同时根据质量守恒定律,甲质量减少(50-23)g,丙生成24g,丁生成3g,可知是甲、丙、丁的质量比是27:24:3=9:8:1。D【练习1】镁条在密闭的耐高温的容器中(内含空气)加热,在图中能正确表示容器里所盛的物质总质量变化的是( )B考点二 化学方程式1.概念:用__________表示化学反应的式子。2.书写 ①必须以_____________为基础,绝不能 凭空臆造。 ②遵守_____________,即化学方程式 两边各种原子的总数要相等。 化学式 客观事实 质量守恒定律 (1)原则(2)步骤写、配、注、等H2O ———O2 H2 + 加热氯酸钾和二氧化锰混合物制取氧气 ______________________________ ↑通电22↑C3H8 + O2 ———CO2 Al + Fe3O4 ——--- Fe + Al2O3H2O + 435点燃最小公倍数法定“1”法书写步骤练一练一定条件配平方法 938 4 KClO3 —— KCl + O2322↑MnO2∆写等配注【例2】关于化学方程式CH4+2O2==== CO2+2H2O的描述正确的是( )A.甲烷加氧气在点燃条件下,反应生成二氧化碳和水B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水C.每1个甲烷分子和2个氧分子反应生成1个二氧化碳分子和2个水分子 D.1 g 甲烷和2 g 氧气在点燃条件下,生成 1 g 二氧化碳和2 g 水点燃 化学方程式可表示:反应物和生成物的种类、反应的条件、反应物和生成物的微观粒子个数比、反应物和生成物的质量比等。但要注意读化学方程式时,“+”应读作“和”,“===”应读作“生成”。解题思路:C【例3】3Cu+8HNO3 ==3Cu(NO3)2+2X↑+4 H2O, X的化学式为 。Cu H N O左边右边 3 8 8 24 3 8 6 22— 2 22 1 1 NO减法短除法列出元素【例4】下图为某反应的微观示意图, 和 分别代表 不同元素的原子,该反应可能是( )解题思路:先从生成物和反应物中划去相同的粒子。 B【例5】(2018贵州黔南州中考)汽车尾气排放的有毒气体可在“催化转化器”中转化为无污染的气体。下图为微观反应示意图,请回答:(1)该微观反应过程中出现了_______种氧化物;(2)该反应的化学方程式为_______________________;(3)该反应前后原子的种类和个数均________(选填“减少”、“不变”或“增加”)。不变2NO+2CO==== 2CO2+N23催化剂【练习2】(2018湖北荆州中考)根据化学方程式不能获得的信息有( )A.化学反应发生的条件 B.化学反应的快慢C.反应物和生成物的质量比 D.化学反应的反应物和生成物B【练习3】现有化学反应X+Y===Z,若将a g X和b g Y在一定条件下充分反应,生成Z的质量( )A.等于(a+b) g B.大于(a+b) gC.小于(a+b) g D.不大于(a+b) gD考点三 根据化学方程式的简单计算2.解题步骤(1)设:根据题意设未知量。(2)写:正确书写有关反应的化学方程式。(3)标:上标相关物质的质量比,下标已知量和未知量(4)列:列出比例式(5)解: 求解(6)答:简明地写出答案。1.依据:___________定律。质量守恒【例6】 加热分解6.3g高锰酸钾,可以得到多少克氧气?1.设未知量设:可以得到氧气的质量为x___ 2.写出化学方程式22×(39+55+16×4)6.3g4.列比例式x322×1586.3gx_______=x = 0.6g6.简明地写出答案Δ5.求解 16×2 3.标出相关物质质量比 及已知量、未知量答:可以得到0.6g氧气。【例7】以H2O2溶液为原料制取4kg氧气,需要H2O2的质量是多少?2H2O2 2H2O + O2 解:设需要过氧化氢的质量为x 4kg答:需要8.5kg的过氧化氢。x=8.5kg2×34 32已知量带单位配平化学方程式计算结果要有单位MnO2x 32未知量x不带单位带着单位进行运算上下对齐2不要丢掉哦!【例8】(2018新疆乌鲁木齐中考)碳酸氢钠用于焙制糕点,在270℃时分解的化学方程式为2NaHCO3===Na2CO3+H2O+CO2↑。现取NaHCO3 16.8g,在敞口容器中加热到质量不再改变。计算容器中剩余固体物质的质量(计算结 果保留一位小数)。∆解题思路:正确理解“加热到质量不再改变”的含义是解题的关键。配平下列化学方程式:(1) CuSO4+ NaOH === Cu(OH)2↓+ Na2SO4;(2) P+ O 2===== P2O5;(3) Fe2O3+ CO ===== Fe+ CO2;(4) C2H4+ O2 ===== CO2+ H2O。高温点燃点燃2 1 3 2 3 1 2 5 4 1 2 1 1 2 3 【化学方程式专项练习1】现有下列物质:水、铁丝、氧气、硫磺、氢气,从中选出物质,各写一个符合下列要求的化学方程式。(1)物质燃烧生成黑色固体 ;(2)有两种单质气体生成 ;(3)生成有刺激性气味的体 ;(4)最轻的气体燃烧 。【化学方程式专项练习2】3Fe+2O2=====Fe3O42H2O=====2H2↑+O2↑通电S+O2=====SO22H2+O2=====2H2O 点燃 点燃点燃哥伦比亚号航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)混合物作为固体燃料。加热铝粉使其被氧气氧化,放出大量的热,促使混合物中的高氯酸铵受热分解,同时生成四种气体:两种气体是空气中的主要成分,一种气体是氯气(Cl2),还有一种气体是化合物(常温下是液态),因而产生巨大的推动力。试写出其中涉及的化学方程式:(1)铝粉被氧气氧化成氧化铝:___________________;(2)高氯酸铵受热分解___________________________________________。【化学方程式专项练习3】2NH4ClO4 ==N2↑+2O2↑+Cl2↑+4H2O↑∆4Al+3O2=====2Al2O3∆易错点归纳1.质量守恒定律理解有误:①对物理变化无意义;②体积、分子数目不守恒;③不能把“参加反应的各物质”简单地理解为“反应物”(例如例1中甲)。2.化学方程式书写错误:①错写化学式;②臆造不存在的反应;③没有配平;④错写或漏写反应条件;⑤错标或漏标生成物状态符号。3.化学方程式计算格式不规范,代入化学方程式计算的量不是纯净物的质量。









