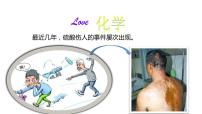



鲁教版九年级下册第七单元 常见的酸和碱第一节 酸及其性质课前预习课件ppt
展开复分解反应酸的化学通性
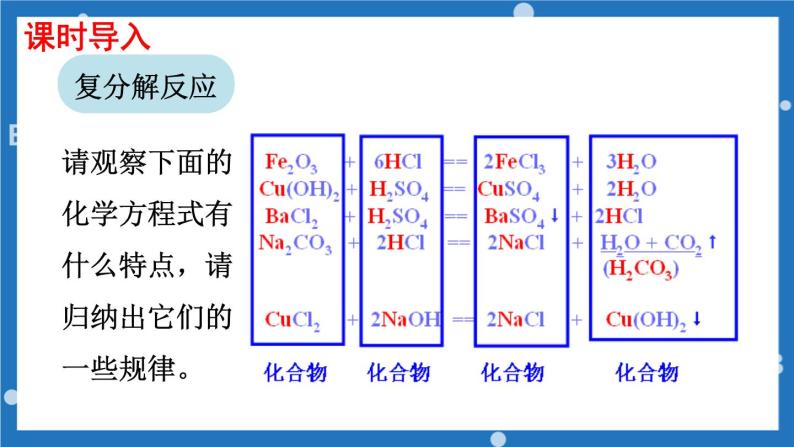
请观察下面的化学方程式有什么特点,请归纳出它们的一些规律。
1、复分解反应的定义两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应表达式:AB + CD→ AD+ CB
6HCl + Fe2O3=2FeCl3 + 3H2O H2SO4 + BaCl2=BaSO4 ↓+ 2HCl2NaOH + CuCl2=Cu(OH)2 ↓+ 2NaCl2HCl + Ba(OH)2=BaCl2 + 2H2O
定义:由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。可表示为:AB+CD ==== AD+CB
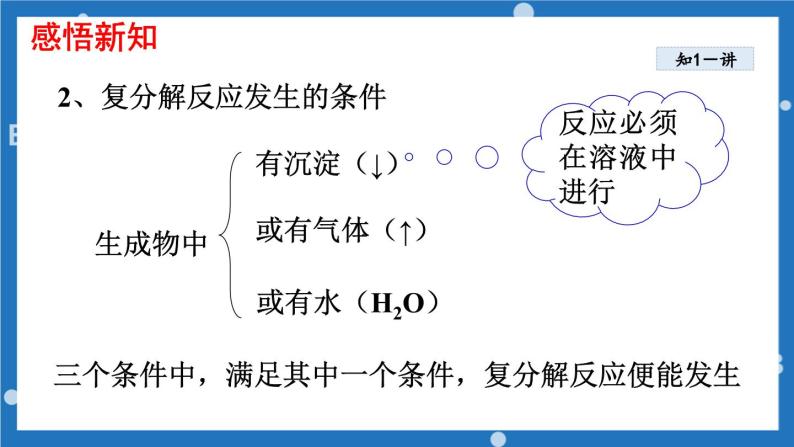
2、复分解反应发生的条件
三个条件中,满足其中一个条件,复分解反应便能发生
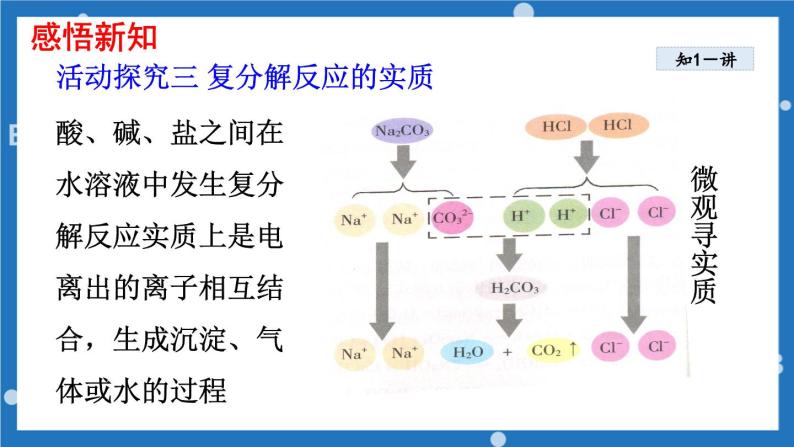
酸、碱、盐之间在水溶液中发生复分解反应实质上是电离出的离子相互结合,生成沉淀、气体或水的过程
活动探究三 复分解反应的实质
下列属于复分解反应的是( )A. 2NaOH+CO2 ==== Na2CO3+H2OB. Ba(NO3)2+Na2CO3 ==== BaCO3 ↓ +2NaNO3C. H2O+3NO2 ==== 2HNO3+NOD. CO+CuO ==== Cu+CO2
解题秘方:根据复分解反应的定义来判断,即两种化合物互相交换成分,生成另外两种化合物的反应。解:A 中是两种化合物反应生成另外两种化合物,但不是交换成分得到的,不是复分解反应;同理C 也不正确;D 中有单质生成,不是复分解反应。
1.【中考•益阳】甲、乙、丙、丁四种物质,存在关系:甲+乙→丙+丁。下列说法正确的是( )A.若丙、丁为盐和水,则甲、乙一定为酸和碱B.若甲、乙、丙、丁都是化合物,则该反应一定是复分解反应C.若该反应为复分解反应,则生成物中一定有水D.复分解反应中一定没有单质
2.下列各组物质混合,发生复分解反应且产生气泡的是( )A.氢氧化钾溶液与稀硫酸B.锌与稀硫酸C.稀硫酸与氯化钡溶液D.碳酸钾与稀盐酸
3.【中考·天水】下列各组物质加入水中充分搅拌后,同组反应物恰好完全反应,过滤后,在滤纸上留下两种不溶物质的是( )A.Ca(NO3)2、BaCl2、AgNO3B.MgCl2、KOH、NaClC.K2CO3、CuSO4、KClD.CuSO4、Ba(OH)2、Cu(NO3)2
1. 概念 由金属阳离子和酸根离子构成的化合物,称为盐。2. 常见的酸根离子 硫酸根离子(SO42-)、碳酸根离子(CO32-)、硝酸根离子(NO3-)等。氯离子(Cl-)是盐酸(HCl)的酸根离子。
[模拟·聊城] 在抗击新型冠状病毒性肺炎疫情的防控工作中,我们常选用“84”消毒液进行杀菌消毒,其有效成分次氯酸钠(NaClO)属于( )A. 酸 B . 盐 C . 氧化物 D . 混合物
解题秘方:解答本题应采用内涵分析法,结合盐的概念,找出各物质的组成特征,进行分析判断。解:NaClO 是由钠离子和次氯酸根离子构成的化合物,属于盐。
酸具有哪些相似的化学性质(通性)?
1.酸溶液能使紫色石蕊试液变红,不能使无色酚酞试液变色。
2.酸+金属 盐+氢气 Fe+2HCl=FeCl2+H2↑ Zn+H2SO4=ZnSO4+H2↑ Mg+2HCl=MgCl2+H2↑ Fe+H2SO4=FeSO4+H2↑
3.酸+金属氧化物 盐+水 Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O4.酸+盐 新盐+新酸 CaCO3+2HCl=CaCl2+CO2↑+H2O Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
1. 酸具有通性的原因 在水溶液中解离出的阳离子都是氢离子。2. 酸的通性
1.酸能使酸碱指示剂显示不同的颜色;2.酸能与多种活泼金属反应生成氢气;3.酸能与某些金属氧化物反应,生成水。
[中考·青岛] 稀盐酸和稀硫酸具有相似的化学性质,其本质原因是( )A. 都能与指示剂作用B. 都能解离出酸根离子C. 溶液中的阳离子都是氢离子D. 都含有氢元素
解题秘方:解答本题应运用结构决定性质的思想,通过分析酸的结构特点,可得出酸具有通性的原因。解:稀盐酸和稀硫酸具有酸的通性的本质原因是:溶液中的阳离子都是氢离子。故选C。
1.【中考·青岛】稀盐酸和稀硫酸具有相似的化学性质,其本质原因是( )A.都能与指示剂作用 B.都能解离出酸根离子C.溶液中的阳离子都是氢离子 D.都含有氢元素
2.向盛有下列物质的试管中加入过量的稀盐酸,最后能形成无色溶液的是( )A.氧化铜 B.氧化铁C.镁粉 D.紫色石蕊溶液
酸能使紫色的石蕊变红,无色酚酞不变色。
酸与某些金属氧化物反应
1.厕所用清洁剂中含有盐酸,如果不慎洒到大理石的地面上,会发生嘶嘶声,并有气体产生。这种气体是( )A.二氧化硫B.二氧化碳C.氢气D.氧气
2.某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8 t(H2SO4的质量分数为20%),与足量的废铁屑反应,可生产FeSO4的质量是多少?
初中化学鲁教版九年级下册第一节 酸及其性质背景图ppt课件: 这是一份初中化学鲁教版九年级下册<a href="/hx/tb_c91622_t3/?tag_id=26" target="_blank">第一节 酸及其性质背景图ppt课件</a>,共26页。PPT课件主要包含了常见的酸,酸的化学性质,内容提要,学习目标,油状液体,84gmL,无明显现象,刺激性气味,18gmL,瓶口出现白雾等内容,欢迎下载使用。
初中化学鲁教版九年级下册第一节 酸及其性质教课ppt课件: 这是一份初中化学鲁教版九年级下册<a href="/hx/tb_c91622_t3/?tag_id=26" target="_blank">第一节 酸及其性质教课ppt课件</a>,共15页。PPT课件主要包含了猜想与假设,能与金属反应,能与金属氧化物反应,实验要求,实验目标,实验内容,实验步骤,产生无色气体,无现象,产生白色沉淀等内容,欢迎下载使用。
初中化学鲁教版九年级下册第一节 酸及其性质说课课件ppt: 这是一份初中化学鲁教版九年级下册第一节 酸及其性质说课课件ppt,共29页。PPT课件主要包含了知识回顾,刺激性气味,19gmL,%~38%,探究活动1,探究活动2,有大量气泡产生,有白色沉淀生成,无明显现象,盐酸的化学性质等内容,欢迎下载使用。