初中化学鲁教版九年级下册第一节 酸及其性质学案设计
展开酸及其性质
教学目标
知识:掌握盐酸、硫酸的化学性质及有关的化学方程式,了解其物理性质和用途。
能力:浓H2SO4的特性及稀释。
情感:通过展示样品及演示实验,培养学生的观察能力和分析实验现象的能力。
重点 、难点
盐酸、稀H2SO4的化学性质。
化学方程式的书写。
课前准备:(请通过课前预习和复习把这些习题完成。试试看,相信自己!)
1.酸在生产生活中很常见,例如人的胃液中含有 ,汽水等碳酸饮料中含有 ,汽车电瓶中常有 ,食醋中含有 ,酸雨中含有极少量的 和 。在所有的酸溶液中,都存在着相同的微粒 (填写微粒的符号)。
【课堂学习研讨】
一、常见的酸
【活动与探究】观察探究浓硫酸和浓盐酸的物理性质,填写下表(括号内填写其溶质的化学式)
| 浓盐酸( ) | 浓硫酸( ) |
颜色、状态、气味 |
|
|
密度(与水比较) |
|
|
敞开试剂瓶口发生的现象 |
|
|
与少量水混合发生的现象 |
|
|
其它 |
|
|
【小结】
1、 浓盐酸的物理性质
2、 浓硫酸的特性:
(1)易 。常可作 (如干燥 、 等气体;但不可干燥NH3等碱性气体[2NH3 + H2SO4 == (NH4)2SO4])用浓硫酸来干燥气体时,如何组装洗气瓶?
气体流向如何?
(2)腐蚀性。浓硫酸与蔗糖、纸张反应,使之炭化。
(3)强氧化性——与金属发生反应,不生成氢气而是水。)
实验室为什么不能用浓硫酸和锌制取氢气? 。
★浓硫酸与铁反应后,能生成一层致密的氧化膜,造成钝化现象,所以可以用铁槽车装浓硫酸。
3、稀释浓硫酸的正确操作
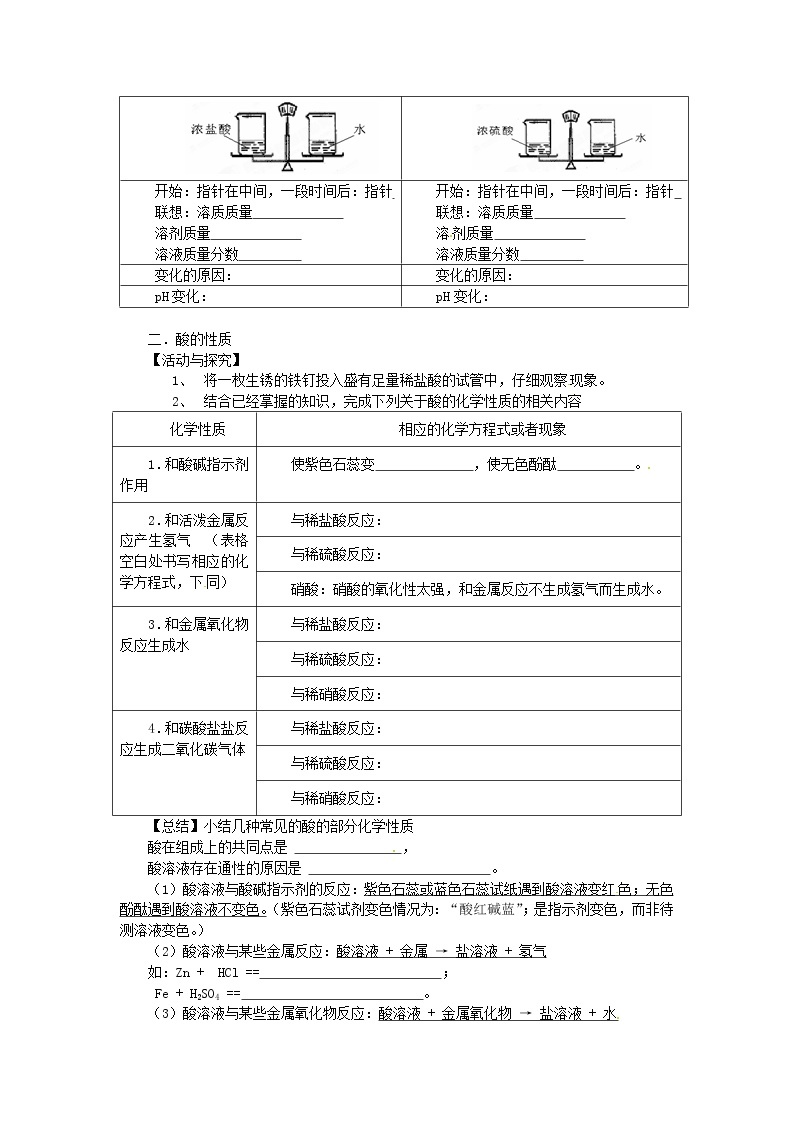
【实践应用】下列图示实验中可能产生的现象?为什么?
开始:指针在中间,一段时间后:指针 联想:溶质质量 溶剂质量 溶液质量分数 | 开始:指针在中间,一段时间后:指针 联想:溶质质量 溶剂质量 溶液质量分数 |
变化的原因: | 变化的原因: |
pH变化: | pH变化: |
二.酸的性质
【活动与探究】
1、 将一枚生锈的铁钉投入盛有足量稀盐酸的试管中,仔细观察现象。
2、 结合已经掌握的知识,完成下列关于酸的化学性质的相关内容
化学性质 | 相应的化学方程式或者现象 |
1.和酸碱指示剂作用 | 使紫色石蕊变 ,使无色酚酞 。 |
2.和活泼金属反应产生氢气 (表格空白处书写相应的化学方程式,下同) | 与稀盐酸反应: |
与稀硫酸反应: | |
硝酸:硝酸的氧化性太强,和金属反应不生成氢气而生成水。 | |
3.和金属氧化物反应生成水 | 与稀盐酸反应: |
与稀硫酸反应: | |
与稀硝酸反应: | |
4.和碳酸盐盐反应生成二氧化碳气体 | 与稀盐酸反应: |
与稀硫酸反应: | |
与稀硝酸反应: |
【总结】小结几种常见的酸的部分化学性质
酸在组成上的共同点是 ,
酸溶液存在通性的原因是 。
(1)酸溶液与酸碱指示剂的反应:紫色石蕊或蓝色石蕊试纸遇到酸溶液变红色;无色酚酞遇到酸溶液不变色。(紫色石蕊试剂变色情况为:“酸红碱蓝”;是指示剂变色,而非待测溶液变色。)
(2)酸溶液与某些金属反应:酸溶液 + 金属 → 盐溶液 + 氢气
如:Zn + HCl == ;
Fe + H2SO4 == 。
(3)酸溶液与某些金属氧化物反应:酸溶液 + 金属氧化物 → 盐溶液 + 水
注意:该反应过程中,金属元素的化合价 ,酸中的原子团不变。
如:CuO + HCl == ZnO + HNO3 ==
Fe2O3 + H2SO4 ==
(4)酸溶液与某些盐反应:酸溶液 + 盐 → 新酸+ 新盐
如:CaCO3 + HCl == Na2CO3 + H2SO4 ==
Na2CO3+ HCl == K2CO3 + HNO3 ==
HCl + AgNO3 == BaCl2 + H2SO4 ==。
【延伸知识】Cl—及SO42-的检验
A.向待测溶液中加入AgNO3溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有Cl-,如果没有沉淀或者沉淀消失,则不含有Cl-。
B.向待测溶液中加入Ba(NO3)2溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有SO42-,如果没有沉淀或者沉淀消失,则不含有SO42-。
【课堂评价练习】
1.人体内的胃液里含有少量的酸,该酸是() A.硫酸 B.碳酸 C.醋酸 D.盐酸
2. 实验室制H2和CO2(用大理石)都可以使用的酸是()
A.浓硫酸 B.稀硝酸 C.稀硫酸 D.稀盐酸
3.下列说法不正确的是()
A.打开浓盐酸的试剂瓶,瓶口有白雾冒出 B.盐酸和铁粉反应后溶液呈黄色
C.盐酸使紫色石蕊试液变红色 D.盐酸可除去铁制品表面的锈
4.下列化学方程式正确的是()
A.2Fe + 6HCl == 2FeCl3 + 3H2↑ B.Fe2O3 + 4HCl == 2FeCl2 + 3H2O
C. Na2CO3 + 2HNO3 == 2NaNO3 + H2O + CO2↑ D.Zn + 2HNO3 == Zn(NO3)2 + H2↑
5. 下列物质①FeCl3 ②ZnCl2 ③CuCl2 ④AlCl3中,能用金属和盐酸直接反应制得的物质是 ( )
A. ①② B.②④ C. ③④ D. ①③
6. 酸都具有某些共同的性质,主要决定于()
A.与指示剂作用 B.都含有氢元素
C.都能电离出相同的H+ D.都能使紫色石蕊试液变红
7.下列溶液加热蒸发时,溶质的质量分数可能会降低的是()
A.食盐溶液 B.浓盐酸 C.稀硫酸 D.硝酸钾溶液
8.将生锈的铁钉投入盐酸中,稍微热,观察到溶液 (填颜色变化情况),该反应的化学方程式是 ;继续观察可以看到铁钉表面有 放出,反应的化学方程式为 。
10. 烧水的铝壶中经常结有一层水垢(水垢的主要成分是碳酸钙和氢氧化镁),用适量的稀盐酸可以除去它,写出反应的化学方程式 、 ;
【课后拓展练习】
1.下列几种溶液久置于空气中,溶质成分不变,但溶质的质量分数减小且溶液质量增加的是 ( )
A. 浓硫酸 B. 浓盐酸 C. 浓硝酸 D. 石灰水
2.请用实验探究:盐酸溶液中哪一种粒子(H2O、H+、Cl-)能使指示剂变色?
实验步骤:
①在第一支试管中加入约2 mL蒸馏水,滴入几滴紫色石蕊试液,观察现象。
②在第二支试管中加入约2 mL NaCl溶液(pH=7),滴入几滴紫色石蕊试液,观察现象。
③在第三支试管中加入约2 mL HCl溶液,滴入几滴紫色石蕊试液,观察现象。
通过上述实验,回答下列问题(下述“现象”是指紫色石蕊试液是否变色):
实验①看到的现象是 ,你得出的结论是 ;
实验②看到的现象是 ,你得出的结论是 ;
实验③看到的现象是 ,你得出的结论是 。
4.有失去标签的的浓盐酸和的浓硫酸各一瓶,请用不同的方法将他们区分开:
物理方法:________________________________________________。
化学方法:_______________________________________________。
初中化学鲁教版九年级下册第一节 酸及其性质导学案: 这是一份初中化学鲁教版九年级下册第一节 酸及其性质导学案,共3页。学案主要包含了学习目标,学习过程,课堂练习等内容,欢迎下载使用。
初中化学鲁教版九年级下册第四节 酸碱中和反应学案设计: 这是一份初中化学鲁教版九年级下册第四节 酸碱中和反应学案设计,共3页。学案主要包含了课前准备,导入新课,演示实验,问题发现,交流与讨论,问题呈现,归纳小结,实验 1等内容,欢迎下载使用。
化学鲁教版第七单元 常见的酸和碱第二节 碱及其性质学案设计: 这是一份化学鲁教版第七单元 常见的酸和碱第二节 碱及其性质学案设计,共3页。学案主要包含了学习目标,学习过程,课堂展评等内容,欢迎下载使用。













