预测卷04-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
展开预测卷04
(满分:58分 建议用时:40分钟)
8.(湖南省郴州市2023届高三下学期2月模拟)工业上铬铁矿主要成分为亚铬酸亚铁[Fe(CrO2)2],还含少量MgCO3、Al2O3、SiO2等杂质。以铬铁矿为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如图:
已知:a.+3价Cr在酸性溶液中性质稳定,当pH>9时,以CrO2-形式存在且易被氧化。b.常温下,氢氧化铁的Ksp=4.0×10-38、氢氧化镁的Ksp=1.8×10-11、氢氧化铝的Ksp=3.2×10-34。
(1)为了提高酸浸速率和反应充分,可以采取的措施有_________________(填两条)。
(2)滤渣2的主要成分为__________(写化学式)。
(3)流程中两次使用了H2O2,分别写出两次反应的离子方程式:_____________________________、____________________________________。
(4)产品铬酸钠溶于水后,CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应:_____________________________________________,根据A点数据计算出该转化反应的平衡常数为_________,温度升高,溶液中CrO42-的平衡转化率减小,则该反应的△H_____(填“>”“<”或“=”)0。
【解析】工业上铬铁矿主要成分为亚铬酸亚铁[Fe(CrO2)2],还含少量MgCO3、Al2O3、SiO2等杂质,先用稀硫酸酸浸并调节pH=1,Fe(CrO2)2、MgCO3、Al2O3能够和硫酸反应转化为Mg2+、Al3+、Fe2+和Cr3+,SiO2不和硫酸反应经过滤存在于滤渣1中,滤液1中加入H2O2将Fe2+氧化为Fe3+,再加入NaOH调节pH为4.7使Fe3+和Al3+转化为氢氧化铁和氢氧化铝沉淀除去,滤渣2为Fe(OH)3、Al(OH)3,过滤后再加入NaOH调节pH>11使Mg2+转化为氢氧化镁除去,得到的滤液中加入H2O2将CrO2-氧化为CrO42-,得到Na2CrO4溶液,以此解答。(1)增大浸出率的方法:将铬铁矿粉碎、充分搅拌、适当提高温度等。(2)由分析可知,滤渣2的主要成分为Fe(OH)3、Al(OH)3。(3)由分析可知,流程中第一次使用H2O2的作用是将Fe2+氧化为Fe3+,离子方程式为:2Fe2++H2O2+2H+2Fe3++2H2O,第二次使用H2O2的作用是将CrO2-氧化为CrO42-,离子方程式为:2OH-+3H2O2+2CrO2-2CrO42-+4H2O。(4)从图像看出,铬酸根离子在酸性条件下逐渐转化成重铬酸根离子,离子方程式为:2CrO42-+2H+Cr2O72-+H2O;从图像看出,酸性越强,c(Cr2O72-)越大,说明CrO42-的平衡转化率越大,A点对应的离子浓度:c(Cr2O72-)=0.25mol·L-1,c(H+)=1.0×10-7mol·L-1,c(CrO42-)=1.0mol·L-1-0.25mol·L-1×2=0.5mol·L-1,平衡常数K===1.0×1014;升高温度,CrO42-的平衡转化率减小,说明平衡向左移动,根据平衡移动原理,正反应是放热反应,ΔH<0。
【答案】(1)将铬铁矿粉碎、充分搅拌、适当提高温度等(2)Fe(OH)3、Al(OH)3
(3)2Fe2++H2O2+2H+2Fe3++2H2O、2OH-+3H2O2+2CrO2-2CrO42-+4H2O
(4)2CrO42-+2H+Cr2O72-+H2O;1.0×1014;<
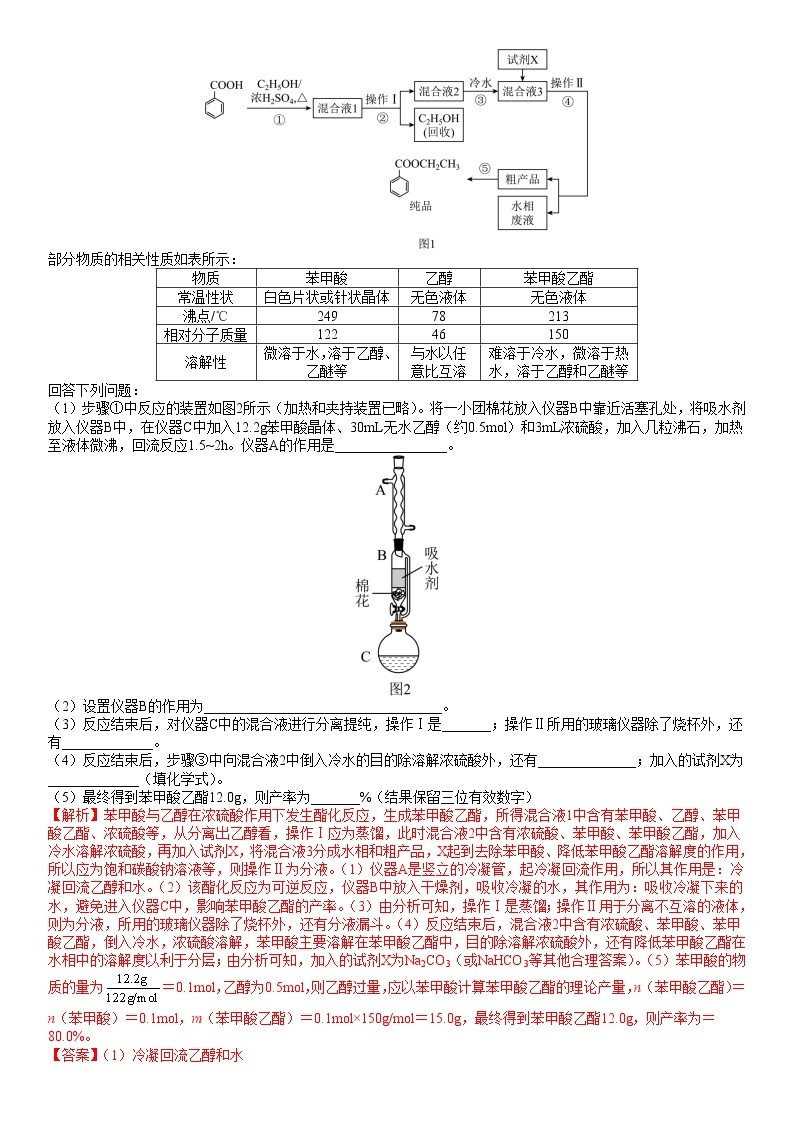
9.(2022~2023学年甘肃省张掖市高三上学期第一次诊断)苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备苯甲酸乙酯的流程如图1所示:
部分物质的相关性质如表所示:
物质
苯甲酸
乙醇
苯甲酸乙酯
常温性状
白色片状或针状晶体
无色液体
无色液体
沸点/℃
249
78
213
相对分子质量
122
46
150
溶解性
微溶于水,溶于乙醇、乙醚等
与水以任意比互溶
难溶于冷水,微溶于热水,溶于乙醇和乙醚等
回答下列问题:
(1)步骤①中反应的装置如图2所示(加热和夹持装置已略)。将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂放入仪器B中,在仪器C中加入12.2g苯甲酸晶体、30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入几粒沸石,加热至液体微沸,回流反应1.5~2h。仪器A的作用是________________。
(2)设置仪器B的作用为__________________________________。
(3)反应结束后,对仪器C中的混合液进行分离提纯,操作Ⅰ是_______;操作Ⅱ所用的玻璃仪器除了烧杯外,还有_____________。
(4)反应结束后,步骤③中向混合液2中倒入冷水的目的除溶解浓硫酸外,还有______________;加入的试剂X为_____________(填化学式)。
(5)最终得到苯甲酸乙酯12.0g,则产率为_______%(结果保留三位有效数字)
【解析】苯甲酸与乙醇在浓硫酸作用下发生酯化反应,生成苯甲酸乙酯,所得混合液1中含有苯甲酸、乙醇、苯甲酸乙酯、浓硫酸等,从分离出乙醇看,操作Ⅰ应为蒸馏,此时混合液2中含有浓硫酸、苯甲酸、苯甲酸乙酯,加入冷水溶解浓硫酸,再加入试剂X,将混合液3分成水相和粗产品,X起到去除苯甲酸、降低苯甲酸乙酯溶解度的作用,所以应为饱和碳酸钠溶液等,则操作Ⅱ为分液。(1)仪器A是竖立的冷凝管,起冷凝回流作用,所以其作用是:冷凝回流乙醇和水。(2)该酯化反应为可逆反应,仪器B中放入干燥剂,吸收冷凝的水,其作用为:吸收冷凝下来的水,避免进入仪器C中,影响苯甲酸乙酯的产率。(3)由分析可知,操作Ⅰ是蒸馏;操作Ⅱ用于分离不互溶的液体,则为分液,所用的玻璃仪器除了烧杯外,还有分液漏斗。(4)反应结束后,混合液2中含有浓硫酸、苯甲酸、苯甲酸乙酯,倒入冷水,浓硫酸溶解,苯甲酸主要溶解在苯甲酸乙酯中,目的除溶解浓硫酸外,还有降低苯甲酸乙酯在水相中的溶解度以利于分层;由分析可知,加入的试剂X为Na2CO3(或NaHCO3等其他合理答案)。(5)苯甲酸的物质的量为=0.1mol,乙醇为0.5mol,则乙醇过量,应以苯甲酸计算苯甲酸乙酯的理论产量,n(苯甲酸乙酯)=n(苯甲酸)=0.1mol,m(苯甲酸乙酯)=0.1mol×150g/mol=15.0g,最终得到苯甲酸乙酯12.0g,则产率为=80.0%。
【答案】(1)冷凝回流乙醇和水
(2)吸收冷凝下来的水,避免进入仪器C中,影响苯甲酸乙酯的产率
(3)蒸馏;分液漏斗
(4)降低苯甲酸乙酯在水相中的溶解度以利于分层;Na2CO3(或NaHCO3等其他合理答案)
(5)80.0
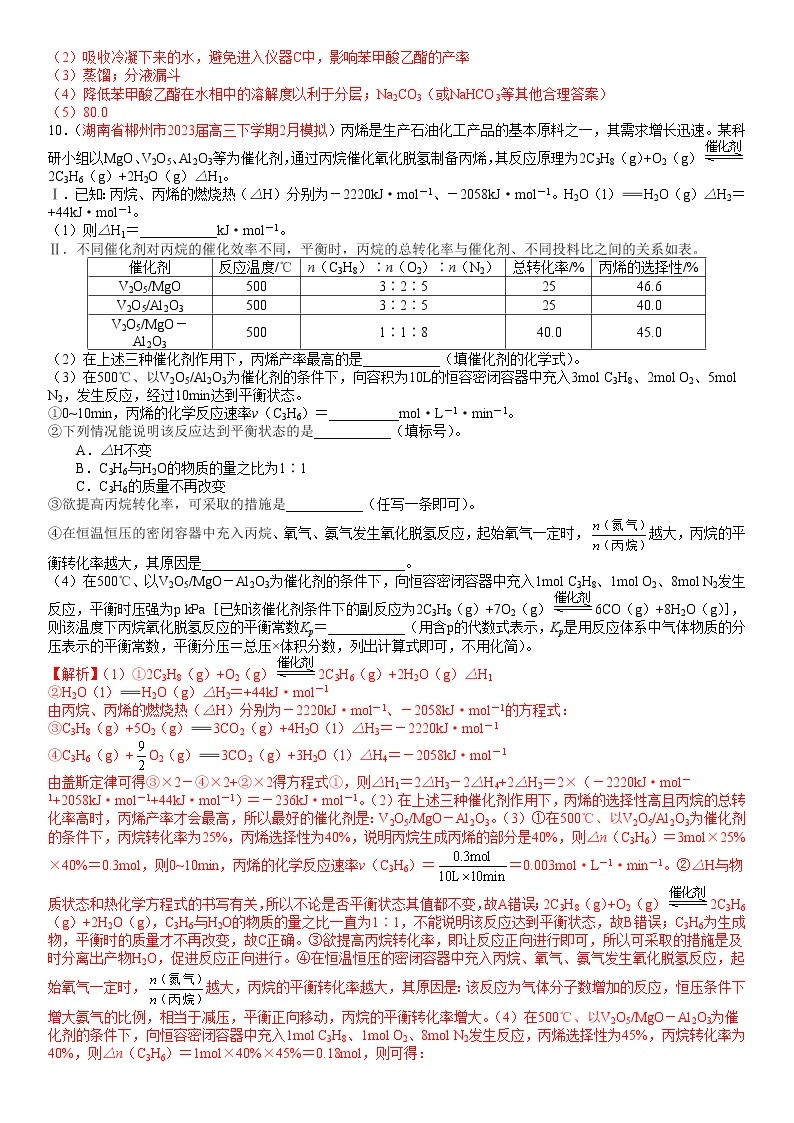
10.(湖南省郴州市2023届高三下学期2月模拟)丙烯是生产石油化工产品的基本原料之一,其需求增长迅速。某科研小组以MgO、V2O5、Al2O3等为催化剂,通过丙烷催化氧化脱氢制备丙烯,其反应原理为2C3H8(g)+O2(g)2C3H6(g)+2H2O(g)△H1。
Ⅰ.已知:丙烷、丙烯的燃烧热(△H)分别为-2220kJ·mol-1、-2058kJ·mol-1。H2O(l)H2O(g)△H2=+44kJ·mol-1。
(1)则△H1=___________kJ·mol-1。
Ⅱ.不同催化剂对丙烷的催化效率不同,平衡时,丙烷的总转化率与催化剂、不同投料比之间的关系如表。
催化剂
反应温度/℃
n(C3H8)∶n(O2)∶n(N2)
总转化率/%
丙烯的选择性/%
V2O5/MgO
500
3∶2∶5
25
46.6
V2O5/Al2O3
500
3∶2∶5
25
40.0
V2O5/MgO-Al2O3
500
1∶1∶8
40.0
45.0
(2)在上述三种催化剂作用下,丙烯产率最高的是___________(填催化剂的化学式)。
(3)在500℃、以V2O5/Al2O3为催化剂的条件下,向容积为10L的恒容密闭容器中充入3mol C3H8、2mol O2、5mol N2,发生反应,经过10min达到平衡状态。
①0~10min,丙烯的化学反应速率v(C3H6)=__________mol·L-1·min-1。
②下列情况能说明该反应达到平衡状态的是___________(填标号)。
A.△H不变
B.C3H6与H2O的物质的量之比为1∶1
C.C3H6的质量不再改变
③欲提高丙烷转化率,可采取的措施是___________(任写一条即可)。
④在恒温恒压的密闭容器中充入丙烷、氧气、氨气发生氧化脱氢反应,起始氧气一定时,越大,丙烷的平衡转化率越大,其原因是_____________________________。
(4)在500℃、以V2O5/MgO-Al2O3为催化剂的条件下,向恒容密闭容器中充入1mol C3H8、1mol O2、8mol N2发生反应,平衡时压强为p kPa[已知该催化剂条件下的副反应为2C3H8(g)+7O2(g)6CO(g)+8H2O(g)],则该温度下丙烷氧化脱氢反应的平衡常数Kp=___________(用含p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×体积分数,列出计算式即可,不用化简)。
【解析】(1)①2C3H8(g)+O2(g)2C3H6(g)+2H2O(g)△H1
②H2O(l)H2O(g)△H2=+44kJ·mol-1
由丙烷、丙烯的燃烧热(△H)分别为-2220kJ·mol-1、-2058kJ·mol-1的方程式:
③C3H8(g)+5O2(g)3CO2(g)+4H2O(l)△H3=-2220kJ·mol-1
④C3H6(g)+O2(g)3CO2(g)+3H2O(l)△H4=-2058kJ·mol-1
由盖斯定律可得③×2-④×2+②×2得方程式①,则△H1=2△H3-2△H4+2△H2=2×(-2220kJ·mol-1+2058kJ·mol-1+44kJ·mol-1)=-236kJ·mol-1。(2)在上述三种催化剂作用下,丙烯的选择性高且丙烷的总转化率高时,丙烯产率才会最高,所以最好的催化剂是:V2O5/MgO-Al2O3。(3)①在500℃、以V2O5/Al2O3为催化剂的条件下,丙烷转化率为25%,丙烯选择性为40%,说明丙烷生成丙烯的部分是40%,则△n(C3H6)=3mol×25%×40%=0.3mol,则0~10min,丙烯的化学反应速率v(C3H6)==0.003mol·L-1·min-1。②△H与物质状态和热化学方程式的书写有关,所以不论是否平衡状态其值都不变,故A错误;2C3H8(g)+O2(g)2C3H6(g)+2H2O(g),C3H6与H2O的物质的量之比一直为1∶1,不能说明该反应达到平衡状态,故B错误;C3H6为生成物,平衡时的质量才不再改变,故C正确。③欲提高丙烷转化率,即让反应正向进行即可,所以可采取的措施是及时分离出产物H2O,促进反应正向进行。④在恒温恒压的密闭容器中充入丙烷、氧气、氨气发生氧化脱氢反应,起始氧气一定时,越大,丙烷的平衡转化率越大,其原因是:该反应为气体分子数增加的反应,恒压条件下增大氨气的比例,相当于减压,平衡正向移动,丙烷的平衡转化率增大。(4)在500℃、以V2O5/MgO-Al2O3为催化剂的条件下,向恒容密闭容器中充入1mol C3H8、1mol O2、8mol N2发生反应,丙烯选择性为45%,丙烷转化率为40%,则△n(C3H6)=1mol×40%×45%=0.18mol,则可得:
2C3H8(g)
+
O2(g)
2C3H6(g)
+
2H2O(g)
起始mol
1
1
0
0
变化mol
0.18
0.09
0.18
0.18
平衡mol
0.82
0.91
0.18
0.18
副反应
2C3H8(g)
+
7O2(g)
6CO(g)
+
8H2O(g)
起始mol
0.82
0.91
0
0.18
变化mol
0.4-0.18
0.77
0.66
0.88
平衡mol
0.6
0.17
0.66
1.06
故平衡时:n(C3H8)=0.6mol,n(C3H6)=0.18mol,n(CO)=0.66mol,n(O2)=0.14mol,n(H2O)=1.06mol,n(N2)=8mol,则n总=10.64mol;平衡时压强为p kPa,平衡分压=总压×体积分数,则p(C3H8)=p kPa,p(C3H6)=p kPa,p(O2)=p kPa,p(H2O)=p kPa,则该温度下丙烷氧化脱氢反应的平衡常数:Kp==。
【答案】(1)-236(2)V2O5/MgO-Al2O3
(3)①0.003②C③及时分离出H2O④该反应为气体分子数增加的反应,恒压条件下增大氨气的比例,相当于减压,平衡正向移动,丙烷的平衡转化率增大
(4)
【化学-选修3:物质结构与性质】
11.(天津市河西区2022~2023学年高三2月模拟)请回答下列问题:
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①按照核外电子排布,可把元素周期表划分为5个区,Co在元素周期表中属于_______区。
②下列状态的钴中,电离最外层一个电子所需能量最大的是_______(填标号)
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(2)[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。
①该配合物的一种配体是NH3,NH3的空间结构呈_______形,是_______(填“极性”或“非极性)分子。
②Co3+的价层电子轨道表示式是_______。该配合物中Co3+参与杂化的6个能量相近的空轨道分别是2个3d轨道、1个4s轨道和3个_______轨道。
③设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取2.505g该配合物,先加水溶解,再加足量AgNO3溶液,_________________(补全实验操作和数据)。相对分子质量[Co(NH3)5Cl]Cl2:250.5;AgCl:143.5。
(3)第VA族元素及其化合物的结构和性质如下:
①N基态原子核外电子排布式为___________。
②NH3、PH3、AsH3的沸点由高到低的顺序为___________(填化学式,下同),键角由大到小的顺序为___________。
③某一种氮化硼晶体的立方晶胞结构如下图:
氮化硼(BN)属于_______晶体。该种氮化硼(BN)的熔点_______SiC。(填>、<、=)
【解析】(1)①Co元素位于第四周期第Ⅷ族,根据元素周期表的分区在d区;②基态Co原子的电子排布为[Ar]3d74s2,[Ar]3d74s14p1和[Ar]3d74p1状态的Co电子能量均高于基态原子的,故电离最外层的1个电子所需的能量也小于基态Co的第一电离能I1,而[Ar]3d74s1状态的Co,其4s轨道为半满结构,能量更低,所需电离能也更大,选A;(2)①NH3的中心原子N为sp3杂化,NH3分子构型为三角锥形,其正负电荷中心不重叠,为极性分子;②基态Co的价电子排布为3d74s2,失去3个电子后有3d能级的轨道有6个电子,价电子电子排布图为。4p能级有3个轨道,参与杂化形成sp3d2杂化轨道;③2.505g该配合物的物质的量为n{[Co(NH3)5Cl]Cl2}==0.01mol,配合物溶于水只有离子键断裂,则溶液中氯离子的物质的量为0.02mol,加入硝酸银生成的氯化银沉淀为0.02mol,氯化银的质量为m(AgCl)=0.02mol×143.5g/mol=2.87g,故后续操作与数据为过滤沉淀,称重,沉淀质量为2.87g;(3)①N为第二周期第ⅤA族元素,电子排布式为1s22s22p3;②三者均为分子晶体,熔沸点高低主要由范德华力影响,相对分子质量越大,范德华力越大,熔沸点越高,而NH3分子之间会生成氢键,沸点高于PH3和AsH3,故沸点大小为NH3>AsH3>PH3。三种化合物中心原子均为sp3杂化,分子为三角锥性,且中心原子电负性N>P>As,电负性越大,成键电子对偏向中心原子,电子对之间的排斥力越大,键角越大,故键角大小为:NH3>PH3>AsH3;③BN晶体与SiC晶体均为为共价晶体,共价晶体熔沸点由共价键键能决定,键长越短键能越大,B、C、N均为第二周期的元素,其原子半径小于位于第三周期的Si原子,故B—N键键长小于Si—C键键长,则BN晶体熔点高于SiC熔点。
【答案】(1)①d②A
(2)①三角锥;极性②; 4p③过滤,沉淀称重2.87g
(3)①1s22s22p3②NH3、AsH3、PH3;NH3、PH3、AsH3③共价;>
【化学-选修5:有机化学基础】
12.(湖北省高中名校2023届高三下学期第三次联合测评)以下为某药物K的合成路线:
回答下列问题:
(1)已知B分子苯环上的一氯代物只有2种,则B的结构简式为____________。
(2)D中官能团的名称为_______。
(3)G→H的方程式为________________________________。
(4)H→I的反应条件为_______。
(5)E+J→K的另一产物为____________。
(6)符合下列条件的E的同分异构体有_______种,其中一种同分异构体的结构简式为____________。①能发生银镜反应;②与FeCl3溶液不发生显色反应,但水解产物之一能发生;③核磁共振氢谱有四组峰,峰面积之比为6∶2∶1∶1。
【解析】(1)已知B分子苯环上的一氯代物只有2种,则B的结构简式为HO-OCH3;(2)D是,该物质分子中含有的官能团名称是(酚)羟基、羧基、醚键;(3)G是,G分子中含有羧基,G与CH3OH在浓硫酸催化下加热,发生酯化反应产生H:和H2O,该反应的化学方程式为:+CH3OH+H2O;(4)H结构简式是;H在光照条件下与Br2发生-CH3的取代反应产生I,故H→I的反应条件是光照;(5)E与J发生取代反应产生K,同时反应产生HBr,故另外一种产物化学式是HBr;(6)E的同分异构体满足条件:①能发生银镜反应,说明分子中含有醛基-CHO;②与FeCl3溶液不发生显色反应,但水解产物之一能发生是,该同分异构体不含酚羟基,但其能够发生水解反应产生含有酚羟基的物质;③核磁共振氢谱有四组峰,峰面积之比为6∶2∶1∶1,则该物质分子中含有4种不同位置的H原子,H原子的数目比是6∶2∶1∶1,其分子结构对称,含有加水与酚羟基形成的酯基,可能的结构为:或,因此该物质具有2种不同的结构。
【答案】(1)HO-OCH3(2)(酚)羟基、羧基、醚键
(3)+CH3OH+H2O
(4)光照(5)HBr(6)2;或
预测卷04-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用): 这是一份预测卷04-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用),文件包含预测卷04原卷版docx、预测卷04解析版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
预测卷04-【大题精做】冲刺2023年高考化学大题突破+限时集训(浙江专用): 这是一份预测卷04-【大题精做】冲刺2023年高考化学大题突破+限时集训(浙江专用),文件包含预测卷04解析版docx、预测卷04原卷版docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
预测卷04-【大题精做】冲刺2023年高考化学大题突破+限时集训(浙江专用): 这是一份预测卷04-【大题精做】冲刺2023年高考化学大题突破+限时集训(浙江专用),文件包含预测卷04解析版docx、预测卷04原卷版docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。