

初中化学沪教版九年级下册第3节 物质的溶解性同步测试题
展开(进阶篇)2021-2022学年下学期初中化学沪教版九年级同步分层作业6.3物质的溶解性
一.多选题(共1小题)
(多选)1.将某物质溶液蒸发50克水后,温度降到t℃,析出晶体8克,再蒸发50克水,温度降到t℃又析出晶体10克,那么原溶液欲变成t℃饱和溶液,至少应( )
A.蒸发10克水 B.加入2克溶质
C.蒸发15克水 D.加入8克溶质
二.填空题(共6小题)
2.化学中有许多概念是相对的,又是统一的。右图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系。
(1)从图可以看出,饱和溶液与浓溶液、稀溶液的关系是 。
(2)0.9%的医用生理盐水可归于图中 区域(选填“Ⅰ”、“Ⅱ”、“Ⅲ”或“Ⅳ”);现有一瓶接近饱和的NaCl溶液,若要使它变为饱和溶液,一般采用的方法是 或 。
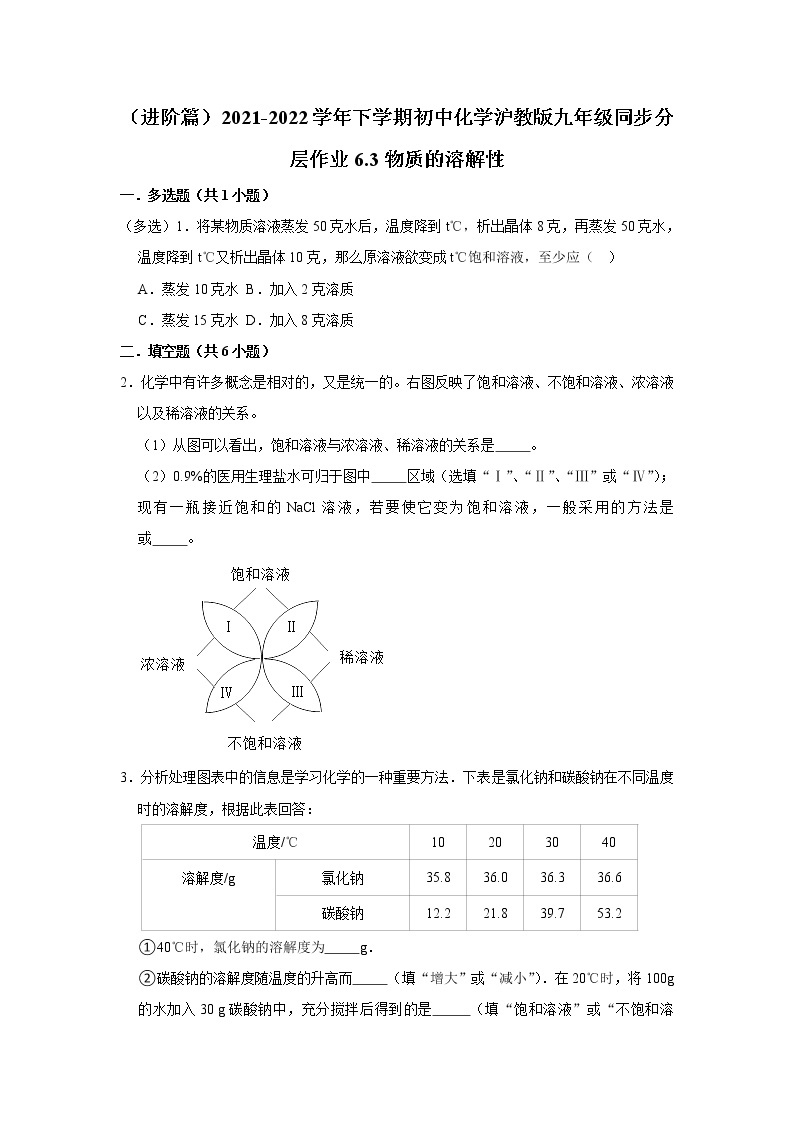
3.分析处理图表中的信息是学习化学的一种重要方法.下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃
10
20
30
40
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
碳酸钠
12.2
21.8
39.7
53.2
①40℃时,氯化钠的溶解度为 g.
②碳酸钠的溶解度随温度的升高而 (填“增大”或“减小”).在20℃时,将100g的水加入30 g碳酸钠中,充分搅拌后得到的是 (填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为 (计算结果精确到0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的溶液是 .
④你认为以上两种溶液适合用蒸发结晶的是 ,适合用降温结晶的是 .
4.请根据图中a、b、c 三种物质的溶解度曲线,回答下列问题。
(1)三种物质中,溶解度随温度的升高而减小的是 。
(2)P 点的含义是 。
(3)t2℃时,28g 物质 a 加入到 50g 水中,充分溶解后得到物质a的 (填“饱和”或“不饱和”)溶液,此时溶液中溶质的质量是 克。
(4)将 t2℃时的 a、b、c 三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数最小的是 。
5.右图是A、B、C三种物质的溶解度曲线,根据右图回答下列问题:
(1)在t1℃时,A、B、C三种物质溶解度的大小关系是 .
(2)在t2℃时,分别配制等质量A、C两种物质的饱和溶液,需要用水的质量A C(填“大于”或“小于”或“等于”).
(3)t4℃时,将100克A物质的饱和溶液恒温蒸发10克水,会有 克A物质析出.
(4)A物质中混有少量B物质,分离该混合物的方法为: .
6.将30g甲、乙两种物质在t2℃时分别放入100g水中,充分溶解如图所示。试回答:
(1)A试管中放的物质是 (填甲或乙),此时另一支试管中的溶液是 (填饱和或不饱和),该溶液中溶质质量分数是 (保留1位小数),若将温度降至t1℃时,试管B中的现象是 。
(2)在t2℃时,若要让试管A中的固体全部溶解,可向烧杯的水中加入 (填序号)
①硝酸铵 ②氢氧化钠 ③氯化钠。
7.根据溶解度受温度影响的信息和溶解度曲线回答下列问题:
已知硝酸钾的溶解度受温度影响比较大,食盐的溶解度受温度影响较小,熟石灰的溶解度随温度升高而减少。
(1)A是 的溶解度曲线。
(2)50℃时,硝酸钾的溶解度 (大于、小于或等于)氯化钠的溶解度。
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是 。
(4)欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是 。
(5)如图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是 (填序号)。
A.反应放热,温度升高,氢氧化钙溶解度降低
B.反应消耗水,氢氧化钙析出
C.生石灰与水反应生成的氢氧化钙不再溶解。
三.实验探究题(共1小题)
8.溶解是生活中常见的现象,不同物质在水中的溶解能力不同.
(1)表是硝酸钾、氯化钠在不同温度下的溶解度(单位:g).
温度(℃)
0
20
40
60
80
100
硝酸钾
13.3
31.6
63.9
110
169
246
氯化钠
35.7
36.0
36.6
37.3
38.4
39.8
①查表,60℃时氯化钠的溶解度为 克.
②若要从硝酸钾和氯化钠的混合溶液中提取硝酸钾,应采用的方法是 (选填“蒸发溶剂”或“冷却热饱和溶液”).
(2)用硝酸钾固体进行了如下实验:
所得三杯溶液中:一定属于饱和溶液的是 (用字母表示)溶液,A溶液和C溶液溶质质量分数的关系是 .(选填“A>C”、“A<C”或“A=C”)
四.解答题(共3小题)
9.如图是A、B、C三种物质的溶解度曲线,根据如图回答问题:
(1)在 ℃时,分别配制A、B两种物质的等质量的饱和溶液,需要用水的质量相等;
(2)A中含少量C时可用 法进行提纯A;
(3)若将C由不饱和溶液变成饱和溶液的方法有增加溶质、恒温蒸发溶剂和 .
(4)t4℃时将A、B、C三种物质的饱和溶液降至t3℃时,所得溶液的质量分数由大到小的顺序是 .
10.如图1为KCl和KNO3的溶解度表及溶解度曲线图。
温度/℃
20
30
40
50
溶解度/g
KCl
34.0
37.0
40.0
42.6
KNO3
31.6
45.8
63.9
85.5
(1)由表中数据分析可知,t1最小的温度范围是 。
(2)40℃时配制硝酸钾和氯化钾溶质质量分数相同的溶液,则溶液溶质质量分数的最大值是 (只列出表达式)。
(3)50℃时,将mg的硝酸钾溶液进行如图2所示的操作。B溶液是 (填“饱和”或“不饱和”)溶液:A中的m= 。
11.a,b两物质的溶解度曲线如图1所示,请根据图回答:
(1)c点配制的a物质溶液降温到0℃时溶液变为 (填“饱和溶液”,“不饱和溶液”).
(2)取30℃时配制的a,b两物质的饱和溶液降温至20℃时,a溶液质量分数 b溶液的质量分数(填“=”,“>”,“<”).
(3)如图2所示,现有20℃时等质量的a、b两物质的饱和溶液,试管底部有等质量的a,b剩余,向烧杯的水中加入氢氧化钠固体,则对相关变化判断正确的 (不考虑溶剂的蒸发,析出的固体不含水)
A、a溶液中溶质质量增多,b溶液中溶质质量减少 B、试管底部a固体的质量大于b固体的质量
C、a溶液中溶剂质量小于b溶液中溶剂质量 D、试管底部a固体的质量小于b固体的质量.
(进阶篇)2021-2022学年下学期初中化学沪教版九年级同步分层作业6.3物质的溶解性
参考答案与试题解析
一.多选题(共1小题)
(多选)1.将某物质溶液蒸发50克水后,温度降到t℃,析出晶体8克,再蒸发50克水,温度降到t℃又析出晶体10克,那么原溶液欲变成t℃饱和溶液,至少应( )
A.蒸发10克水 B.加入2克溶质
C.蒸发15克水 D.加入8克溶质
【分析】开始蒸发水析出晶体不能说明原来溶液是否饱和,析出晶体8克,再蒸发50克水,属于饱和溶液的蒸发,析出晶体10克,说明50克水中最多溶解了10g溶质,再根据第一次蒸发析出晶体的质量分析出还缺少的溶质的质量,或者多余的水的质量.
【解答】解:析出晶体8克,再蒸发50克水,属于饱和溶液的蒸发,析出晶体10克,说明50克水中最多溶解了10g溶质,根据将某物质溶液蒸发50克水后,温度降到t℃,析出晶体8克,说明原溶液中还缺少2克溶质,所以再加入2克溶质,还能说明原溶液中多了溶解2克溶质的溶剂,由50克水中最多溶解了10g溶质,可推出10克水中能溶解2克溶质,所以蒸发10克水也能达到饱和。
故选:AB。
【点评】解答本题关键是要根据饱和溶液的蒸发,计算出50克水中溶解溶质的质量,再与原溶液蒸发析出晶体的比较分析出缺少溶质质量和多余溶剂的质量.
二.填空题(共6小题)
2.化学中有许多概念是相对的,又是统一的。右图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系。
(1)从图可以看出,饱和溶液与浓溶液、稀溶液的关系是 饱和溶液不一定是浓溶液,稀溶液不一定是不饱和溶液 。
(2)0.9%的医用生理盐水可归于图中 Ⅲ 区域(选填“Ⅰ”、“Ⅱ”、“Ⅲ”或“Ⅳ”);现有一瓶接近饱和的NaCl溶液,若要使它变为饱和溶液,一般采用的方法是 加氯化钠 或 蒸发水分 。
【分析】(1)解读图示信息,找出图中所述概念间的关系;
(2)根据溶液的特点,分析溶液与图示概念关系的关系;并根据物质的溶解性说明把不饱和溶液变为饱和溶液的方法。
【解答】解:(1)图中II区既是饱和溶液也是稀溶液,说明有些饱和溶液是稀溶液,或者说有些稀溶液已经达到饱和状态;
图中I区既是饱和溶液也是浓溶液,说明有些饱和溶液是浓溶液,或者说有些浓溶液达到了饱和状态;
综合上述,饱和溶液可能是浓溶液也可能是稀溶液,进一步推断可知,饱和溶液与溶液的浓稀没有必然的关系。
故答:饱和溶液不一定是浓溶液,稀溶液不一定是不饱和溶液;(其他说法合理就行)
(2)根据食盐的溶解度,0.9%的医用生理盐水应为不饱和的稀溶液,所以属于图中的III区;
氯化钠的溶解度随温度升高而增大,所以要把接近饱和的NaCl溶液变成饱和溶液可采取增加氯化钠、蒸发水分或降低温度的方法。
故答:III,加氯化钠,蒸发水分。
【点评】溶液的状态(饱和、不饱和)与溶液的浓稀(溶液中溶质含量的大小)之间没有必然的关系,若是在同一温度下同一种溶质溶解在同一溶剂中,则有饱和溶液的浓度一定大于不饱和溶液的结论。注意区分。
3.分析处理图表中的信息是学习化学的一种重要方法.下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃
10
20
30
40
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
碳酸钠
12.2
21.8
39.7
53.2
①40℃时,氯化钠的溶解度为 36.6 g.
②碳酸钠的溶解度随温度的升高而 增大 (填“增大”或“减小”).在20℃时,将100g的水加入30 g碳酸钠中,充分搅拌后得到的是 饱和溶液 (填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为 23.1% (计算结果精确到0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的溶液是 碳酸钠饱和溶液 .
④你认为以上两种溶液适合用蒸发结晶的是 氯化钠溶液 ,适合用降温结晶的是 碳酸钠溶液 .
【分析】①由氯化钠和碳酸钠在不同温度时的溶解度表,查出40℃时氯化钠的溶解度即可;
②由碳酸钠在不同温度时的溶解度表,确定碳酸钠的溶解度受温度影响的变化趋势即可.20℃时,碳酸钠的溶解度为21.8g,进行分析解答;
③根据溶解度的大小分析判断
④根据溶解度随温度变化的情况分析.
【解答】解:(1)40℃时,氯化钠的溶解度为36.6g.
(2)由碳酸钠在不同温度时的溶解度表,碳酸钠的溶解度随温度的升高而增大.20℃时,碳酸钠的溶解度为21.8g,在20℃时,将30g碳酸钠加入到100g水中,充分搅拌后,最多只能溶解21.8g,得到的是饱和溶液;由表格知,30℃碳酸钠的溶解度为39.7g,将上述溶液升温到30℃,将100g的水加入30g碳酸钠中,充分搅拌后得到的是不饱和溶液,碳酸钠完全溶解,该溶液的溶质质量分数=×100%=23.1%.
③10℃时,分别配制表中两种物质的饱和溶液,由于碳酸钠的溶解度较小,所以其中溶质质量分数较小的溶液是碳酸钠饱和溶液.
④由于氯化钠的溶解度受温度的影响不大,碳酸钠的溶解度受温度的影响加大,所以以上两种溶液适合用蒸发结晶的是 氯化钠溶液,适合用降温结晶的是碳酸钠溶液.
故答案为:①36.6;②增大;饱和溶液,23.1%; ③碳酸钠饱和溶液; ④氯化钠溶液 碳酸钠溶液.
【点评】本题题难度不大,掌握溶解度受温度影响的变化趋势、溶解度的含义、溶液中溶质质量分数=×100%是正确解答本题的关键.
4.请根据图中a、b、c 三种物质的溶解度曲线,回答下列问题。
(1)三种物质中,溶解度随温度的升高而减小的是 c 。
(2)P 点的含义是 t1℃时,a、c物质的溶解度相等,均为20g 。
(3)t2℃时,28g 物质 a 加入到 50g 水中,充分溶解后得到物质a的 饱和 (填“饱和”或“不饱和”)溶液,此时溶液中溶质的质量是 25 克。
(4)将 t2℃时的 a、b、c 三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数最小的是 c 。
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:(1)通过分析溶解度曲线可知,三种物质中,溶解度随温度的升高而减小的是c;
(2)P 点的含义是t1℃时,a、c物质的溶解度相等,均为20g;
(3)t2℃时,a物质的溶解度是50g,所以28g物质a加入到50g水中,充分溶解后得到物质a的饱和溶液,此时溶液中溶质的质量是25克;
(4)将 t2℃时的 a、b、c 三种物质的饱和溶液降温到t1℃时,a、b物质的溶解度最大,c物质的溶解度减小,应该按照t2℃时是溶解度计算,所以所得溶液中溶质质量分数最小的是c。
故答案为:(1)c;
(2)t1℃时,a、c物质的溶解度相等,均为20g;
(3)饱和,25;
(4)c。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
5.右图是A、B、C三种物质的溶解度曲线,根据右图回答下列问题:
(1)在t1℃时,A、B、C三种物质溶解度的大小关系是 C>A=B .
(2)在t2℃时,分别配制等质量A、C两种物质的饱和溶液,需要用水的质量A 等于 C(填“大于”或“小于”或“等于”).
(3)t4℃时,将100克A物质的饱和溶液恒温蒸发10克水,会有 8 克A物质析出.
(4)A物质中混有少量B物质,分离该混合物的方法为: 降温结晶 .
【分析】根据固体物质的溶解度曲线可以:①查出某物质在一定温度时的溶解度大小,从而可以确定一定量的溶剂中最多溶解的溶质的质量,②比较不同物质在同一温度时的溶解度大小,从而可以比较其饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而可以判断分离混合物的方法等.
【解答】解:(1)根据A、B、C三种物质的溶解度曲线不难看出,在t1℃时,三种物质的溶解度大小关系为C>A=B,故答案为:C>A=B
(2)由于在t2℃时,A和C的溶解度相等,即它们的饱和溶液中溶质的质量分数相同,则若配制等质量的两种物质的饱和溶液,则需溶质、溶剂的质量都相等,故答案为:等于
(3)由于在t4℃时,A的溶解度是80g,即100g水中最多溶解80gA,则10g水中最多溶解8gA,因此将100克A物质的饱和溶液恒温蒸发10克水,会析出8g晶体析出,故答案为:8
(4)由于A的溶解度随温度的升高而明显增大,而B的溶解度受温度的影响不大,因此可以采用降温结晶的方法来提纯混有少量B物质的A物质,故答案为:降温结晶
【点评】本题难度不是很大,主要考查了固体溶解度曲线的意义及对固体溶解度概念的理解,从而培养学生分析问题、解决问题的能力.
6.将30g甲、乙两种物质在t2℃时分别放入100g水中,充分溶解如图所示。试回答:
(1)A试管中放的物质是 乙 (填甲或乙),此时另一支试管中的溶液是 饱和 (填饱和或不饱和),该溶液中溶质质量分数是 23.1% (保留1位小数),若将温度降至t1℃时,试管B中的现象是 有固体析出 。
(2)在t2℃时,若要让试管A中的固体全部溶解,可向烧杯的水中加入 ② (填序号)
①硝酸铵 ②氢氧化钠 ③氯化钠。
【分析】(1)根据t2℃时AB的溶解度分析;一定温度下,物质的饱和溶液溶质质量分数的计算式×100%,据此分析解答;
(2)乙的溶解度随温度的升高而逐渐增大,固体全部溶解,说明溶液的温度升高,而氢氧化钠固体和氧化钙固体、浓硫酸溶于水均可使溶液的温度升高。
【解答】解:
(1)观察溶解度曲线图可知:t2℃时甲的溶解度是30g,乙的溶解度小于30g,所以把30g 甲乙物质放入100g水中,甲全部溶解正好饱和,乙有固体剩余,t2℃时甲的溶解度是30g,所以甲物质饱和溶液中溶质的质量分数为=23.1%,若将温度降至t1℃时,甲的溶解度随温度的降低而减小,溶解度小于15g,试管 B中的现象是有固体析出;
(2)乙的溶解度随温度的升高而增大,若要让试管A中的固体全部溶解,可以采用升温的方法,而氢氧化钠固体和氧化钙固体、浓硫酸溶于水均可使溶液的温度升高。
答案:
(1)乙 饱和 23.1% 有固体析出
(2)②
【点评】了解溶解度概念的含义、溶解度曲线的意义、饱和溶液中溶质的质量分数的计算方法、物质溶于水时溶液的温度变化,才能结合题意灵活分析解答。
7.根据溶解度受温度影响的信息和溶解度曲线回答下列问题:
已知硝酸钾的溶解度受温度影响比较大,食盐的溶解度受温度影响较小,熟石灰的溶解度随温度升高而减少。
(1)A是 KNO3 的溶解度曲线。
(2)50℃时,硝酸钾的溶解度 等于 (大于、小于或等于)氯化钠的溶解度。
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是 降温结晶 。
(4)欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是 降低温度 。
(5)如图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是 A (填序号)。
A.反应放热,温度升高,氢氧化钙溶解度降低
B.反应消耗水,氢氧化钙析出
C.生石灰与水反应生成的氢氧化钙不再溶解。
【分析】根据固体物质的溶解度曲线可以:①查出某物质在一定温度时的溶解度,②比较不同物质在同一温度下的溶解度的大小,③判断出物质的溶解度随温度变化的变化情况,从而可以确定出分离混合物的方法等;可以确定将不饱和溶液转化为饱和溶液的方法。
【解答】解:(1)由溶解度曲线可知,A的溶解度受温度影响比较大,A是KNO3的溶解度曲线;B的溶解度受温度影响较小,B是食盐的溶解度曲线;C的溶解度的溶解度随温度升高而减少,C是熟石灰的溶解度曲线;
(2)由硝酸钾和氯化钠的溶解度曲线可知,50℃时,硝酸钾与氯化钠的溶解度溶解度曲线交于一点,硝酸钾的溶解度等于氯化钠的溶解度;
(3)由于硝酸钾的溶解度受温度影响比较大,食盐的溶解度受温度影响较小,所以,硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是降温结晶;
(4)由于硝酸钾的溶解度随温度的升高而增大。所以,欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是降低温度(或增加溶质或蒸发溶剂);
(5)由于熟石灰的溶解度随温度升高而减少,向烧杯B中加入生石灰后,烧杯A中变浑浊,说明了生石灰与水反应反应放热,温度升高,氢氧化钙溶解度降低。
故答案为:(1)KNO3;(2)等于;(3)降温结晶;(4)降低温度(或增加溶质或蒸发溶剂)(5)A。
【点评】解题时,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,细致地阅读、分析题意等,联系生活实际,细心地进行探究、推理,最后,按照题目的要求,认真地进行选择或解答即可。
三.实验探究题(共1小题)
8.溶解是生活中常见的现象,不同物质在水中的溶解能力不同.
(1)表是硝酸钾、氯化钠在不同温度下的溶解度(单位:g).
温度(℃)
0
20
40
60
80
100
硝酸钾
13.3
31.6
63.9
110
169
246
氯化钠
35.7
36.0
36.6
37.3
38.4
39.8
①查表,60℃时氯化钠的溶解度为 110 克.
②若要从硝酸钾和氯化钠的混合溶液中提取硝酸钾,应采用的方法是 冷却热饱和溶液 (选填“蒸发溶剂”或“冷却热饱和溶液”).
(2)用硝酸钾固体进行了如下实验:
所得三杯溶液中:一定属于饱和溶液的是 A (用字母表示)溶液,A溶液和C溶液溶质质量分数的关系是 A<C .(选填“A>C”、“A<C”或“A=C”)
【分析】(1)①由60℃时硝酸钾的溶解度为110g,进行分析.
②由于硝酸钾的溶解度随温度的升高而明显增大,而氯化钠的溶解度受温度影响很小,因此提纯混有少量氯化钠的硝酸钾应采用降温结晶的方法即冷却热饱和溶液.
(2)根据饱和溶液的判断方法和溶质质量分数的计算方法考虑.
【解答】解:(1)①由表中数据可知60℃时硝酸钾的溶解度为110g.
②由于硝酸钾的溶解度随温度的升高而明显增大,而氯化钠的溶解度受温度影响很小,因此提纯混有少量氯化钠的硝酸钾应采用降温结晶的方法;
(2)由图示可知A中有不溶物一定是饱和溶液;A溶液和C溶液中溶剂质量相同,但A中溶质没有全部溶解,含有的溶质质量小,所以C溶液溶质质量分数大.
故答案为:(1)①110;②冷却热饱和溶液;(2)A;A<C.
【点评】本题难度不大,掌握理解溶解度的概念、结晶的方法并能灵活运用是正确解答本题的关键.
四.解答题(共3小题)
9.如图是A、B、C三种物质的溶解度曲线,根据如图回答问题:
(1)在 t1 ℃时,分别配制A、B两种物质的等质量的饱和溶液,需要用水的质量相等;
(2)A中含少量C时可用 降温结晶 法进行提纯A;
(3)若将C由不饱和溶液变成饱和溶液的方法有增加溶质、恒温蒸发溶剂和 升高温度 .
(4)t4℃时将A、B、C三种物质的饱和溶液降至t3℃时,所得溶液的质量分数由大到小的顺序是 A、B、C .
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:(1)在t1℃时,A、B两种物质的溶解度相等,所以配制A、B两种物质的等质量的饱和溶液,需要用水的质量相等;
(2)A物质的溶解度受温度影响较大,C物质的溶解度随温度的升高而减小,所以A中含少量C时可用降温结晶法进行提纯A;
(3)C物质的溶解度随温度的升高而减小,所以将C由不饱和溶液变成饱和溶液的方法有增加溶质、恒温蒸发溶剂和升高温度;
(4)t3℃时,A物质的溶解度最大,B物质的溶解度次之,C物质的溶解度随温度的降低而增大,降温不会析出晶体,应该按照t4℃时的溶解度计算,所以t4℃时将A、B、C三种物质的饱和溶液降至t3℃时,所得溶液的质量分数由大到小的顺序是A、B、C.
故答案为:(1)t1;
(2)降温结晶;
(3)升高温度;
(4)A、B、C.
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.
10.如图1为KCl和KNO3的溶解度表及溶解度曲线图。
温度/℃
20
30
40
50
溶解度/g
KCl
34.0
37.0
40.0
42.6
KNO3
31.6
45.8
63.9
85.5
(1)由表中数据分析可知,t1最小的温度范围是 20℃﹣30℃ 。
(2)40℃时配制硝酸钾和氯化钾溶质质量分数相同的溶液,则溶液溶质质量分数的最大值是 (只列出表达式)。
(3)50℃时,将mg的硝酸钾溶液进行如图2所示的操作。B溶液是 不饱和 (填“饱和”或“不饱和”)溶液:A中的m= 203.9 。
【分析】(1)根据溶解度曲线相交时物质溶解度相等的性质回答此题;
(2)根据饱和溶液溶质质量分数=的性质回答此题;
(3)根据饱和C溶液与饱和D溶液溶质质量的关系计算回答此题。
【解答】解:(1)t1℃时,两种物质溶解度曲线相交,说明此时溶解度相等,而在题目给出的实验数据中,在20℃时,氯化钾溶解度大于硝酸钾溶解度,而在30℃时,硝酸钾溶解度大于氯化钾溶解度,因此想要两者相等,则在20℃到30℃之间可以达到这种情况;
故答案为:20℃﹣30℃。
(2)溶液达到饱和时,溶质质量分数最大,在40℃时,氯化钾溶解度小于硝酸钾溶解度,因此两种物质形成溶液后溶质质量分数相等,则说明达到氯化钾饱和溶液时,就达到了最大溶质质量分数,此时溶质质量分数=;
故答案为:。
(3)若B为饱和溶液,则溶解度减少=85.5g﹣63.9g=21.6g,而此时析出质量为20g,小于21.6g,所以B为不饱和溶液;溶液C为饱和溶液,溶液D为饱和溶液,而C到D过程中又析出了固体质量=38.1g﹣20g=18.1g,根据饱和溶液溶质质量分数与溶解度的关系,以及溶质质量守恒,可知C中溶质质量=D中溶质质量+18.1g,
=+18.1g,m=203.9;
故答案为:不饱和;203.9。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
11.a,b两物质的溶解度曲线如图1所示,请根据图回答:
(1)c点配制的a物质溶液降温到0℃时溶液变为 饱和溶液 (填“饱和溶液”,“不饱和溶液”).
(2)取30℃时配制的a,b两物质的饱和溶液降温至20℃时,a溶液质量分数 > b溶液的质量分数(填“=”,“>”,“<”).
(3)如图2所示,现有20℃时等质量的a、b两物质的饱和溶液,试管底部有等质量的a,b剩余,向烧杯的水中加入氢氧化钠固体,则对相关变化判断正确的 AD (不考虑溶剂的蒸发,析出的固体不含水)
A、a溶液中溶质质量增多,b溶液中溶质质量减少 B、试管底部a固体的质量大于b固体的质量
C、a溶液中溶剂质量小于b溶液中溶剂质量 D、试管底部a固体的质量小于b固体的质量.
【分析】(1)比较溶解度曲线中点的位置关系,分析温度改变对溶液的影响;
(2)对比两物质溶解度曲线,分析两种物质的饱和溶液在降温时溶液组成的变化,比较所得溶液溶质质量分数的大小;
(3)结合曲线中两物质溶解度曲线的变化,分析升温后饱和溶液中未溶解溶质的质量变化.
【解答】解:(1)c点位于a溶解度曲线下方,说明c点的溶液为此温度下a物质的不饱和溶液;当温度降至0℃时,a物质的溶解度随温度降低而减小,且0℃的溶解度低于c点,所以,降温至0℃溶液析出少量晶体后变成饱和溶液;
故答案为:饱和溶液;
(2)30℃时的a,b两物质的饱和溶液,降温时,a物质的饱和溶液析出晶体变成20℃的饱和溶液,溶液的溶质质量分数减小,而b物质的饱和溶液降温变成了不饱和溶液,溶液的组成不变,溶液的溶质质量分数不变;又由溶解度曲线图,20℃时a物质的溶解度位于30℃的b物质溶解度上方,因此,降温到20℃时,两溶液的溶质质量分数大小关系为:a>b;
故答案为:>;
(3)向烧杯中加入氢氧化钠,氢氧化钠溶于水放出大量热而使两物质的饱和溶液温度升高,因a物质溶解度随温度升高而减小,所以有固体析出,则试管底部的固体质量增加;而b物质溶解度随温度升高而增大,试管底部b固体减少;
故选AD.
【点评】20℃时两物质的溶解度相等,此时两物质的饱和溶液的溶质的质量分数相等,但由30℃的饱和溶液降温至20℃时,物质b的饱和溶液变成了不饱和溶液,所以,不能再使用上述相等的结论进行判断.
初中化学沪教版九年级下册第3节 物质的溶解性同步测试题: 这是一份初中化学沪教版九年级下册第3节 物质的溶解性同步测试题,共17页。试卷主要包含了如图是甲、乙、两三种固体物质等内容,欢迎下载使用。
2021学年第2节 糖类 油脂精练: 这是一份2021学年第2节 糖类 油脂精练,共10页。试卷主要包含了用简单的实验方法解决下列问题,如图是某品牌补铁剂的标签,如图为速力菲补血剂的说明书等内容,欢迎下载使用。
沪教版九年级下册第7章 应用广泛的酸、碱、盐第3节 几种重要的盐复习练习题: 这是一份沪教版九年级下册第7章 应用广泛的酸、碱、盐第3节 几种重要的盐复习练习题,共24页。试卷主要包含了小明课下在家做了一个趣味实验,某Ca,小金分别向含有Ba等内容,欢迎下载使用。