

高中化学人教版 (2019)必修 第二册第一节 硫及其化合物第1课时导学案
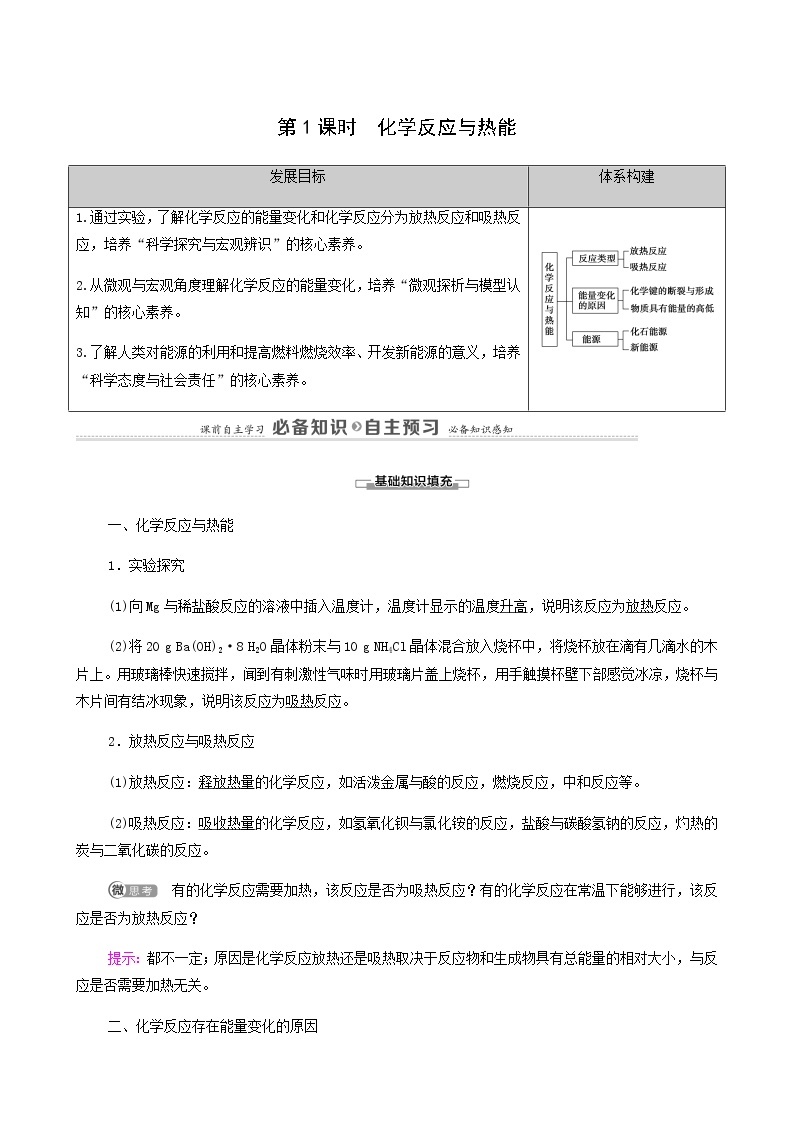
展开第1课时 化学反应与热能
发展目标 | 体系构建 |
1.通过实验,了解化学反应的能量变化和化学反应分为放热反应和吸热反应,培养“科学探究与宏观辨识”的核心素养。 2.从微观与宏观角度理解化学反应的能量变化,培养“微观探析与模型认知”的核心素养。 3.了解人类对能源的利用和提高燃料燃烧效率、开发新能源的意义,培养“科学态度与社会责任”的核心素养。 |
一、化学反应与热能
1.实验探究
(1)向Mg与稀盐酸反应的溶液中插入温度计,温度计显示的温度升高,说明该反应为放热反应。
(2)将20 g Ba(OH)2·8 H2O晶体粉末与10 g NH4Cl晶体混合放入烧杯中,将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到有刺激性气味时用玻璃片盖上烧杯,用手触摸杯壁下部感觉冰凉,烧杯与木片间有结冰现象,说明该反应为吸热反应。
2.放热反应与吸热反应
(1)放热反应:释放热量的化学反应,如活泼金属与酸的反应,燃烧反应,中和反应等。
(2)吸热反应:吸收热量的化学反应,如氢氧化钡与氯化铵的反应,盐酸与碳酸氢钠的反应,灼热的炭与二氧化碳的反应。
有的化学反应需要加热,该反应是否为吸热反应?有的化学反应在常温下能够进行,该反应是否为放热反应?
提示:都不一定;原因是化学反应放热还是吸热取决于反应物和生成物具有总能量的相对大小,与反应是否需要加热无关。
二、化学反应存在能量变化的原因
1.从化学键的变化理解——主要原因
2.从物质储存化学能的角度理解
宏观解释 | 放热反应示意图 | 吸热反应示意图 |
化学反应放出热量 化学反应吸收热量 |
(1)放热反应可以看成是反应物所具有的化学能转化为热能释放出来。
(2)吸热反应可以看成是热能转化为化学能被生成物所“储存”。
三、人类对能源的利用
1.利用的三个阶段
——树枝杂草
↓
——煤、石油、天然气
↓
——
2.化石燃料利用过程中亟待解决的两方面问题
(1)一是其短期内不可再生,储量有限;
(2)二是煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
3.在燃料利用过程中,节能的主要环节
(1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
(2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
4.新能源
(1)特点:资源丰富、可以再生、对环境无污染等。
(2)人们比较关注的新能源:太阳能、风能、地热能、海洋能和氢能等。
1.判断正误(正确的打“√”,错误的打“×”)
(1)所有化学反应都伴随着能量的变化。 ( )
(2)断裂化学键释放出能量而形成化学键则吸收能量。 ( )
(3)吸热反应均需要加热才能发生。 ( )
(4)化石燃料储量有限,燃烧时又产生污染,故尽可能减少化石燃料的使用。
( )
[答案] (1)√ (2)× (3)× (4)√
2.下列反应是吸热反应的是( )
A.硫的燃烧 B.水的分解
C.食物的氧化变质 D.中和反应
[答案] B
3.如图所示,某化学兴趣小组把试管放入盛有25 ℃的饱和石灰水的烧杯中,在试管中放入几小块镁片,再向试管中滴入5 mL稀盐酸。试回答下列问题:
(1)实验中观察到的现象是_________________________________________
_______________________________________________________________
_______________________________________________________________。
(2)产生上述现象的原因是_________________________________________
________________________________________________________________。
(3)写出有关反应的离子方程式:__________________________。
(4)由实验可推知,反应生成的MgCl2和H2的总能量________(填“大于”“小于”或“等于”)参加反应的Mg和HCl的总能量。
[答案] (1)镁片上有大量气泡产生;镁片逐渐溶解;烧杯中的饱和石灰水变浑浊 (2)Mg与HCl反应生成H2,该反应为放热反应,体系温度升高,Ca(OH)2的溶解度随温度的升高而减小,故饱和石灰水中的Ca(OH)2析出而使溶液变浑浊 (3)Mg+2H+===Mg2++H2↑
(4)小于
化学反应中能量变化的原因
利用化学键的能量变化可粗略计算化学反应过程中的能量变化。以反应H2(g)+Cl2(g)===2HCl(g)为例:
1.断裂1 mol H—H键形成2 mol H和1 mol Cl—Cl键形成2 mol Cl,能量有什么变化?数值为多少?
提示:吸收能量。数值为(436+243)kJ=679 kJ。
2.2 mol H与2 mol Cl形成2 mol H—Cl,能量有什么变化?数值为多少?
提示:放出能量。数值为2×431 kJ=862 kJ。
3.1 mol H2与1 mol Cl2生成2 mol HCl气体,能量有什么变化?数值为多少?
提示:放出能量。数值为2×431 kJ-(436 kJ+243 kJ)=183 kJ。
4.1 mol H2(g)与1 mol Cl2(g)具有的总能量和2 mol HCl(g)具有的总能量谁高?
提示:1 mol H2(g)与1 mol Cl2(g)具有的总能量较高。
1.放热反应与吸热反应的比较
| 放热反应 | 吸热反应 |
形成原因 | 反应物具有的总能量大于生成物具有的总能量 | 反应物具有的总能量小于生成物具有的总能量 |
与化学键强弱的关系 | 生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量 | 生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量 |
反应过程图示 | ||
示例 | ①金属与水或酸的反应 ②燃烧反应 ③中和反应 ④大部分化合反应 | ①Ba(OH)2·8H2O与NH4Cl反应 ②C与H2O(g)、CO2的反应 ③大部分分解反应 |
2.化学反应遵循的两条基本规律
(1)质量守恒定律:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式的能量,但体系包含的总能量不变。
1.下列说法正确的是( )
A.Fe与S在加热条件下才能发生反应,所以该反应属于吸热反应
B.HNO3、H2SO4分别与NaOH溶液反应都放出热量
C.分解反应都是吸热反应,化合反应都是放热反应
D.合成氨的反应是放热反应,所以N2与其他物质的反应也是放热反应
B [Fe与S虽然需加热才能发生反应,但反应开始后,停止加热,反应能继续进行,加热只是为了引发反应,所以该反应是放热反应,A错误;中和反应都是放热反应,B正确;分解反应不一定是吸热反应,如H2O2的分解反应就是放热反应,化合反应也不一定是放热反应,如CO2与C的反应就是吸热反应,C错误;与N2反应的物质不同,能量变化也不同,不能根据合成氨反应的能量变化来类推N2与其他物质反应的能量变化,如N2和O2在放电条件下生成NO就是吸热反应,D错误。]
2.已知断裂1 mol共价键所需要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列对H2(g)+I2(g)2HI(g)的反应类型判断错误的是( )
A.放出能量的反应 B.吸收能量的反应
C.氧化还原反应 D.可逆反应
B [依题意,断裂1 mol H—H键和1 mol I—I键吸收的能量为436 kJ+151 kJ=587 kJ,生成2 mol H—I键放出的能量为299 kJ×2=598 kJ,因为598 kJ>587 kJ,所以该反应是放出能量的反应;根据反应式可知该反应是可逆反应,也是氧化还原反应。]
3.已知化学反应N2+3H22NH3的能量变化如图所示:
(1)1 mol N和3 mol H生成1 mol NH3(g)是________(填“吸收”或“释放”)能量的过程。
(2)由 mol N2(g)和 mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量。
[解析] 如果反应物具有的总能量大于生成物具有的总能量,整个反应就放出能量,反之就吸收能量。
(1)由图像可知1 mol N和3 mol H具有的总能量比1 mol NH3(g)的能量高b kJ,所以1 mol N和3 mol H生成1 mol NH3(g)是释放能量的过程。
(2)由图像可知 mol N2(g)和 mol H2(g)总能量比1 mol N 和3 mol H具有的总能量低a kJ,而1 mol NH3(g)具有的总能量比1 mol N和3 mol H具有的总能量低b kJ,b>a,所以由 mol N2(g)和 mol H2(g)生成1 mol NH3(g)的过程释放出(b-a)kJ能量。
[答案] (1)释放 (2)释放 (b-a)
[素材一] 2019年6月26日,《中国氢能源及燃料电池产业白皮书》在山东省潍坊市正式发布。根据白皮书发布内容,氢能将成为中国未来能源体系的重要组成部分,预计到2050年氢能在中国能源体系中的比例约为10%。“氢能是高效清洁能源载体,具有许多无可比拟的特点。”
[素材二] 2019中国(山西)国际清洁能源博览会于2019年6月28日上午在太原开幕。本次展会以“清洁低碳、绿色发展”为主题,聚焦煤炭清洁利用、新能源、储能、节能环保等领域,展示新技术新产品新应用,搭建中西部清洁能源及设备供需平台,促进煤改电、煤改气、煤改清洁采暖在中西部的实施,加强雾霾的治理,有效改善呼吸环境。
[素材三] SF6气体已有百年历史,它是法国两位化学家Moissan和Lebeau于1900年合成的人造惰性气体。六氟化硫具有良好的电气绝缘性能及优异的灭弧性能,国际上称为“气体绝缘开关设备”。SF6分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。
1.根据素材一思考
(1)氢气燃烧放出的热量从何而来?与化学反应的本质有什么关系?
(2)氢能具有哪些优点?
提示:(1)氢气燃烧放出的热量来自物质的内能,与化学反应中化学键的断裂和形成有关。
(2)氢能的优点:①清洁燃料,是零排放能源;②来源广泛,可来自可再生能源,也可来自工业流程中的副产品;③应用广泛;④热值高、安全性好。
2.根据素材二思考
(1)提高燃料的燃烧效率应该从哪些方面考虑?
(2)日常生产、生活中常常采用下列能源:
①煤;②石油;③天然气;④太阳能;⑤水能;⑥氢能;⑦核能;⑧风能;⑨地热能等,属于清洁能源的有哪些?
提示:(1)使燃料与氧气充分接触,如将煤粉碎、液化和气化;通入充足的氧气。
(2)④⑤⑥⑦⑧⑨。清洁能源即绿色能源,是指不排放污染物、能够直接用于生产生活的能源,它包括核能和可再生能源。可再生能源是指原材料可以再生的能源,如水力发电、风力发电、太阳能、水能、生物能(沼气)、地热能(包括地源和水源)、海洋能等能源。
3.根据素材三思考
(1)1 mol S(s)与3 mol F2(g)生成1 mol SF6(g)的能量变化及数量如何?
(2)1 mol S(s)与3 mol F2(g)的总能量和1 mol SF6(s)的总能量大小如何?
提示:(1)放出1 220 kJ的热量。
(2)前者能量大。
通过素材一、二、三的探究,了解能源问题和能量变化的原因,培养学生“证据推理与社会责任”的核心素养。
1.下列对于化学反应过程的理解错误的是( )
A.化学变化过程中同时存在物质和能量的变化
B.能量变化一定发生在化学变化中
C.化学反应既遵循质量守恒定律又遵循能量守恒定律
D.能量的释放和吸收以发生变化的物质为基础
B [化学变化过程中一定伴随着能量的变化,但有能量变化的不一定是化学变化,如灯泡通电发光放热,是物理变化,B项错误。]
2.下列反应中能量变化趋势与如图一致的是( )
A.氢氧化钡晶体与氯化铵晶体混合
B.中和反应
C.木炭在氧气中发生不完全燃烧
D.生石灰和水的反应
A [生成物的总能量大于反应物的总能量,说明此反应为吸热反应。Ba(OH)2·8H2O和NH4Cl的反应为吸热反应,A项正确;中和反应、2C+O22CO、CaO+H2O===Ca(OH)2均为放热反应,B、C、D项错误。]
3.新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列能达到新能源标准的是( )
①地热能 ②煤 ②天然气 ④太阳能 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能
A.②⑤⑦⑧ B.①④⑤⑦⑧
C.④⑤⑦⑧ D.②③⑥⑦⑧
B [煤、石油、天然气是化石能源,不可再生,不属于新能源;新能源有:太阳能、地热能、海洋能、风能、氢能、生物质能等,这些新能源对环境污染小,属于环境友好型能源,即符合条件的是①④⑤⑦⑧,故选B。]
4.氢气燃烧生成水蒸气的能量变化如图所示。下列说法正确的是( )
A.燃烧时化学能全部转化为热能
B.断开1 mol氢氧键吸收930 kJ的能量
C.相同条件下,1 mol氢原子的能量为E1,1 mol氢分子的能量为E2,则2E1<E2
D.该反应生成1 mol水蒸气时放出能量245 kJ
D [燃烧时化学能可转化为热能、光能等,A项错误;由题图可知,断开2 mol氢氧键吸收930 kJ的能量,B项错误;氢分子变成氢原子要吸收能量,所以2E1>E2,C项错误;该反应生成1 mol水蒸气时放出的能量为930 kJ-436 kJ-249 kJ=245 kJ,D项正确。]
5.(素养题)如图所示,在小试管里加入2 g新制备的无水硫酸铜,把小试管套在具支试管内。在U形管内加入少量红墨水。打开T形管螺旋夹,使U形管内两边的液面处于同一水平面。再夹紧螺旋夹,把水滴入小试管内,白色的无水硫酸铜完全变成蓝色的五水硫酸铜晶体,可观察到U形管右侧的液面立即下降,左侧的液面上升。
(1)①写出上述反应的化学方程式:__________________________________
________________________________________________________________。
②该反应是________(填“吸热”或“放热”)反应。
③反应中的硫酸铜和水具有的总能量________(填“大于”或“小于”)硫酸铜晶体的总能量。
(2)如果U形管内两边的液面处于同一水平面后,在小试管内先加入Ba(OH)2·8H2O晶体,再加入NH4Cl固体,用玻璃棒不断搅拌,则可观察到U形管中的现象为__________________________________。
[解析] (1)滴入水后,CuSO4+5H2O===CuSO4·5H2O,由现象U形管右侧液面下降,左侧液面上升,可知是具支试管内气体受热膨胀,压强增大所致,所以此反应是放热反应,CuSO4和H2O的总能量大于CuSO4·5H2O的总能量。(2)Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O,反应吸热,导致具支试管内气体压强减小,U形管中右侧液面上升,左侧液面下降。
[答案] (1)①CuSO4+5H2O===CuSO4·5H2O
②放热 ③大于 (2)U形管右侧液面上升,左侧液面下降
高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度学案设计: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度学案设计,共3页。
高中人教版 (2019)第二节 化学反应的速率与限度学案: 这是一份高中人教版 (2019)第二节 化学反应的速率与限度学案,共4页。
人教版 (2019)必修 第二册第六章 化学反应与能量第二节 化学反应的速率与限度第2课时学案设计: 这是一份人教版 (2019)必修 第二册第六章 化学反应与能量第二节 化学反应的速率与限度第2课时学案设计,共12页。学案主要包含了化学反应的限度,化学反应条件的控制等内容,欢迎下载使用。