人教版 (新课标)选修5 有机化学基础第三节 卤代烃学案
展开1、认识卤代烃的组成和结构特点;
2、根据卤代烃的组成和结构特点,认识取代和消去反应。
【要点梳理】
【高清课堂:卤代烃#溴乙烷】
要点一、溴乙烷的结构和性质
1.分子结构。
溴乙烷的分子式为C2H5Br,结构式为,结构简式为CH3CH2Br或C2H5—Br。
2.物理性质。
纯净的溴乙烷是无色液体,沸点38.4℃,密度比水大,难溶于水,溶于多种有机溶剂。
【高清课堂:卤代烃#化学性质】
3.化学性质。
(1)水解反应(或取代反应)。
C2H5—Br—H—OHC2H5—OH+HBr或C2H5—Br+NaOHC2H5—OH+NaBr
注意:卤代烃的水解反应的实质是取代反应。NaOH的作用是中和掉反应中生成的HBr,从而加快反应速率,
并提高卤代烃的利用率。
(2)消去反应。
注意:卤代烃发生消去反应时,主要是卤素原子与相邻含氢较少的碳原子上的氢一起结合成卤化氢脱去。如
果相邻碳原子上无氢原子,则不能发生消去反应。
要点二、卤代烃
1.烃分子中的氢原子被卤素原子取代后所生成的化合物叫做卤代烃。
2.卤代烃有多种分类方法。根据分子里所含卤素的不同,卤代烃可分为氟代烃、氯代烃、溴代烃等;根据分子中卤素原子的多少可分为一卤代烃和多卤代烃;根据分子中烃基的不同可分为饱和卤代烃、不饱和卤代烃和芳香卤代烃,等等。
一卤代烃的结构式为R—X。
3.卤代烃的物理性质。
(1)常温下,卤代烃中除少数为气体外,大多为液体或固体。
(2)所有卤代烃都不溶于水,可溶于大多数有机溶剂。某些卤代烃是很好的有机溶剂。
(3)卤代烃的同系物的沸点随烃基中碳原子数的增加而升高,且均高于相应烷烃。
(4)卤代烃的同分异构体的沸点随烃基中支链的增加而降低。
(5)同一烃基的不同卤代烃的沸点随卤素原子的相对原子质量的增大而增大。如:沸点:RF<RCl<RBr<RI。
(6)卤代烃的同系物的密度随碳原子数的增加而降低,且密度均比相应的烷烃密度大;卤代烃的同分异构体的密度随分子中支链的增加而降低。
4.卤代烃的化学性质。
卤代烃的化学性质一般比烃活泼,能发生许多化学反应,如取代反应、消去反应等,从而转化为各种其他类型的化合物。
(1)取代反应
R—X+H2OR—OH+HX或R—X+NaOHR—OH+NaX
(2)消去反应
注意:若与卤素原子相连的碳原子的邻位碳原子上都有氢原子,则可能有多种消去方式,如:在发生消去反应时,生成物可能为或。
5.卤代烃中卤素原子的检验方法。
(1)实验原理。
R—X+H2OR—OH+HX
HX+NaOH==NaX+H2O
HNO3+NaOH==NaNO3+H2O
AgNO3+NaX==AgX↓+NaNO3
根据沉淀(AgX)的颜色(白色、浅黄色、黄色)可确定是何种卤族元素(Cl、Br、I)。
(2)实验步骤。
①取少量卤代烃;②加入NaOH水溶液;③加热;④冷却;⑤加入稀硝酸酸化;⑥加入AgNO3溶液,观察沉淀的颜色。
(3)实验说明。
①加热是为了加快卤代烃的水解反应速率,因不同的卤代烃水解难易程度不同。
②加入稀HNO3酸化,一是为了中和过量的NaOH,防止NaOH与AgNO3反应产生沉淀,影响对实验现象的观察和AgX沉淀的质量;二是检验生成的沉淀是否溶于稀硝酸。
③量的关系:R—X~NaX~AgX↓,1 ml一卤代烃可得到1 ml卤化银(除F外)沉淀,常利用此量的关系来进行定量测定卤代烃。
要点三、卤代烃对人类生活的影响
1.卤代烃用途十分广泛,对人类的生产生活有着巨大的影响,如:有些卤代烃可用作溶剂、农药、制冷剂、灭火剂等。
2.卤代烃通常比较稳定,不易被微生物降解,有些卤代烃(如氟氯代烃)还会破坏大气臭氧层,这使得人类对卤代烃的使用受到了较大的限制。
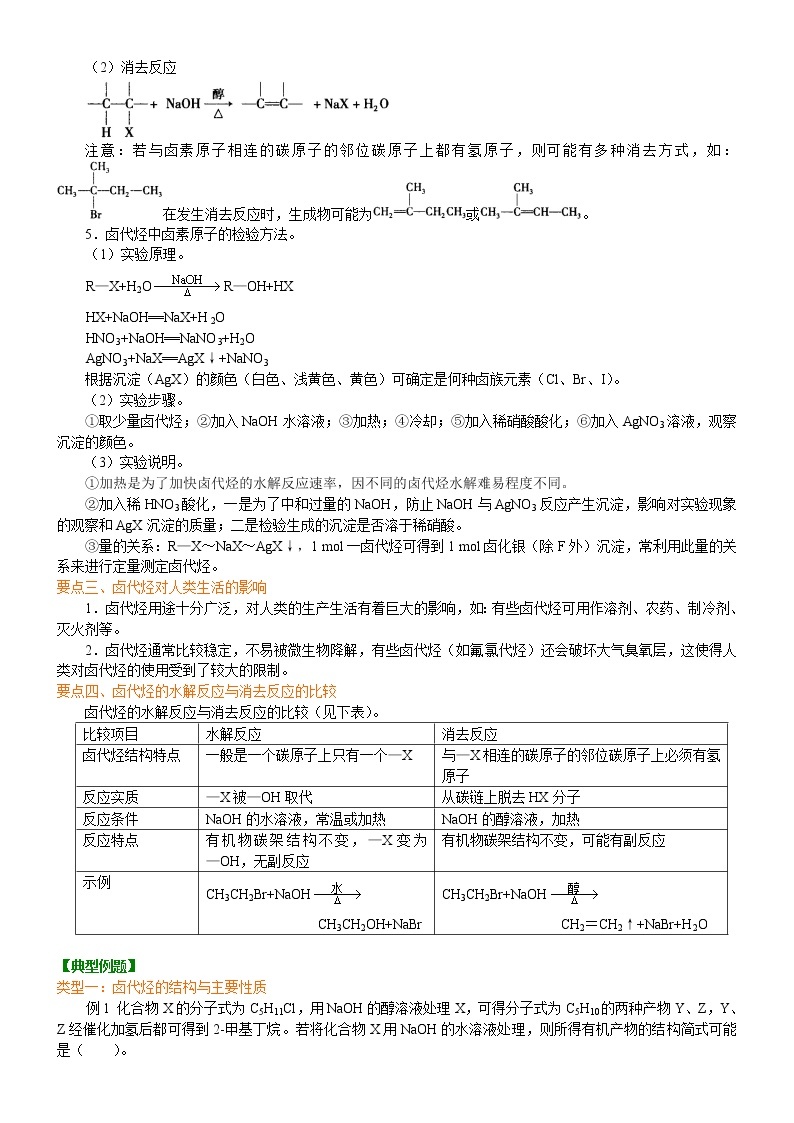
要点四、卤代烃的水解反应与消去反应的比较
卤代烃的水解反应与消去反应的比较(见下表)。
【典型例题】
类型一:卤代烃的结构与主要性质
例1 化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2-甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )。
CH3—C—CH2—CH3
CH3
OH
A.CH3CH2CH2CH2CH2OH B.
CH3—C—CH2Cl
CH3
CH3
CH3—CH—CH—CH3
CH3
OH
C. D.
【答案】B、C
【解析】化合物X(C5H11Cl)用NaOH的醇溶液处理发生消去反应生成Y、Z的过程中,有机物X的碳架结构不变,而Y、Z经催化加氢后,其有机物的碳架结构也未变,由2-甲基丁烷的结构可推知X的碳架结构为:,其连接Cl原子的相邻碳原子上都有氢原子且氢原子的化学环境不同。从而推知有机物X的结构简式为或 。则X水解的产物可能是B,也可能是C。
【总结升华】要注意卤代烃的消去反应和水解反应的区别。
举一反三:
【高清课堂:卤代烃#例1】
【变式1】有机物CH3—CH=CHC1能发生的反应有( )。
①取代反应 ②加成反应 ③消去反应
④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应
A.以上反应均可发生B.只有⑦不能发生
C.只有⑥不能发生 D.只有②不能发生
【答案】C
【变式2】在有机反应中,反应物相同而条件不同会得到不同的主产物,下图中R代表烃基,副产物均已略去。
(请注意H和Br所加成的位置)
请写出实现下列转变的各步反应的化学方程式,特别注意要写明反应条件。
(1)由CH3CH2CH2CH2Br分两步转变为CH3CH2CHBrCH3;
(2)由(CH3)2CHCH—CH2分两步转变为(CH3)2CHCH2CH2OH。
【答案】(1)CH3CH2CH2CH2Br+NaOHCH3CH2CH=CH2↑+NaBr+H2O
类型二:卤代烃在有机合成中的应用
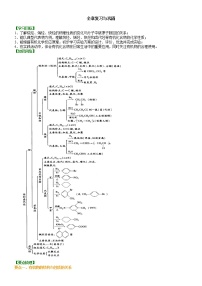
例2 二氯烯丹是一种播前除草剂,其合成路线如下:
D在反应⑤中所生成的E,其结构只有一种可能。
(1)写出下列反应的类型:反应①是________,反应③是________。
(2)写出下列物质的结构简式:A:________,C:________,D:________,E:________。
【答案】(1)取代反应 消去反应
(2)CH3—CH=CH2 CH2=CCl—CH2Cl CH2Cl—CCl2—CH2Cl CH2Cl—CCl=CHCl
【解析】该题可分两段进行逆推。首先由第②步B通过加成反应生成了CH2Cl—CHCl—CHCl,推出B为CH2Cl—CH=CH2,进一步可推出A为CH3CH=CH2。CH2ClCHClCH2Cl通过反应③得到C,此时有些难以判断:消去哪个氯?消去几个?此时可从另一段开始逆推。由最终产物可推知E为CH2Cl—CCl=CHCl;D的消去产物E只有一种结构,所以D应该是一种对称结构。D为CH2Cl—CCl2—CH2Cl。再进一步联系反应③,可推知C为CH2=CCl—CH2Cl。
【总结升华】氯代烃在一定条件下水解生成醇:;通常情况下,多个—OH连在同一个碳上,分子结构是不稳定的,容易自动失水,生成碳氧双键:。
举一反三:
【变式1】傅瑞德尔—克拉福茨反应是在苯环上引入烷基的反应,例如:
,
乙苯还可发生下列反应:。已知烯烃在发生加成反应时,加成试剂HA中的氢总是加在含氢较多的不饱和碳上:R—CH=CH2+HA—→R—CH(A)—CH3。
试以电石、苯为原料制备,写出各步反应的化学方程式。
【答案】CaC2+2H2O—→Ca(OH)2+C2H2↑ CH≡CH+H2CH2=CH2
CH2=CH2+HCl—→CH3CH2Cl
类型三:卤代烃中卤原子的鉴定
例3 在实验室里鉴定氯酸钾晶体和1-氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加入NaOH溶液;③加热;④加入MnO2固体;⑤加蒸馏水过滤后取滤液;⑥过滤后取滤渣;⑦用稀HNO3酸化。
(1)鉴定氯酸钾晶体中氯元素的操作步骤是________(填序号)。
(2)鉴定1-氯丙烷中氯元素的操作步骤是________(填序号)。
【答案】(1)④③⑤⑦① (2)②③⑦①
【解析】要鉴定样品中是否含有氯元素,通常采用的实验方法是先设法将样品中的氯元素转化为Cl-,再使Cl-转化为AgCl沉淀,利用沉淀的颜色和卤化银(氟化银除外)不溶于稀硝酸的性质来判断氯元素的存在。
(1)鉴定氯酸钾晶体中的氯元素,可先用催化加热分解的方法得到氯化钾,再利用酸化AgNO3溶液来检验Cl-,从而确认氯酸钾中氯元素的存在。
(2)鉴定1-氯丙烷中的氯元素,必须先将1-氯丙烷中的氯原子通过水解或消去反应变为氯离子,再滴入AgNO3溶液来检验。即先取少量1-氯丙烷加入NaOH的水溶液,使其水解后,再加入稀HNO3酸化,然后加入AgNO3溶液,观察沉淀的颜色来判断是哪种卤素原子。其实验的关键是在加入AgNO3溶液之前,应加入稀HNO3酸化,以中和过量的NaOH溶液,防止NaOH与AgNO3溶液反应生成的沉淀对实验的观察产生干扰。
举一反三:
【变式1】要检验某溴乙烷中的溴元素,下列实验方法正确的是( )。
A.加入新制的氯水振荡,再加入少量CCl4振荡,观察下层是否变为橙红色
B.加入硝酸银溶液,再加入稀硝酸使溶液呈酸性,观察有无浅黄色沉淀生成
C.加入NaOH溶液共热,冷却后加入硝酸银溶液,观察有无浅黄色沉淀生成
D.加入NaOH溶液共热,冷却后加入稀硝酸使溶液呈酸性,再滴入硝酸银溶液,观察有无浅黄色沉淀生成
【答案】D比较项目
水解反应
消去反应
卤代烃结构特点
一般是一个碳原子上只有一个—X
与—X相连的碳原子的邻位碳原子上必须有氢原子
反应实质
—X被—OH取代
从碳链上脱去HX分子
反应条件
NaOH的水溶液,常温或加热
NaOH的醇溶液,加热
反应特点
有机物碳架结构不变,—X变为—OH,无副反应
有机物碳架结构不变,可能有副反应
示例
CH3CH2Br+NaOH
CH3CH2OH+NaBr
CH3CH2Br+NaOH
CH2=CH2↑+NaBr+H2O
2021学年第一节 油脂导学案: 这是一份2021学年第一节 油脂导学案,共5页。学案主要包含了学习目标,要点梳理,高清课堂:油脂#油脂,典型例题,思路点拨,总结升华等内容,欢迎下载使用。
高中化学人教版 (新课标)选修5 有机化学基础第三节 卤代烃学案设计: 这是一份高中化学人教版 (新课标)选修5 有机化学基础第三节 卤代烃学案设计,共4页。学案主要包含了学习目标,要点梳理,典型例题,总结升华等内容,欢迎下载使用。
化学选修5 有机化学基础第二章 烃和卤代烃综合与测试导学案及答案: 这是一份化学选修5 有机化学基础第二章 烃和卤代烃综合与测试导学案及答案,共6页。学案主要包含了学习目标,知识网络,要点梳理,典型例题,思路点拨,总结升华等内容,欢迎下载使用。