高中化学第二章 烃和卤代烃第三节 卤代烃教案设计
展开第三节 卤代烃
教学目标:
1、掌握溴乙烷的主要化学性质,理解取代反应和消去反应,并通过对二者的比较认识反应条件对化学反应的影响。
2、了解卤代烃的结构特点、一般通性和用途。
3、了解氟利昂对环境的不良作用,增强环境保护意识。
教学重点:溴乙烷的结构特点和主要化学性质 。
教学难点:溴乙烷发生取代反应和消去反应的基本规律。
课时: 2课时
第一课时
一、卤代烃
1、概念
烃分子中的氢原子被____________取代后所生成的化合物。
2、分类
卤代烃
3、饱和一元脂肪卤代烃:通式为: 。
命名:与烯烃的命名相似。
即:(1)主链的选择: ;(2)编号原则: 。
4、(复习)卤代烃的同分异构体的写法:
(1)先写 ,与烷烃的同分异构体写法相同;
(2)然后再用等效氢的思考方法写出—X的位置异构。
(练习)1、分子式为C3H6Cl2的有机物,发生一元氯代反应后,可生成2种同分异构体,则原C3H6Cl2应是( )
A、1,3—二氯丙烷 B、1,1—二氯丙烷 C、1,2—二氯丙烷 D、2,2—二氯丙烷
(练习)2、2—溴—3,3—二甲基戊烷是由某烃与等物质的量的溴化氢加成制区取的,则原烃是 。
5、物理性质
常温下,卤代烃中除少数为气体外,大多数为液体或固体。卤代烃不溶于水,可溶于大多数有机溶剂,某些卤代烃本身就是很好的溶剂。
特别提醒
①低级溴代烷密度比水大,而一氯代烷密度比水小。
②常温下呈气态的氯代烷是CH3Cl和C2H5Cl。
二、溴乙烷
1、 分子结构
H H
| |
分子式为__________________,结构式为H —C—C— Br
| |
H H
结构简式为_________________,官能团为________。
2、物理性质
纯净的溴乙烷是____________液体,沸点为38.4℃,密度比水________难溶于水,易溶于乙醇等多种有机溶剂。
3、化学性质
[科学探究]
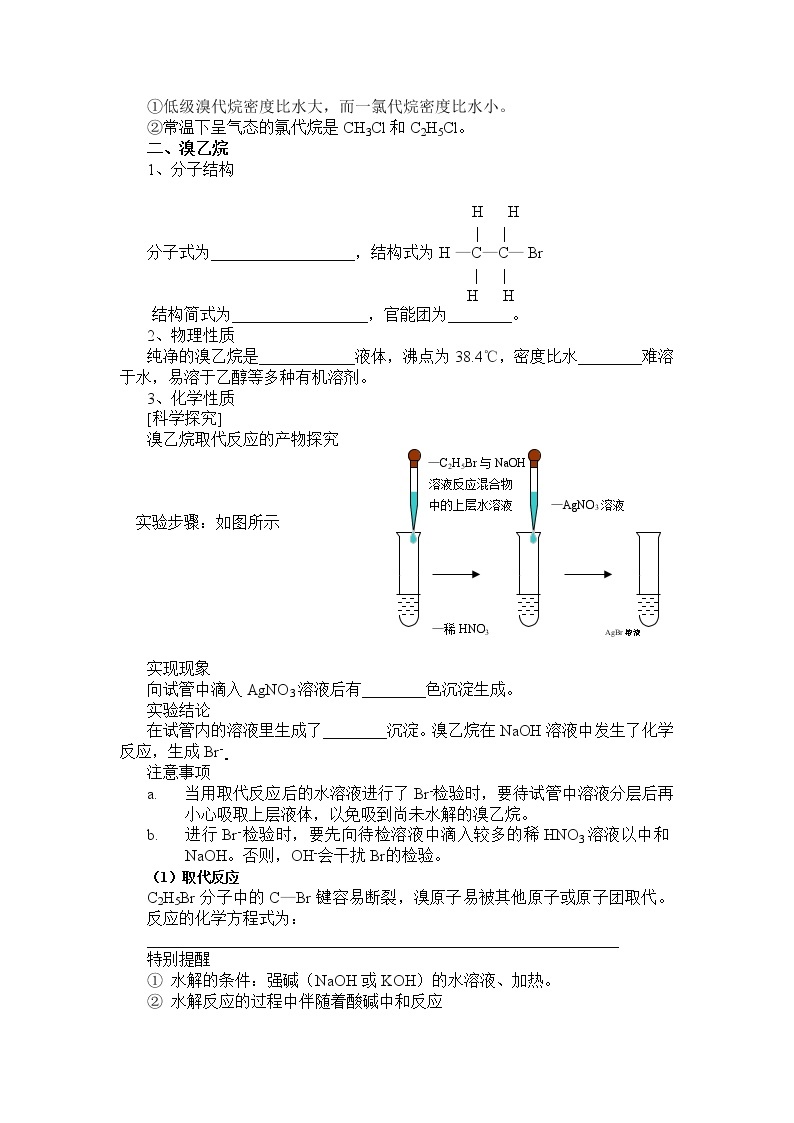
溴乙烷取代反应的产物探究
—C2H5Br与NaOH
溶液反应混合物
中的上层水溶液 —AgNO3溶液
实验步骤:如图所示
—稀HNO3 AgBr溶液
实现现象
向试管中滴入AgNO3溶液后有________色沉淀生成。
实验结论
在试管内的溶液里生成了________沉淀。溴乙烷在NaOH溶液中发生了化学反应,生成Br-。
注意事项
- 当用取代反应后的水溶液进行了Br-检验时,要待试管中溶液分层后再小心吸取上层液体,以免吸到尚未水解的溴乙烷。
- 进行Br-检验时,要先向待检溶液中滴入较多的稀HNO3溶液以中和NaOH。否则,OH-会干扰Br的检验。
(1)取代反应
C2H5Br分子中的C—Br键容易断裂,溴原子易被其他原子或原子团取代。反应的化学方程式为:
___________________________________________________________
特别提醒
① 水解的条件:强碱(NaOH或KOH)的水溶液、加热。
② 水解反应的过程中伴随着酸碱中和反应
应用 检验卤代烃分子中卤素的方法
(1) 实验原理
(2) 实验步骤
(3)实验说明
第二课时
[实验探究]
溴乙烷消去反应产物的探究
气体
实验方案:
注意事项
- 在溴乙烷与NaOH乙醇溶液混合加热生成的乙烯气体中肯定混有乙醇的蒸气,而乙醇可以被酸性KMnO4溶液氧化。因此要在气体通入酸性KMnO4溶液前加一个盛有水的试管,以除去乙醇蒸气,防止对乙烯的检验造成干扰。
- 还可以用溴水检验乙烯,此时没有必要将气体通入水中,因为乙醇与溴水不能发生化学反应。
(2)消去反应
① 概念:有机化合物在一定条件下,从一个分子中脱去_________(如________、_________等)而生成含_______________的反应。
② 溴乙烷在NaOH的醇溶液中发生消去反应的化学方程式为:____________________________________________。
特别提醒
① 反应条件:强碱(NaOH或KOH)的醇溶液,加热。
② 反应的实质:从相邻的碳原子上分虽去掉溴原子和氢原子。
③ 产物特点:生成小分子HBr,同时生成不饱和化合物CH2=CH2。
④ 消去反应的过程中也伴随着酸碱中和反应。
(3)溴乙烷的取代反应和消去反应的比较
| 取代反应 | 消去反应 |
反应物 | 溴乙烷和NaOH | 溴乙烷和NaOH |
反应条件 | 水、加热 | 醇、加热 |
生成物 | 乙醇、溴化钠 | 乙烯、溴化钠、水 |
结论 | 溴乙烷和NaOH在不同溶剂中发生不同类型的反应,生成不同的产物 | |
三、卤代烃的化学性质
1、 均能水解(与溴乙烷类似):
(完成) R—X + NaOH
2、 消去反应
条件: 。
介质: 。
如:
思维拓展
① 能发生消去反应的卤代烃,在结构上必须具备两个条件:一是分子中碳原子数大于等于2;二是与—X相连的碳原子的邻位碳原子上必须有氢原子。
② R—CH—CH—R型卤代烃,发生消去反应生成 。
| |
X X
③卤代烃发生消去反应和取代反应的外界条件不同。在醇和强碱存在的条件下发生消去反应,在水和强碱存在的条件下发生取代反应。
四、卤代烃的用途及对环境的影响
1、氟氯烃的特性;多数为 色, 味的 体。化学性质 、 毒、具有 燃烧, 挥发、 液化等特性。
2、卤代烃的用途:常用作 、 、 、 和 。
3、(阅读材料)卤代烃对臭氧层的破坏原理:大量氟氯烃在平流层受紫外光的照射分解产生氯原子,氯原子可引发损耗O3的反应:
高中化学人教版 (新课标)选修5 有机化学基础第三节 卤代烃教案设计: 这是一份高中化学人教版 (新课标)选修5 有机化学基础第三节 卤代烃教案设计,共5页。
高中化学人教版 (新课标)选修5 有机化学基础第三节 卤代烃教案: 这是一份高中化学人教版 (新课标)选修5 有机化学基础第三节 卤代烃教案,共5页。
化学选修5 有机化学基础第三节 卤代烃教案设计: 这是一份化学选修5 有机化学基础第三节 卤代烃教案设计,共8页。教案主要包含了知识目标,能力和方法目标,情感和价值观目标,科学方法,边讲述边投影,引导探究,投影板书,提出问题等内容,欢迎下载使用。