




初中化学人教版九年级下册课题3 溶液的浓度教学演示ppt课件
展开第九单元 溶液课题3 溶液的浓度
1.掌握一种溶液组成的表示方法——溶质的质量分数,并能进行溶质质量分数的简单计算。2.正确理解溶解度与溶质质量分数的关系。
学习重点: 溶解度曲线涵义及运用学习难点: 溶解度曲线运用
1.溶液中溶质的质量分数是 与 _________之比。
2.溶质质量分数计算公式:
3.溶质质量分数与溶液浓度的关系 溶质的质量分数是溶液浓度的 表示,溶质的质量分数越大,表示溶液 。
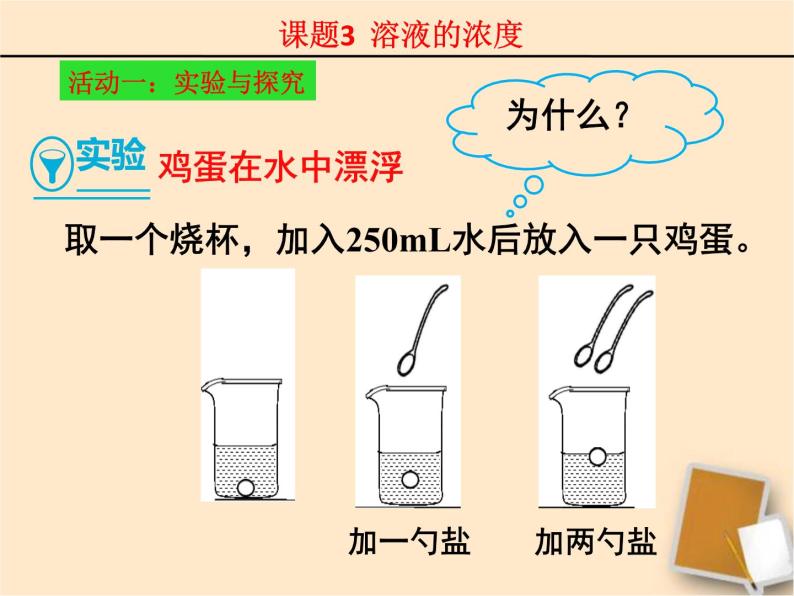
取一个烧杯,加入250mL水后放入一只鸡蛋。
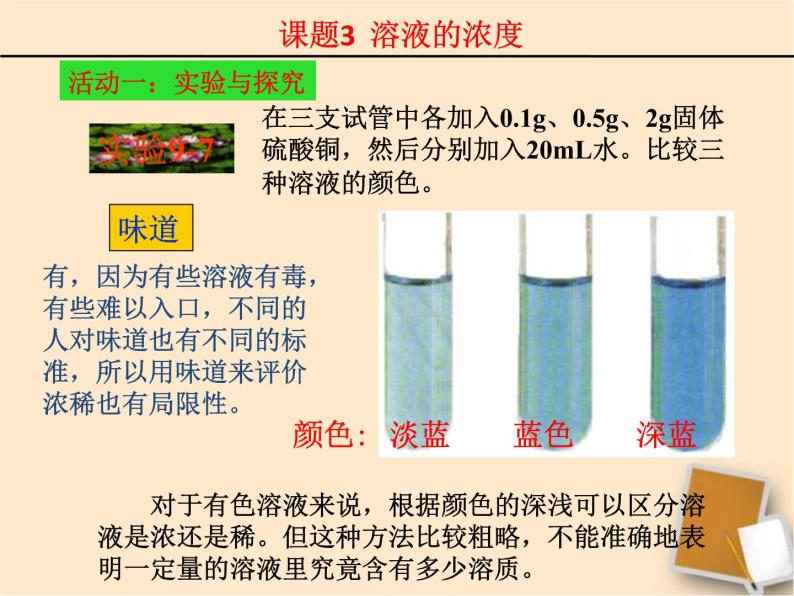
在三支试管中各加入0.1g、0.5g、2g固体硫酸铜,然后分别加入20mL水。比较三种溶液的颜色。
对于有色溶液来说,根据颜色的深浅可以区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
淡蓝 蓝色 深蓝
有,因为有些溶液有毒,有些难以入口,不同的人对味道也有不同的标准,所以用味道来评价浓稀也有局限性。
通过观察颜色来判断溶液的浓稀,仅仅是判断溶液浓稀粗略的方法。 如何准确地表明一定量溶液中含有的溶质的量?表示溶液组成的方法有多种,这里主要认识溶质的质量分数。
1、定义:溶质质量与溶液质量之比
溶质质量 = 溶液质量× 溶质的质量分数
溶质的质量=溶液的质量×溶质的质量分数
溶剂的质量=溶液的质量-溶质的质量
1、溶质的质量:形成溶液的那部分溶质,无溶入溶液的不计。2、溶液的质量 = 溶质的质量 + 溶剂的质量。3、计算时上下质量单位要统一。4、不要忘记X100%,最后得到百分数。5、物质的质量分数要在不超过其最大溶解量的范围时才有意义。6、运用溶质的质量分数表示时,必须分清溶质、溶剂与溶液的质量。 7、 溶质的质量分数表示溶质质量与溶液质量之比,并不是溶质质量与溶剂质量之比。 8、溶质的质量分数一般用百分数表示。 9、计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
结论:一般而言,有色溶液的颜色深些其溶质的质量分数大些。
活动二:溶液的浓、稀与饱和、不饱和的关系
一定量溶液里,所含溶质的多少
思考:溶液的浓稀 和 溶液的饱和与否的关系
☆同一温度时,同一溶质的饱和溶液肯定比不饱和溶液浓
例:20℃时KNO3的溶解度为31.6g,将20g KNO3投入50g水中,充分搅拌,制成20℃时溶液,求该溶液中溶质的质量分数?
解:20℃时KNO3的溶解度为31.6g。50g水中最多溶解KNO315.8g。
答:溶液中溶质的质量分数为24%。
活动三:溶质的质量分数与溶解度的关系
溶质质量分数与溶解度的比较溶质的质量分数36%是指:100g溶液中含有36g溶质。溶质T ℃时溶解度36g是指:在T ℃时,100g水最多溶解该溶质36g。
饱和溶液的溶质质量分数=
“已知20摄氏度时,食盐的溶解度是36g。这表明,该饱和溶液溶质的质量分数是36%”这种说法对吗?为什么?
【例题1】在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
有关溶液的稀释、浓缩和混合问题的计算
有关溶液的稀释、浓缩的计算依据是什么?
如何进行有关溶液的稀释、浓缩的计算?
结论:改变溶质质量分数的方法有:_______________________________________________________。
例题2 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
分析:解决这道题的关键是什么?
溶液稀释前后溶质的质量不变
若有某溶液Ag,其溶质的质量分数为a%,稀释后得到溶质质量分数为b%的溶液Bg。则有: Ag×a% = Bg×b% (稀释前 (稀释后)
如果把50g换成50mL,还需要什么条件?
设稀释后溶液的质量为x。
50g× 98%= x × 20%
x=245g 需要水的质量=245g-50g=195g
答:需要水的质量为195g。
1.计算原理:在溶液稀释与浓缩的过程中,溶质的质量不会发生变化。2.溶液稀释的方法与计算公式(1)加水稀释:A为浓溶液质量,a%为浓溶液溶质的质量分数;B为稀释后溶液质量,b%表示稀释后溶质质量分数;M水表示加入水的质量。A·a%=B·b%或A·a%=(A+M水)·b%(2)加入稀溶液稀释浓溶液:A为浓溶液质量,a%为浓溶液溶质的质量分数;B为稀溶液质量,b%表示稀溶液溶质质量分数;c%代表混合后所得溶液的溶质质量分数。A·a%+B·b%=(A+B)·c%
3.溶液浓缩的方法与计算公式(1)加入溶质:A为原溶液质量,a%为其溶质的质量分数;B为加入溶质的质量,c%表示加入溶质后所得溶液溶质的质量分数。A·a%+B=(A+B)·c% (2)蒸发溶剂:A为原溶液质量,a%为其溶质的质量分数;B为减少的溶剂的质量,c%为蒸发溶剂后所得溶液溶质的质量分数。A·a%=(A-B)·c%
(3)与浓溶液混合:A为原溶液质量,a%为其溶质的质量分数,B为浓溶液质量,b%表示其溶质质量分数,c%表示混合后所得溶液溶质的质量分数。A·a%+B·b%=(A+B)·c%易错提示:(1)计算时要保持单位一致。(2)两种溶液混合,混合后溶液的质量等于混合前两种溶液的质量之和,但混合后溶液的体积不一定等于混合前两种溶液的体积之和。
活动四:课堂小结及展示
一、溶质的质量分数1.定义:溶质的质量与溶液的质量之比。2.公式:溶质的质量分数=溶质的质量/溶液的质量×100%二、溶质质量分数的计算1. 有关溶质的质量分数的简单计算2. 溶质的质量分数与溶解度的关系一定温度下的饱和溶液中: 3. 有关溶液的稀释、浓缩和混合问题的计算
初中人教版课题3 溶液的浓度教学演示课件ppt: 这是一份初中人教版课题3 溶液的浓度教学演示课件ppt,共27页。PPT课件主要包含了各加入20ml水,比较颜色,浅蓝色--→深蓝色,稀----→浓,发现什么,葡萄糖注射液的浓度,溶质的质量分数,计算公式,注意公式推导,溶质质量分数的含义等内容,欢迎下载使用。
人教版九年级下册第九单元 溶液课题3 溶液的浓度精品ppt课件: 这是一份人教版九年级下册第九单元 溶液课题3 溶液的浓度精品ppt课件,共20页。PPT课件主要包含了新知探究,无水硫酸铜,实验9-7,淡蓝色,深蓝色,学习目标,溶质的质量分数,新知探究1,小试牛刀,比比谁最快等内容,欢迎下载使用。
化学人教版课题3 溶液的浓度教案配套课件ppt: 这是一份化学人教版课题3 溶液的浓度教案配套课件ppt,共35页。PPT课件主要包含了128%,664克,625molL,molL,4molL,gmol,Na2O,2molL,容量瓶简介,容量瓶使用注意事项等内容,欢迎下载使用。













