






高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化精品ppt课件
展开1. 了解硫和含硫化合物的相互转化关系。 2. 学习氧化还原反应方程式的配平。 3. 学习氧化还原反应方程式中的守恒思想。
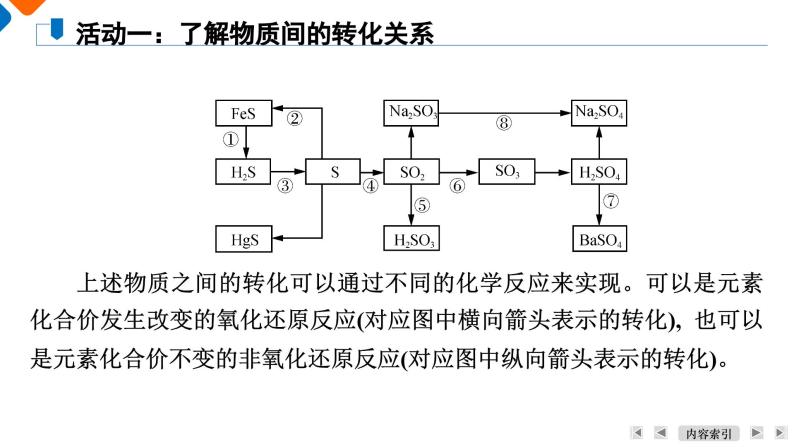
上述物质之间的转化可以通过不同的化学反应来实现。可以是元素化合价发生改变的氧化还原反应(对应图中横向箭头表示的转化), 也可以是元素化合价不变的非氧化还原反应(对应图中纵向箭头表示的转化)。
活动一:了解物质间的转化关系
请写出下列含硫物质之间发生转化的化学方程式。1. 在常温下,硫单质能与汞化合生成硫化汞(HgS)。为了除去不慎洒落的汞,人们常将硫黄粉撒在汞的表面。【答案】 Hg+S===HgS2. 长期暴露在空气中的亚硫酸钠会慢慢变成硫酸钠。【答案】 2Na2SO3+O2===2Na2SO43. 实验室中用过量氢氧化钠溶液吸收二氧化硫生成亚硫酸钠。【答案】 2NaOH+SO2===Na2SO3+H2O
守恒现象在化学变化过程中普遍存在。我们已经知道,参加化学反应的各物质的总质量等于反应后生成的各物质的总质量。从元素的化合价变化考查氧化还原反应,反应前后元素化合价升、降的总数相等;从电子转移的角度来认识氧化还原反应,反应中氧化剂得电子的数目等于还原剂失电子的数目。氧化还原反应中从化合价变化到得失电子数守恒,体现了人们对化学反应由表及里,由片面到全面,逐渐深入本质的认识过程。
活动二:学习氧化还原反应中的守恒思想
1. 24 mL浓度为0.05 ml·L-1的Na2SO3溶液,恰好与20 mL浓度为0.02 ml·L-1的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )A. +6 B. +3 C. +2 D. 0
2. 氧化还原反应的配平。以________Cu+________HNO3(浓)===________Cu(NO3)2+________NO2+________H2O的配平为例:第一步:分析氧化剂、还原剂、氧化产物、还原产物的“纯粹”性,确定采用“逆向”配平比较方便。第二步:计算1 ml氧化产物、还原产物电子转移(化合价变化)情况。
第三步:根据“电子守恒”,n[Cu(NO3)2]∶n(NO2)=1∶2。 Cu+ HNO3(浓)=== 1 Cu(NO3)2+ 2 NO2+ H2O第四步:根据“原子守恒”确定其他化学计量数,并检验。 1 Cu+ 4 HNO3(浓)=== 1 Cu(NO3)2+ 2 NO2↑+ 2 H2O
(1) 配平下列氧化还原反应方程式:
说明:实际书写方程式时,“1”可以省去。
(2) 分享在配平氧化还原反应时,如何确定采用“顺向法”还是“逆向法”?【答案】 当氧化剂全部被还原、还原剂全部被氧化,采用“顺向法”;当氧化剂或还原剂中的元素只有部分被还原或氧化(如“歧化反应”),而氧化产物和还原产物是“纯粹”的氧化产物和还原产物,采用“逆向法”。
1. 缺项配平。缺项方程式:某些反应物或生成物的分子式未写出(缺项),它们一般为水、酸、碱。(1) 先根据化合价变化找出氧化剂、还原剂及还原产物、氧化产物。(2) 再根据质量守恒、电荷守恒确定所缺的物质的化学式(分子或离子),若反应物缺正电荷,一般加H+,生成物加水;若反应物缺负电荷,一般加OH-,生成物加水。(3) 最后观察配平其他物质系数。
活动三:氧化还原配平原理的拓展应用
2. 突破新情景下氧化还原反应方程式的书写。
高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_____________________________________________________。
练习:(1) 将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为___________________________________。(2) 一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和[B(OH)4]-,其离子方程式为____________________________________________________。
2Fe2++H2O2+2H+===2Fe3++2H2O
1. X盐和Y酸反应可放出有刺激性气味的气体Z,Z跟NaOH反应又得到X盐,Z氧化的最终产物为气体W,气体W溶于水又得到Y酸。则X盐和Y酸是( )A. Na2SO4和硫酸 B. Na2SO3和盐酸C. Na2CO3和盐酸 D. Na2SO3和硫酸
【解析】 X盐和Y酸反应,产生有刺激性气味的气体Z,A不反应,C产生无味CO2,排除A、C项;B、D产生SO2,SO2氧化生成SO3,SO3溶于水生成硫酸,排除B项。
2. 下列有关硫及其化合物的说法正确的是( )A. SO2、H2SO3均具有还原性,故浓硫酸能氧化SO2和H2SO3B. H2S与浓硫酸在不同的条件下反应的氧化产物只能是SO2
【解析】 硫元素的+4价与+6价之间无中间价态,所以SO2、H2SO3与浓硫酸不能发生氧化还原反应,A错误;H2S被浓硫酸氧化的产物可以是硫单质,B错误;S在O2中燃烧,只能得到SO2,D错误。
3. (2022·常州期末)下列物质间的转化不能通过一步化学反应实现的是( )A. S―→SO3 B. Cl2―→FeCl3C. Na2CO3―→NaHCO3 D. H2SO4―→SO2
【解析】 S燃烧只能生成SO2,A错误;铁与氯气反应生成FeCl3,B正确;Na2CO3溶液中通入CO2可生成NaHCO3,C正确;铜与浓硫酸反应可生成SO2,D正确。
4. 有关下列三个反应的叙述正确的是( )①2H2S+SO2===3S↓+2H2OA. 反应①说明SO2能与酸反应,具有碱性氧化物的性质B. 反应②改用稀硫酸,则能放出氢气C. 反应②和③说明S具有两性元素的性质D. 反应③中被氧化的硫元素与被还原的硫元素的质量之比为1∶2
【解析】 反应①中SO2作氧化剂,说明二氧化硫具有氧化性,不能从氧化还原反应的发生来判断酸性或碱性氧化物,A错误;反应②体现浓硫酸的强氧化性和S的还原性,S与稀硫酸不反应,B错误;单质硫只能与氧化性酸反应,不能与非氧化性酸反应,故不属于两性元素,C错误;反应③中化合价升高的硫原子与化合价降低的硫原子的个数之比为1∶2,即被氧化的硫元素与被还原的硫元素的质量之比为1∶2,D正确。
A. 配平后水的化学计量数为4 B. 反应后的溶液呈酸性C. 配平后氧化剂与还原剂的分子数之比为3∶28
7. 配平下列氧化还原反应方程式:
8. 已知亚硫酸钠在空气中能被氧气氧化成硫酸钠。某兴趣小组为检验亚硫酸钠固体是否变质及探究二氧化硫的性质,设计了如下实验:
Ⅰ. 检验Na2SO3是否变质。(1) 往圆底烧瓶A中加入待测液1.0 ml·L-1 Na2SO3溶液50 mL,溶液a为__________,溶液b为__________。(2) 向装置A中滴加足量溶液a,Na2SO3反应完全后,微热装置A使SO2完全逸出。实验前后测得C装置增重2.4 g,则Na2SO3溶液物质的量浓度为____________ml·L-1,Na2SO3固体______(填“已”或“未”)变质。
Ⅱ. 利用以上装置制备适量SO2,设计实验比较H2SO3、 H2CO3和H2SiO3的酸性强弱,并探究SO2的化学性质。
(1) 试剂X是________________________________________,试剂Y是____________,试剂Z是________________。(2) 关闭止水夹b,打开止水夹a,向装置中通入SO2,当观察到______________________________________________________,即证明H2CO3的酸性比H2SiO3强。(3) 关闭止水夹a,打开止水夹b,继续通入SO2,溴水褪色,说明SO2具有__________;写出相应的离子方程式:___________________________________。
酸性高锰酸钾溶液(其他答案合理即可)
品红溶液不褪色,Na2SiO3溶液中有白色沉淀生成
9. (2022·苏州高一期末)已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:(1) 写出“氧化”反应的离子方程式:________________________。
2Br-+Cl2===2Cl-+Br2
(2) 将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。①写出吸收反应的离子方程式:____________________________________________________。②吹出时,Br2吹出率与吸收塔中 SO2流量的关系如图所示。SO2流量过大,Br2吹出率反而下降的原因是________________________________________________________________________________________________________________________。
SO2流量过大,吸收塔内过量SO2
随着空气循环进入吹出塔与Br2反应生成氢溴酸,(部分溴未吹出)造成Br2吹出率下降
(3) 工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式:______Br2+______Na2CO3——______NaBrO3+______CO2+______________,当有1.204×1024个电子发生转移时,理论上参加反应Br2的质量为______________。(4) 对于较低浓度的溴水,可采用萃取的方法提取Br2。四氯化碳可作为Br2的萃取剂,其原因除四氯化碳不与溴反应外,还有____________________________________________________________________。
互不相溶,溴在四氯化碳中的溶解度远大于在水中的溶解度
化学必修 第一册第二单元 硫及其化合物的相互转化图文ppt课件: 这是一份化学必修 第一册第二单元 硫及其化合物的相互转化图文ppt课件,共26页。
高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化课文内容ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化课文内容ppt课件,共43页。PPT课件主要包含了课堂小结等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册专题4 硫与环境保护第二单元 硫及其化合物的相互转化背景图ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册专题4 硫与环境保护第二单元 硫及其化合物的相互转化背景图ppt课件,共44页。PPT课件主要包含了氧化还原,蓝紫色,有刺激性,√√×,含硫物质之间的转化等内容,欢迎下载使用。













