




- 苏教版(2019)高中化学必修第一册 专题4 硫与环境保护 第一单元 第1课时 二氧化硫的性质和应用课件PPT 课件 0 次下载
- 苏教版(2019)高中化学必修第一册 专题4 第一单元 第2课时 硫酸的工业制备 浓硫酸的性质课件PPT 课件 0 次下载
- 苏教版(2019)高中化学必修第一册 专题4 硫与环境保护 第三单元 防治二氧化硫对环境的污染课件PPT 课件 0 次下载
- 苏教版(2019)高中化学必修第一册 专题4 硫与环境保护 专题整合课件PPT 课件 0 次下载
- 苏教版(2019)高中化学必修第一册 专题5 微观结构与物质的多样性 第一单元 第1课时 元素周期律课件PPT 课件 0 次下载
苏教版 (2019)必修 第一册专题4 硫与环境保护第二单元 硫及其化合物的相互转化授课ppt课件
展开1.通过对“硫的转化”的学习增强变化观念素养水平。2.通过“氧化还原反应的配平”的学习,能形成模型认知,并能运用模型解释化学现象,揭示现象的本质和规律。
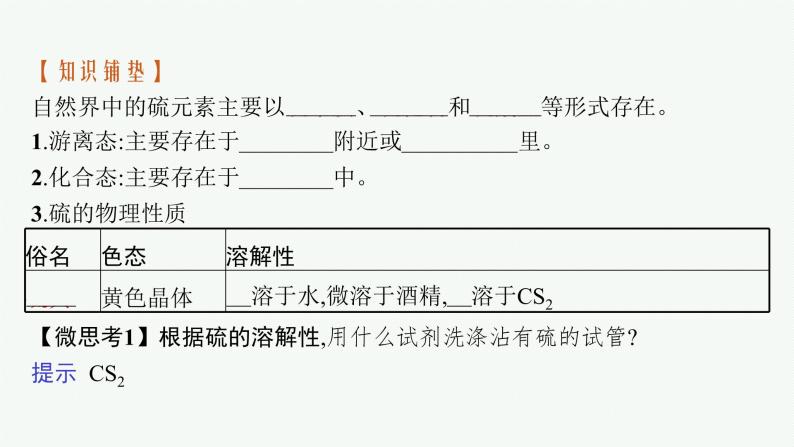
【知识铺垫】自然界中的硫元素主要以硫单质、硫化物和硫酸盐等形式存在。1.游离态:主要存在于火山喷口附近或地壳的岩层里。2.化合态:主要存在于金属矿石中。3.硫的物理性质
【微思考1】根据硫的溶解性,用什么试剂洗涤沾有硫的试管?提示 CS2
【必备知识】一、硫的化学性质1.还原性。与O2反应:S+O2 SO2,空气中燃烧火焰为淡蓝色。2.氧化性:与Fe反应:S+Fe FeS。与Cu反应:S+2Cu Cu2S【微思考2】硫与变价金属Fe、Cu反应,生成高价态硫化物还是低价态硫化物?为什么?提示 低价态硫化物,产物分别是FeS和Cu2S。因为硫的氧化性比较弱。
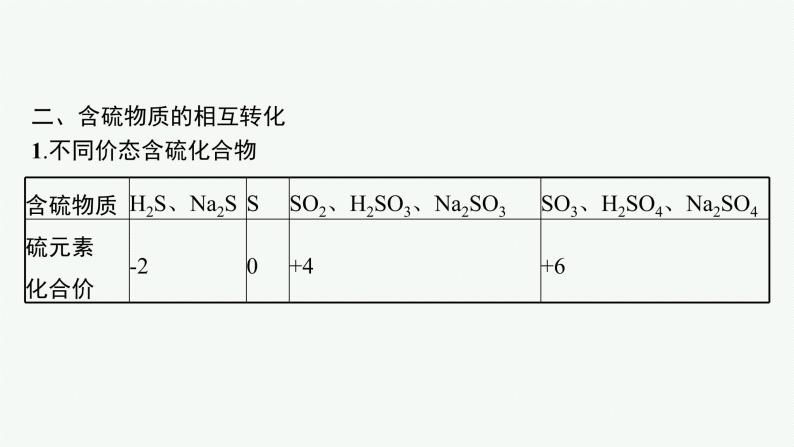
二、含硫物质的相互转化1.不同价态含硫化合物
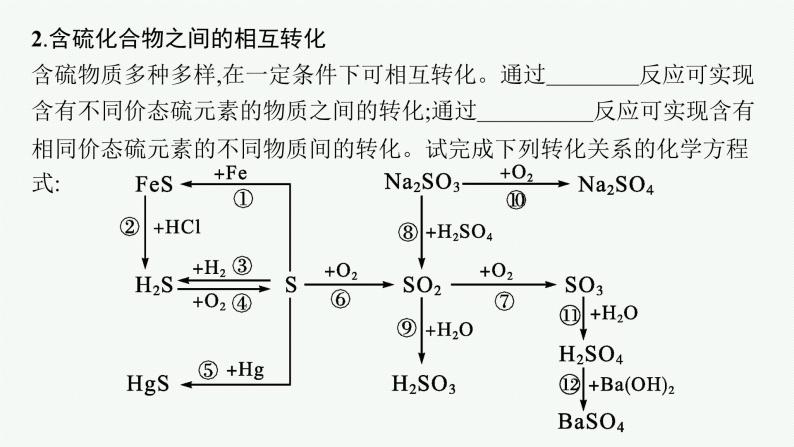
2.含硫化合物之间的相互转化含硫物质多种多样,在一定条件下可相互转化。通过氧化还原反应可实现含有不同价态硫元素的物质之间的转化;通过非氧化还原反应可实现含有相同价态硫元素的不同物质间的转化。试完成下列转化关系的化学方程式:
【微思考3】实验室中如何制取SO2?提示 Na2SO3与较浓硫酸反应。
三、氧化还原反应的配平1.标价态:标出化合价发生变化的元素的化合价。2.列变化:列出升降变化的数值。3.配氧还:根据升降总值,配出氧化剂和还原剂前面的化学计量数。4.得系数:根据原子守恒配平其他物质的系数,配平后将单线号改为等号。【微思考4】化学方程式的配平需要满足什么原则?提示 原子守恒,若是氧化还原反应还应该满足电子转移守恒。
【正误判断】判断下列说法是否正确,正确的打“√”,错误的打“×”。(1)硫与汞反应体现了硫的氧化性。( )(2)试管中残留的硫可以利用酒精洗涤。( )(3)Na2SO3固体长期露置于空气中会被氧气氧化而变质。( )(4)H2SO3只有还原性。( )(5)氯气可以将铁氧化到+3价,而硫只能将铁氧化到+2价,所以氯气的氧化性大于硫的氧化性。( )(6)SO3不能由S和O2化合而成。( )(7)SO2具有强还原性,能与具有强氧化性的浓硫酸反应。( )(8)稀硫酸因其+6价的S而具有强氧化性。( )
【问题探究】1.对于不慎洒落的汞应如何处理?提示 把硫粉撒在汞的表面。2.硫在足量O2中燃烧,可以生成SO3吗?提示 不可以,只生成SO2,与O2的量无关。
3.结合以前所学知识,你认为Cl2和S的氧化性哪个强?4.硫元素的常见化合价有哪些?各价态分别对应哪些物质?提示 -2价:H2S、Na2S、FeS等;+4价:SO2、H2SO3、Na2SO3等;+6价:SO3、H2SO4、Na2SO4等。5.SO2具有还原性,浓硫酸有强氧化性,为什么实验室可用浓硫酸干燥SO2气体?提示 因为SO2和浓硫酸中硫的化合价分别为+4、+6价,无中间价态,两者不反应。
【深化拓展】1.S与Cl2的比较
2.硫及其化合物的“价类二维图”
3.含有相同价态的硫元素的物质通过非氧化还原反应实现转化,而含有不同价态的硫元素的物质则通过氧化还原反应实现转化。
【素能应用】典例1如图是硫元素价态与含硫元素物质类别的二维坐标图,其中b、c、d、e分子中只含有一个S原子,下列说法错误的是( )A.物质j和物质e反应生成物质aB.物质b既有氧化性又有还原性C.物质d的浓溶液具有脱水性D.物质f可以与物质q发生氧化还原反应
答案 D解析 j是硫化氢,e是亚硫酸,二者可以发生归中反应得到单质硫,A项正确;b是二氧化硫,+4价的硫化合价既可以升高又可以降低,因此既有氧化性又有还原性,B项正确;d是硫酸,浓硫酸具有脱水性,C项正确;硫酸盐无氧化性,因此不能和硫化物发生氧化还原反应,D项错误。
规律方法 硫及含硫化合物的相互转化
变式训练 1有关下列三个反应的叙述,正确的是( )
A.反应①说明SO2能与酸反应,具有碱性氧化物的性质B.反应②改用稀硫酸,则能放出氢气C.反应②和③说明S具有两性元素的性质D.反应③说明S既具有氧化性又具有还原性
答案 D解析 反应①SO2作氧化剂,说明二氧化硫具有氧化性,不能从氧化还原方面判断是酸性或碱性氧化物;反应②体现浓硫酸的强氧化性,S的还原性;反应③硫的化合价既有升高,又有降低,因此既体现了还原性,又体现了氧化性。
【问题探究】1.配平原则(1)原子守恒原则:反应物和生成物各元素及其原子个数不变。(2)得失电子守恒原则:氧化剂所得电子总数等于还原剂所失电子总数。
2.方法步骤以Cu+HNO3(浓)——Cu(NO3)2+NO2↑+H2O为例“一标”——标出反应前后化合价有变化的元素的化合价。________________________________________“二等”——通过最小公倍数法使化合价升降总数相等。________________________________________“三定”——确定氧化剂和还原剂、氧化产物和还原产物的化学计量数。________________________________________“四查”——用观察法配平其他物质的化学计量数,并检查原子个数是否相等,配平后将短线改为等号。________________________________________
【深化拓展】氧化还原反应方程式的配平依据和步骤(1)氧化还原反应方程式配平的依据是电子守恒。(2)氧化还原反应方程式配平的步骤:标价态、列变化、令相等、定系数。(3)根据化合价升降只能确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,其他物质的化学计量数需运用观察法、奇偶法、守恒法等来确定。
【素能应用】典例2工业上将Na2CO3和Na2S配成溶液,再通入SO2可制取Na2S2O3,同时放出CO2。下列说法不正确的是( )A.上述反应中氧化剂与还原剂的物质的量比是2∶1B.上述反应中的Na2CO3和Na2S的物质的量比最佳是1∶2C.每生成1 ml Na2S2O3转移4 ml 电子D.Na2S2O3既是氧化产物,又是还原产物
答案 C解析 反应的化学方程式为2Na2S+Na2CO3+4SO2 === 3Na2S2O3+CO2,反应中Na2S为还原剂,SO2为氧化剂,则氧化剂与还原剂的物质的量之比为2∶1,A项正确;根据反应的方程式,反应中的Na2CO3和Na2S的物质的量比最佳是1∶2,B项正确;反应中每生成1 ml Na2S2O3,转移 ml电子,C项错误;由反应方程式中S元素的化合价变化可知,硫元素既被氧化又被还原,Na2S2O3既是氧化产物,又是还原产物,D项正确。
规律方法 氧化还原反应的计算电子守恒法解题的步骤是:首先找出氧化剂、还原剂及其物质的量以及每摩尔氧化剂、还原剂得失电子的量,然后根据电子守恒列出等式。计算公式如下:n(氧化剂)×得电子原子数×原子降价数=n(还原剂)×失电子原子数×原子升价数。
答案 C解析 已知 中Fe的化合价是+6价,由离子中各元素的化合价的代数和等于离子所带电荷数可得n=2,故A正确;反应中Cl元素的化合价从+1价降低到-1价,则每产生1 ml Cl-,转移2 ml 电子,故B正确;若n=2,Fe元素的化合价由+3价升高到+6价,Fe(OH)3作还原剂,Cl元素的化合价由+1价降低到-1价,ClO-作氧化剂,则反应中氧化剂与还原剂的物质的量之比为3∶2,故C错误; 具有强氧化性,能杀菌消毒,其还原产物为Fe3+时,Fe3+可与水反应生成具有吸附性的Fe(OH)3胶体,可用作新型自来水的消毒剂和净水剂,故D正确。
变式训练 2-2储氢纳米碳管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。(1)请用上述物质填空,并配平化学方程式:(2)上述反应中氧化剂是 (填化学式),被氧化的元素是 (填元素符号)。 (3)H2SO4在上述反应中表现出来的性质是 (填字母)。 A.氧化性B.氧化性和酸性 C.酸性D.还原性和酸性
答案 (1)3 2 K2Cr2O7 8 3 CO2↑ 2 K2SO4 2 8 (2)K2Cr2O7 C (3)C
1.下列说法不正确的是( )A.硫是一种淡黄色的不溶于水的晶体B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.硫易燃烧,其燃烧产物是大气污染物之一D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫答案 D解析 硫在空气和纯氧中燃烧都生成SO2,SO2在催化剂存在且加热条件下与O2反应生成SO3,D项错误。
2.关于硫的叙述正确的是( )A.硫的非金属性较强,所以主要以化合态存在于自然界中B.SO2气体通入BaCl2溶液中会产生白色沉淀C.硫与金属或非金属反应时均作氧化剂D.3.2 g硫与6.4 g铜反应能得到9.6 g纯净硫化物
答案 A解析 硫的非金属性较强,易形成硫化物或硫酸盐,因此硫在自然界中主要以硫化物和硫酸盐的形式存在,A项正确;SO2不与BaCl2溶液反应,B项错误;硫单质中硫元素为零价,是中间价态,与金属反应时显氧化性,与非金属性比它强的非金属反应时硫显还原性,C项错误;2Cu+S === Cu2S,3.2 g硫和6.4 g铜反应,其物质的量之比为1∶1,说明硫过量,根据铜的量计算,可知1.6 g S和6.4 g Cu恰好完全反应,还有1.6 g S未反应,得到的物质是1.6 g 的S和8 g的Cu2S,为混合物,D项错误。
3.配平下列方程式:
4.Na2SO3中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、H2SO4溶液、NaOH溶液、氨水。(1)要证明Na2SO3具有还原性,应选用的试剂有 ;看到的现象是 。反应的离子方程式为 。 (2)要证明Na2SO3具有氧化性,应选用的试剂有 ;看到的现象是 。反应的离子方程式为 。 (3)要证明H2SO3酸性小于H2SO4,选用的试剂有 ,反应的现象是 ,反应的离子方程式为 。
解析 (1)要证明Na2SO3具有还原性,应选用具有氧化性的物质溴水。向Na2SO3溶液中滴加溴水,溴水褪色,说明Na2SO3具有还原性。(2)要证明Na2SO3具有氧化性,应选用还原性物质Na2S溶液。向Na2SO3溶液中滴加Na2S溶液,若溶液出现浑浊,说明有单质硫生成,说明Na2SO3具有氧化性。(3)要证明H2SO3酸性小于H2SO4,应选用的试剂为Na2SO3溶液和H2SO4,向Na2SO3溶液中滴加硫酸,若有气泡产生,说明H2SO3酸性小于H2SO4。
高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化课文内容ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化课文内容ppt课件,共43页。PPT课件主要包含了课堂小结等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化多媒体教学ppt课件: 这是一份苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化多媒体教学ppt课件,共44页。
高中化学苏教版 (2019)必修 第一册专题4 硫与环境保护第二单元 硫及其化合物的相互转化背景图ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册专题4 硫与环境保护第二单元 硫及其化合物的相互转化背景图ppt课件,共44页。PPT课件主要包含了氧化还原,蓝紫色,有刺激性,√√×,含硫物质之间的转化等内容,欢迎下载使用。













