
2024届高三新高考化学大一轮专题训练---盐类的水解
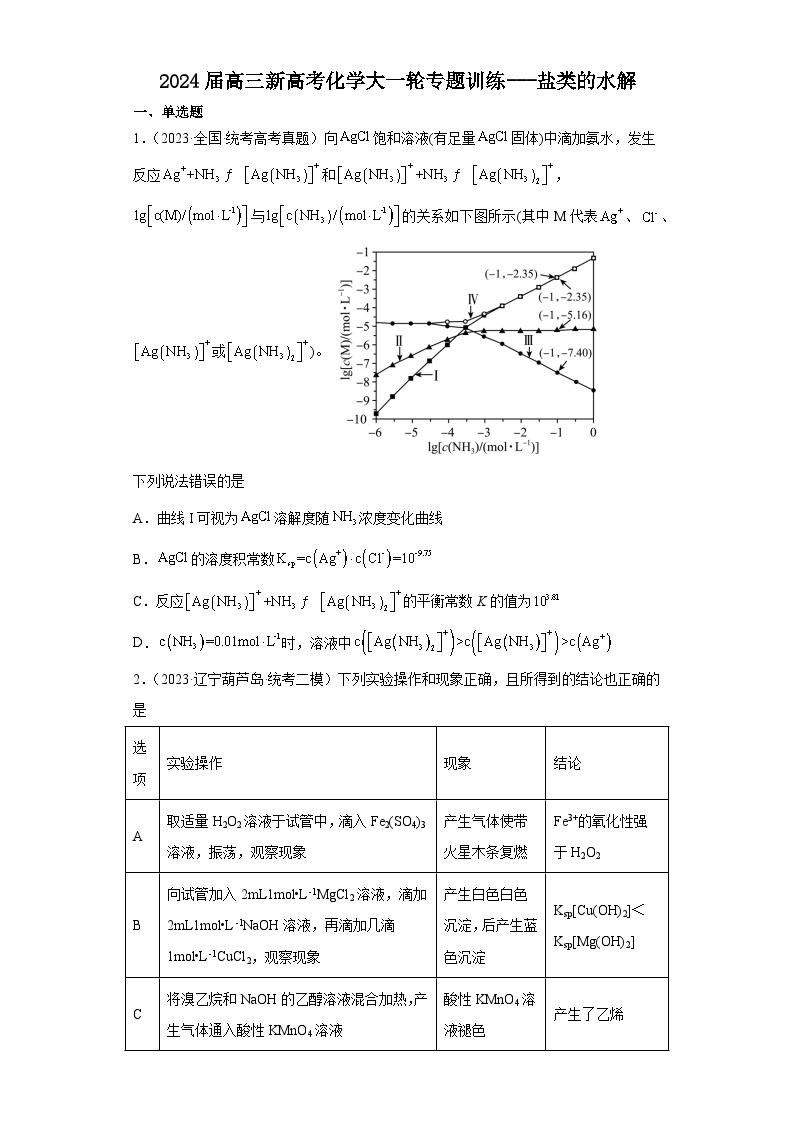
展开1.(2023·全国·统考高考真题)向饱和溶液(有足量固体)中滴加氨水,发生反应和,与的关系如下图所示(其中M代表、、或)。
下列说法错误的是
A.曲线I可视为溶解度随浓度变化曲线
B.的溶度积常数
C.反应的平衡常数K的值为
D.时,溶液中
2.(2023·辽宁葫芦岛·统考二模)下列实验操作和现象正确,且所得到的结论也正确的是
A.AB.BC.CD.D
3.(2023春·重庆渝中·高三重庆巴蜀中学校考阶段练习)室温时,通过实验探究溶液的性质,操作及现象如下表所示:
下列说法正确的是
A.溶液中存在:
B.由实验1可得:
C.由实验2所得溶液:
D.实验3所得溶液中水的电离程度大于溶液
4.(2023·安徽·校联考三模)下列实验操作或方案一定能达到相应实验目的的是
A.AB.BC.CD.D
5.(2023·山东济南·山东省实验中学校考模拟预测)同温同压下,研究Cl2分别在不同浓度的盐酸和NaCl溶液中的溶解度(用溶解Cl2的物质的量浓度表示)变化如图所示。已知氯气在溶解时存在以下
①Cl2(aq)+H2OHClO+H++Cl- K1=4.2×10-4
②Cl2(aq)+Cl-Cl3(aq) K2=0.19
③HClOH++C1O- Ka=3.2×10-8
下列说法错误的是
A.随着NaCl浓度的增大,Cl2溶解度减小,溶液中减小
B.随着盐酸浓度的增大,反应①被抑制,反应②为主要反应从而促进Cl2溶解
C.a点时,c(H+)>c(Cl-)>c(Cl3-)>c(ClO-)
D.b点时,c(Na+)
A.a对应溶液的c(H+)小于b
B.b对应溶液的c()=2.6×10-6ml•L-1
C.向a点溶液中通入CO2可使a点溶液向b点溶液转化
D.a对应的溶液中存在:2c(Ba2+)+c(Na+)>3c()+c(Cl-)
7.(2023·湖南长沙·雅礼中学校考模拟预测)配离子的稳定性可用衡量,如的。一定温度下,向硝酸银溶液中滴入稀氨水,发生反应,溶液中与的关系如图所示,其中、(X代表或。已知该温度下。下列说法正确的是
A.图中代表的是
B.该溶液中
C.向该溶液中滴入稀硝酸,增大
D.溶于氨水时平衡常数为
8.(2023春·福建南平·高三福建省南平市高级中学校考期中)中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识错误的是
A.AB.BC.CD.D
9.(2023春·湖北·高三校联考阶段练习)下列对有关实验现象的解释或结论正确的是
A.AB.BC.CD.D
10.(2023春·河北石家庄·高三校联考阶段练习)下列实验操作及现象和结论都正确的是
A.AB.BC.CD.D
11.(2023秋·广东梅州·高三广东梅县东山中学校联考期末)下列实验操作、实验现象和实验结论均正确的是
A.AB.BC.CD.D
12.(2023·全国·高三统考专题练习)下列各组离子能大量共存,且加入相应试剂后发生反应的离子方程式正确的是
A.AB.BC.CD.D
13.(2023·全国·高三统考专题练习)下列实验操作能达到相应实验目的的是
A.AB.BC.CD.D
14.(2023·湖南娄底·统考模拟预测)某小组设计实验测定胆矾()纯度(杂质不参与反应):称取胆矾样品溶于蒸馏水,加入足量KI溶液,充分反应后,过滤。把滤液配制成250mL溶液,准确量取配制溶液25.00mL于锥形瓶中,滴加2滴溶液X,用溶液滴定至终点,消耗滴定液Vml。涉及有关反应如下:,。下列叙述正确的是
A.X为甲基橙溶液
B.滴加溶液时选择滴定管如图所示
C.滴定管装液之前最后一步操作是水洗
D.胆矾纯度为
二、非选择题
15.(2023·上海嘉定·统考一模)氢氧化钠溶液处理铝土矿井过滤,得到含铝酸钠的溶液。向该溶液中通入二氯化碳,有下列反应:2Na[Al(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。
(1)上述五种物质中沸点最低物质的结构式为______,由上述物质中的两种元素按原子个数比1:1形成的离子化合物的电子式为______(写一例)。
(2)请将Na、Al、O的原子半径和简单离子的半径分别按由小到大的顺序排列:______(用元素符号表示),______(用离子符号表示)。
(3)①在上述混合物的组成元素中,与铝元素同周期的另一元素的原子共有______种不同能级的电子,该元素的最高价氧化物对应水合物与铝单质反应的离子反应方程式为______。
②已知AlN的熔点2200℃,AlCl3的熔点194℃,二者常温下均为固体,其熔点差异较大的原因是______。
(4)NaHCO3溶液中各含碳微粒按浓度由大到小的顺序排列______。
16.(2022秋·辽宁·高三校联考期末)亚磷酸是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。
(1)可由水解(认为不可逆)所得的溶液在低温下蒸去盐酸、脱水冷却制得。请写出水解的化学方程式:_____________________。
(2)室温下,向溶液中加入蒸馏水稀释至,下列说法正确的是______(填标号)。
A.的电离程度减小B.水电离出的增大
C.减小D.减小
(3)设计实验证明的酸性比碳酸强:___________________________。
(4)常温下,已知溶液中含磷粒子的浓度之和为,溶液中含磷粒子的物质的量分数与溶液的关系如图所示。
①随溶液的变化用曲线______(填“1”、“2”或“3”)表示。
②将溶液与等浓度的溶液混合后得到的溶液呈______(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为______。
③反应的平衡常数______。
17.(2023春·上海宝山·高三上海市行知中学校考阶段练习)如图所示的装置是带有可上下移动的活塞的密闭容器,其中盛有饱和 H2S 溶液,并与 H2S 气体建立溶解平衡。
(1)饱和 H2S 溶液中存在_______种微粒。
(2)关闭 c 口,若容器中活塞由 a 压到 b 位置,则H2S 溶液中,_______离子浓度增大,而_______离子浓度减小。
(3)在压强不变时,由 c 处通入一定量N2,则溶液中 H+浓度将_______。(填变大,变小,不变)
(4)若从 c 处通入 SO2气体充分反应,并达到饱和,溶液中 H+浓度将_______。
A.不断增大B.先减小,后增大到某值
C.不变D.先增大,后减小到某值
(5)将等浓度等体积的氢硫酸和氢氧化钠溶液混合,写出反应的离子方程式_______所得溶液中阴离子浓度由大到小的次序为_______
18.(2023·高三课时练习)水的电离方程式为:H2O⇌H++OH-,其平衡移动的分析,符合勒夏特列原理。
选项
实验操作
现象
结论
A
取适量H2O2溶液于试管中,滴入Fe2(SO4)3溶液,振荡,观察现象
产生气体使带火星木条复燃
Fe3+的氧化性强于H2O2
B
向试管加入2mL1ml•L-1MgCl2溶液,滴加2mL1ml•L-1NaOH溶液,再滴加几滴1ml•L-1CuCl2,观察现象
产生白色白色沉淀,后产生蓝色沉淀
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
C
将溴乙烷和NaOH的乙醇溶液混合加热,产生气体通入酸性KMnO4溶液
酸性KMnO4溶液褪色
产生了乙烯
D
向滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液
溶液红色逐渐褪去
BaCl2溶液呈酸性
实验
实验操作及现象
1
测定溶液的pH,测得溶液pH<7
2
向溶液中加入等体积的溶液,产生白色沉淀(草酸钙的)
3
向溶液中滴加少量NaOH溶液,加热产生刺激性气味气体,后冷却至室温
选项
实验操作或方案
实验目的
A
将AlCl3溶液加热蒸干
制备无水AlCl3
B
将含H2S的HCl气体通过CuSO4溶液
除去HCl中的H2S
C
测定NaA溶液和NaB溶液的pH
比较HA和HB的酸性强弱
D
将一滴含酚酞的食盐水滴到铁片上,观察液滴周围的颜色变化
证明Fe能发生吸氧腐蚀
常见古诗文记载
化学知识
A
《本草纲目》中“石碱”条目下写道:“彼人采蒿蓼之属,晒干烧灰,以水淋汁∙∙∙∙∙∙久则凝淀如石,浣衣发面,亦去垢发面”
利用石碱水解显碱性去油污
B
《本草纲目拾遗》中对强水的记载:“性最猛烈,能蚀五金,其水至强∙∙∙∙∙∙惟玻璃可盛”
强水为氢氟酸
C
《本草纲目》记载烧酒制法:“用浓酒和糟入甑,蒸令气上∙∙∙∙∙∙其清如水,味极浓烈,盖酒露也”
涉及的操作是蒸馏
D
《本草经集注》中记载鉴别硝石(KNO3)和朴硝(Na2SO4)的方法:“强烧之,紫青烟起∙∙∙∙∙∙云是真硝石也”
利用焰色反应区别硝石和朴硝
选项
实验操作
现象
解释或结论
A
分别测定NaF溶液和NaCN溶液的pH
NaF溶液的pH约为9,
NaCN溶液的pH约为8
HCN电离出的能力比HF的强
B
向苯的样品中加入浓溴水,振荡
未出现白色沉淀
说明苯的样品中不存在苯酚
C
将25℃的溶液加热,用数字传感器监测35℃~50℃溶液pH变化
溶液的pH逐渐减小
温度升高,的水解增大程度小于水的电离增大程度,导致最终浓度升高
D
向某补血口服液中滴加几滴酸性溶液
酸性溶液紫色褪去
该补血口服液中一定含有
选项
实验操作及现象
结论
A
向10滴中加入溶液,振荡后加热;再滴加溶液,无白色沉淀产生
没有发生水解
B
向溶液中滴入2滴溶液,产生白色沉淀;再滴入2滴溶液,又产生红褐色沉淀
C
向溶液中滴入酚酞试液,溶液变红;再加入溶液,产生白色沉淀且红色褪去
溶液中存在水解平衡
D
将黄色溶液X滴在碘化钾淀粉试纸上,试纸变蓝
X中一定含有
选项
实验操作
实验现象
实验结论
A
往溶液中通入气体
有沉淀生成
沉淀是
B
往平衡体系中,加入KCl晶体
溶液颜色不变
加入少量KCl晶体,不会影响该化学平衡
C
在两个烧杯中分别盛有等体积、等浓度的烧碱溶液和氨水,插入电极,连接灯泡,接通电源,分别进行导电实验
盛有烧碱溶液的灯泡亮度大
强电解质导电能力大于弱电解质
D
相同温度下,分别向NaA和NaB稀溶液中滴加酚酞试液
NaB溶液红色更深
酸性:HA>HB
选项
离子组
加入试剂
加入试剂后发生的离子反应
A
、、
溶液
B
、、
溶液
C
、、
溶液
D
、、
NaOH溶液
选项
实验操作
实验目的
A
向食盐溶液中滴加淀粉溶液
检验食盐中是否含碘元素
B
用pH计测同浓度的溶液和NaClO溶液的pH
比较和HClO的酸性强弱
C
用装有标准浓度盐酸的酸式滴定管滴定一定体积未知浓度的氨水,用酚酞做指示剂
用盐酸做标准液测定氨水的浓度
D
向久置的粉末中滴加过量的盐酸,产生无色气体
检验是否变质
H2O⇌H++OH-
移动方向
c(H+)
c(OH-)
水的电离程度
Kw
①升温
_______
_______
_______
_______
_______
②通入HCl(g)
_______
_______
_______
_______
_______
③通入氨气
_______
_______
_______
_______
_______
④加Na
_______
_______
_______
_______
_______
⑤加FeCl3(s)
_______
_______
_______
_______
_______
⑥加入NaHSO4(s)
_______
_______
_______
_______
_______
参考答案:
1.A
【分析】氯化银饱和溶液中银离子和氯离子的浓度相等,向饱和溶液中滴加氨水,溶液中银离子浓度减小,氯离子浓度增大、一氨合银离子增大,继续滴加氨水,一氨合银离子增大的幅度小于二氨合银离子,则曲线I、Ⅱ、Ⅲ、Ⅳ分别表示二氨合银离子、一氨合银离子、银离子、氯离子与氨气浓度对数变化的曲线。
【详解】A.氨的浓度较小时AgCl(s) Ag+(aq)+Cl-(aq),浓度较大时AgCl(s) +2NH3(aq)+Cl-(aq),氯化银的溶解度曲线应与氯离子的曲线吻合,应该为曲线Ⅳ,故A错误;
B.由图可知,c(NH3)=10-1ml/L时,c(Cl-)=10-2.35ml/L, c(Ag+)=10-7.40ml/L,则氯化银的溶度积为10-2.35×10-7.40=10-9.75,故B正确;
C.由图可知,氨分子浓度对数为-1时,溶液中二氨合银离子和一氨合银离子的浓度分别为10-2.35ml/L和10-5.16ml/L,则的平衡常数K=
==,故C正确;
D.由分析可知,曲线I、Ⅱ、Ⅲ、Ⅳ分别表示二氨合银离子、一氨合银离子、银离子、氯离子与氨气浓度对数变化的曲线,则时,溶液中,故D正确;
故选A。
2.B
【详解】A.适量H2O2溶液中滴入Fe2(SO4)3溶液,产生的能使带火星木条复燃的气体为O2,则加入的Fe2(SO4)3加快H2O2的分解速率,为该分解反应的催化剂,A不正确;
B.2mL1ml•L-1MgCl2溶液中滴加2mL1ml•L-1NaOH溶液,反应后,MgCl2有剩余,再滴加几滴1ml•L-1CuCl2,白色沉淀转化为蓝色沉淀,则表明Mg(OH)2转化为Cu(OH)2,从而得出结论Ksp[Cu(OH)2]<Ksp[Mg(OH)2],B正确;
C.将溴乙烷和NaOH的乙醇溶液混合加热,产生的气体中混有乙醇,乙醇也能使酸性KMnO4溶液褪色,所以产生的气体中不一定含有乙烯,C不正确;
D.滴有酚酞的Na2CO3溶液呈红色,主要发生反应+H2O+OH-,逐滴加入BaCl2溶液,与反应生成BaCO3沉淀,从而促进平衡逆向移动,溶液的颜色变浅,BaCl2为强酸强碱盐,其水溶液呈中性,D不正确;
故选B。
3.C
【详解】A.溶液中存在物料守恒,电荷守恒,所以溶液中存在,A错误;
B.溶液的<7,溶液显酸性,但由于铵根的浓度是草酸根浓度的2倍,所以不能说明二者水解程度的相对大小,B错误;
C.混合时CaCl2过量,混合后溶液中钙离子浓度为,所以
,C正确;
D.加入NaOH后溶液为草酸钠溶液没有之前草酸铵双水解对的电离促进程度大,D错误;
故答案为:C。
4.D
【详解】A.AlCl3是强酸弱碱盐,在溶液中会发生盐的水解反应产生Al(OH)3、HCl,水解反应的化学方程式为:AlCl3+3H2OAl(OH)3+3HCl,将溶液加热蒸干,HCl挥发逸出,导致平衡正向移动,最终得到的固体是Al(OH)3,而不能得到AlCl3固体,A不选;
B.将含H2S的HCl气体通过CuSO4溶液,HCl易溶于水,H2S和CuSO4反应生成CuS沉淀,B不选;
C.相同条件下,测定相同浓度的NaA溶液和NaB溶液的pH,可比较HA和HB的酸性强弱,C不选;
D.食盐水为中性,铁发生吸氧腐蚀,则正极附近溶液显碱性,遇酚酞变红,可证明Fe能发生吸氧腐蚀,D选;
故选D。
5.A
【详解】A.同一溶液中,随着NaCl浓度的增大,Cl2溶解度减小,反应①逆向移动,溶液中的氢离子浓度减小,所以增大,故A错误;
B.盐酸和氯化钠溶液都能电离出氯离子,但在氯化氢的溶液中,随着氢离子浓度增大,反应①被抑制,随着氯离子浓度的增大,氯气的溶解度增大,说明此时主要发生反应②,反应②平衡正向移动,促进氯气的溶解,故B正确;
C.a点溶液中的氯化氢的浓度为3ml/L,氯气的浓度约为0.81ml/L,氯化氢为强电解质,完全电离,电离出的氯离子部分与氯气结合生成,所以有c(H+)>c(Cl-)>c(Cl),反应②的平衡常数远大于反应①,且次氯酸的电离微弱,所以c(Cl)>c(ClO-),综上所述,有c(H+)>c(Cl-)>c(Cl)>c(ClO-),故C正确;
D.b点溶液中溶质为3ml/L的氯化钠和0.4ml/L的氯气,由氯化钠电离出钠离子和氯离子浓度相等即c(Na+)=c0(Cl-),根据元素守恒有c1(Cl2)=c(HClO)+c(ClO-),故反应①生成的c2(Cl-)=c(HClO)+c(ClO-),反应②的c3(Cl-)=c(Cl),所以溶液中的c(Cl-)=c0(Cl-)+c2(Cl-)− c3(Cl-),所以c0(Cl-)=c(Cl-)− c2(Cl-)+c3(Cl-),最后可得c(Na+)
【点睛】本题考查化学平衡移动以及图像问题,题目难度中等,注意根据图像判断外界条件对平衡移动的影响,注意氯水中的平衡移动问题。
6.B
【详解】A.a点时,lg=0,=1,=5.6×10-11,则c(H+)=5.6×10-11,b点时,lg=2,=100,=5.6×10-11,则c(H+)=5.6×10-9,所以a点对应溶液的c(H+)小于b,A正确;
B.b对应溶液中,c()=ml•L-1=2.6×10-4ml•L-1,=100,c()=2.6×10-2ml•L-1,B错误;
C.向a点溶液中通入CO2,发生反应+CO2+H2O2,从而使增大,可使a点溶液向b点溶液转化,C正确;
D.a对应的溶液中,=1,c()=c(),此时溶液呈碱性,c(H+)<c(OH-),依据电荷守恒可得2c(Ba2+)+c(Na+)+c(H+)=c(OH-)+2c()+c()+c(Cl-),则存在:2c(Ba2+)+c(Na+)>3c()+c(Cl-),D正确;
故选B。
7.D
【详解】A.越大,越小,越多,因此代表的是,故A错误;
B.溶液中根据电荷守恒有,故B错误;
C.向体系中滴入稀硝酸,与反应生成,减小,的平衡逆向移动,减小,故C错误;
D.a点,,则,则对于反应,,故D正确。
故答案选D。
8.B
【详解】A.彼人采蒿蓼之属,晒干烧灰,以水淋汁∙∙∙∙∙∙,则石碱是碳酸钾,碳酸钾水解显碱性,油污在碱性条件下水解,因此利用石碱水解显碱性去油污,故A正确;
B.强水为硝酸,故B错误;
C.用浓酒和糟入甑,蒸令气上∙∙∙∙∙∙其清如水,主要涉及蒸馏过程,将乙醇蒸出,故C正确;
D.硝石(KNO3)和朴硝(Na2SO4)两者含金属离子不同,因此利用焰色反应区别硝石和朴硝,故D正确。
综上所述,答案为B。
9.C
【详解】A.NaF溶液和NaCN溶液浓度不确定,无法比较,A错误
B.可能生成的三溴苯酚溶解于苯中,所以看不到沉淀,B错误
C.加热时溶液的pH变化是碳酸钠水解平衡移动和水的电离平衡移动的共同作用的结果,C正确
D.溶液褪色只能说明口服液中有还原性物质,不能证明存在,D错误;
故选C。
10.C
【详解】A.中加入溶液,振荡后加热,发生水解,生成H和,检验应先加入足量稀硝酸中和过量的,使溶液呈酸性后再加入溶液,故A错误;
B.向溶液中滴入2滴溶液,产生白色沉淀,溶液中过量,再滴入2滴溶液后,过量的与反应产生红褐色沉淀,而不是沉淀转化为沉淀,无法判断出两种沉淀的溶度积大小,故B错误;
C.溶液中存在水解平衡,溶液呈碱性使酚酞变红,滴加溶液后,发生反应,使的水解平衡逆向移动,红色褪去,故C正确;
D.黄色溶液X滴在碘化钾淀粉试纸上,试纸变蓝,X中可能含有,X也可能是是稀的溴水等,故D错误;
选C。
11.B
【详解】A.具有强氧化性,往溶液中通入气体生成CaSO4沉淀,故A错误;
B.反应的离子方程式为,平衡体系中加入KCl晶体,平衡不移动,溶液颜色不变,故B正确;
C.浓度未知的强电解质和弱电解质溶液的浓度是否相等,强电解质溶液的导电能力不一定大于弱电解质,故C错误;
D.没有明确NaA和NaB溶液的浓度是否相等,相同温度下,分别向NaA和NaB稀溶液中滴加酚酞试液,NaB溶液红色更深,不能说明B-水解程度大于A-,所以酸性:HA不一定大于HB,故D错误;
选B。
12.B
【详解】A.过氧化氢和碘离子反应生成碘单质和水,离子方程式为,A错误;
B.铝离子和碳酸氢根离子双水解生成氢氧化铝沉淀和二氧化碳,B正确;
C.银离子和硫离子生成硫化银沉淀,不共存,C错误;
D.和生成红色物质,不共存,D错误;
故选B。
13.B
【详解】A.加淀粉溶液是检验碘单质,而不能检验食盐中的碘元素,不能达到相应实验目的,A不符合题意;
B.用pH计测同浓度的溶液和NaClO溶液的pH,根据越弱越水解原理,可以比较和HClO的酸性强弱,能达到相应实验目的,B符合题意;
C.盐酸和氨水生成强酸弱碱盐,应该使用甲基橙做指示剂,不能达到相应实验目的,C不符合题意;
D.过氧化钠能和盐酸溶液反应生成氧气,故不能检验是否变质,不能达到相应实验目的,D不符合题意;
故选B。
14.D
【详解】A.滴定反应为碘单质与硫代硫酸钠反应,因为碘单质遇淀粉变蓝,则指示剂X为淀粉溶液,A项错误;
B.水解而使其溶液显碱性,因此滴加该溶液要选择碱式滴定管,B项错误;
C.滴定管装液之前最后一步操作是润洗,即用待装液润洗滴定管,C项错误;
D.根据关系式:可知,胆矾纯度为,D项正确;
答案选D。
15.(1) (或者)
(2)
(3) 4 为原子晶体,为共价化合物,为分子晶体,所以熔点较高
(4)
【详解】(1)在、、、、五种物质中,为气体,沸点最低;在这些物质中的钠元素和氧元素,可以形成原子个数比1:1的离子化合物或者钠元素和氢元素形成,电子式为: (或者);
(2)一般情况下,电子层数越多的粒子,半径越大,电子层数相同的粒子,核电荷数越多,粒子半径越小,所以原子半径的:,离子半径:;
(3)①在上述物质所含的元素中,与铝元素同周期的元素为,其电子排布式为,有4种不同能级的电子,最高价氧化物的水化物为,与铝单质反应的离子方程式为:;
②因为为原子晶体,为共价化合物,为分子晶体,所以熔点远高于熔点较低;
(4)溶液中,,,,因为溶液显碱性,所以水解程度大于电离程度,所以溶液中离子浓度的大小为:。
16.(1)
(2)BD
(3)测定同浓度溶液和溶液的,溶液的小,证明的酸性强
(4) 3 酸
【详解】(1)水解生成和盐酸,方程式为:;
(2)是二元弱酸,发生电离:,,A.加入蒸馏水稀释,平衡正向移动,电离程度增大,A正确;B.加水稀释,溶液中的减小,水的电离程度增大,水电离出的增大,B正确;C.,,加水稀释,K不变,减小,增大,C错误;D.加水稀释,溶液中的减小,增大,减小,D正确;故选BD;
(3)要证明的酸性比碳酸强,可以测定同浓度溶液和溶液的pH,溶液的小,证明的酸性强;
(4)①是二元弱酸,发生电离:,,随着溶液中的逐渐增大,逐渐减小,逐渐增大后又减小,逐渐增大,所以随溶液的变化用曲线3;
②是二元弱酸,与氢氧化钠溶液反应:,,将溶液与等浓度的溶液混合后得到的溶液为:和物质的量之比为1:1,电离,,水解,电离,,根据图示信息,溶液显酸性,溶液中离子浓度由大到小的排列顺序为:;
③,,,,反应为第一步减第二步,所以平衡常数。
17.(1)6
(2) HS-、S2−、H+ OH-
(3)减小
(4)B
(5) H2S+OH-=HS-+H2O c(HS-) >c(OH-) >c(S2−)
【详解】(1)饱和 H2S 溶液中存在H2S、HS-、S2−、H+、OH-、H2O共6种微粒;故答案为:6。
(2)关闭 c 口,若容器中活塞由 a 压到 b 位置,则H2S 溶液中,H2S(aq)物质的量浓度增大,第一步电离平衡正向移动,第二步电离平衡正向移动,因此HS-、S2−、H+离子浓度增大,而OH-离子浓度减小;故答案为:HS-、S2−、H+;OH-。
(3)在压强不变时,由 c 处通入一定量N2,顶盖将向上移动,H2S(aq)物质的量浓度减小,第一步电离平衡逆向移动,因此溶液中 H+浓度将变小;故答案为:减小。
(4)若从 c 处通入 SO2 气体充分反应,并达到饱和,先是硫化氢和二氧化硫反应生成硫沉淀和水,因此氢离子浓度减小,后来二氧化硫溶于水反应生成亚硫酸,由于亚硫酸的酸性大于硫化氢的酸性,因此溶液中 H+浓度将增大到某值;故答案为:B。
(5)将等浓度等体积的氢硫酸和氢氧化钠溶液混合,由于硫化氢是二元弱酸,因此两者反应生成硫氢化钠,其反应的离子方程式H2S+OH-=HS-+H2O,HS-水解是微弱的且水解程度大于电离程度,因此氢氧根浓度大于硫离子浓度,则所得溶液中阴离子浓度由大到小的次序为c(HS-) >c(OH-) >c(S2−);故答案为:H2S+OH-=HS-+H2O;c(HS-) >c(OH-) >c(S2−)。
18. 右移 增大 增大 增大 增大 左移 增大 减小 减小 不变 左移 减小 增大 减小 不变 右移 减小 增大 增大 不变 右移 增大 减小 增大 不变 左移 增大 减小 减小 不变
【详解】①水的电离为吸热反应,所以升高温度,促进水的电离,平衡向右移动,溶液中c(H+)和氢c(OH-)均会增大,水的电离平衡常数Kw增大;
②通入HCl(g),溶液中c(H+)增大,抑制水的电离,水的电离平衡向左移动,c(OH-)减小,因为温度不变,所以水的电离平衡常数Kw不变;
③氨气溶于水显碱性,通入氨气,溶液中c(OH-)增大,抑制水的电离,水的电离平衡向左移动,c(H+)减小,因为温度不变,所以水的电离平衡常数Kw不变;
④加Na后,钠与水电离生成的H+发生反应,促进水的电离,水的电离平衡向右移动,因为生成NaOH,所以溶液中c(OH-)增大,但温度不变,水的电离平衡常数Kw不变,所以c(H+)减小;
⑤向水中加入FeCl3(s),Fe3+水解会促进水的电离,水的电离平衡向右移动,Fe3+水解产生H+,所以溶液中c(H+)增大,因为温度不变,水的电离平衡常数Kw不变,所以c(OH-)减小;
⑥加入NaHSO4(s),相当于加入了强酸,溶液中c(H+)增大,抑制水的电离,使水的电离平衡向左移动,因为温度不变,水的电离平衡常数Kw不变,所以c(OH-)减小。
2024届高三新高考化学大一轮专题训练-盐类的水解: 这是一份2024届高三新高考化学大一轮专题训练-盐类的水解,共26页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题训练-盐类的水解: 这是一份2024届高三新高考化学大一轮专题训练-盐类的水解,共23页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题训练--盐类的水解: 这是一份2024届高三新高考化学大一轮专题训练--盐类的水解,共25页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。