



人教版 (2019)必修 第二册第二节 氮及其化合物精品当堂检测题
展开【重难点精讲】
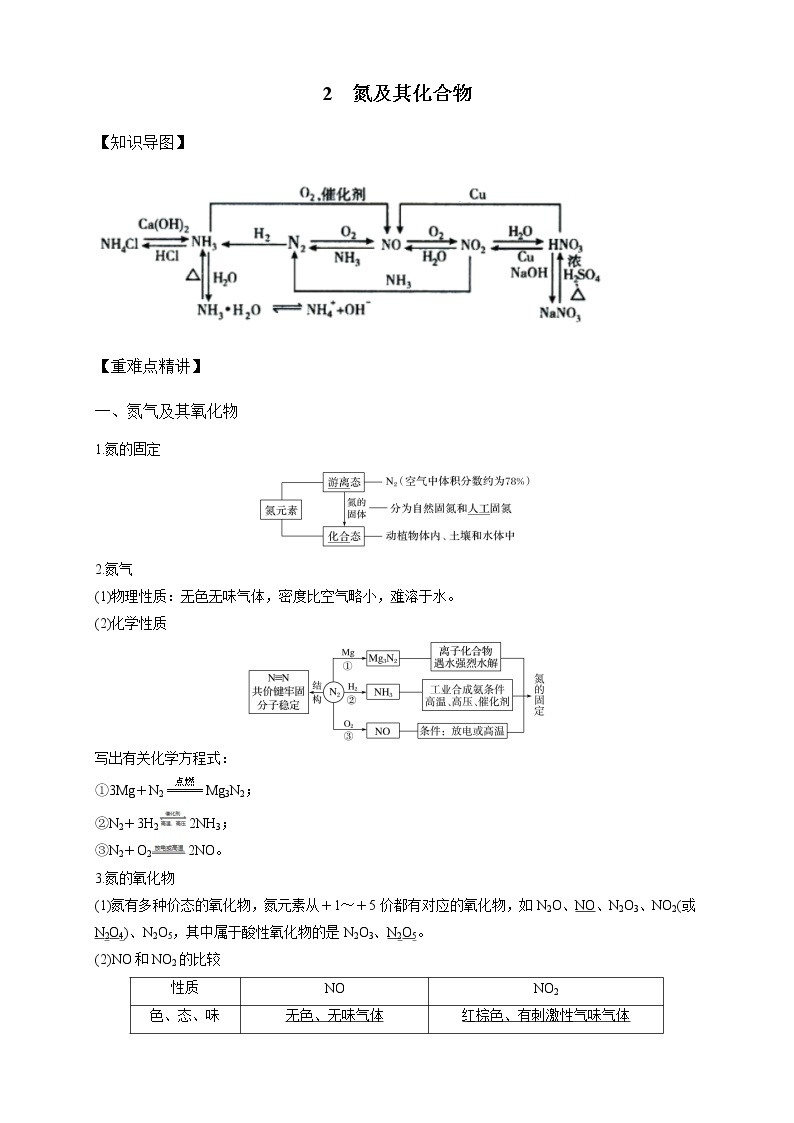
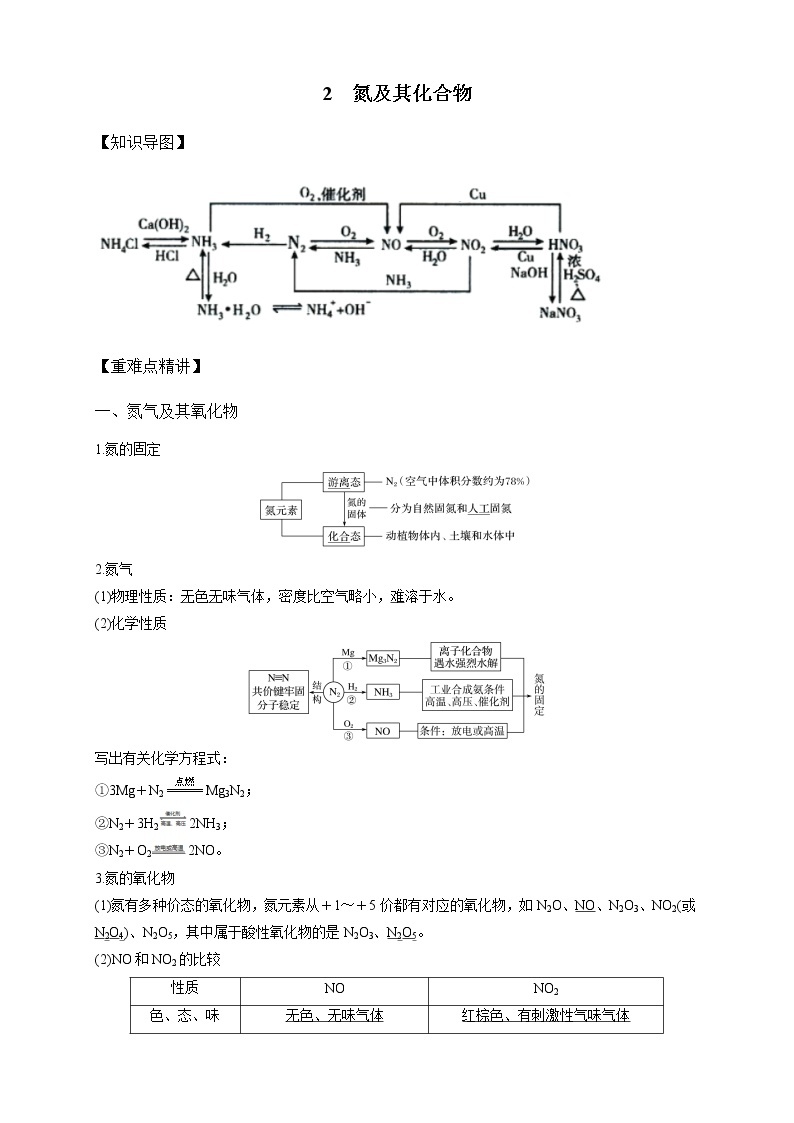
一、氮气及其氧化物
1.氮的固定
2.氮气
(1)物理性质:无色无味气体,密度比空气略小,难溶于水。
(2)化学性质
写出有关化学方程式:
①3Mg+N2eq \(=====,\s\up7(点燃))Mg3N2;
②N2+3H22NH3;
③N2+O22NO。
3.氮的氧化物
(1)氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,如N2O、NO、N2O3、NO2(或N2O4)、N2O5,其中属于酸性氧化物的是N2O3、N2O5。
(2)NO和NO2的比较
(3)氮氧化物对环境的污染及防治
1)常见的污染类型
①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。
③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
④NO与血红蛋白结合使人中毒。
2)常见的NOx尾气处理方法
①碱液吸收法
2NO2+2NaOH===NaNO3+NaNO2+H2O
NO2+NO+2NaOH===2NaNO2+H2O
NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。一般适合工业尾气中NOx的处理。
②催化转化法
在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2)或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。
二、典型的氧化性酸——硝酸
1.物理性质
硝酸是无色易挥发的液体,有刺激性气味。
2.化学性质
(1)不稳定性
反应:4HNO3(浓) eq \(=========,\s\up7(△或光照))2H2O+4NO2↑+O2↑。
(2)强氧化性
硝酸无论浓、稀都有强氧化性,而且浓度越大,氧化性越强。
按要求完成下列反应的方程式:
①与金属反应:
稀硝酸与铜反应:
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O;
浓硝酸与铜反应:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
②与非金属反应:
浓硝酸与C的反应:
C+4HNO3(浓)eq \(=====,\s\up7(△))CO2↑+4NO2↑+2H2O。
③与还原性化合物反应:
硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。
稀硝酸与FeSO4溶液反应的离子方程式:
3Fe2++4H++NOeq \\al(-,3)===3Fe3++NO↑+2H2O。
(3)与有机物反应
①硝化反应(与反应):
;
②颜色反应:含有苯基的蛋白质遇到浓硝酸时变黄色。
特别提醒:
1.质量分数达98%以上的浓硝酸称为“发烟硝酸”,“烟”实为雾(硝酸小液滴),体现了HNO3的挥发性。
2.浓硝酸能使紫色石蕊溶液变红,加热褪色。在这一反应过程中浓硝酸表现出强酸性和强氧化性,可将红色物质氧化成无色物质。
3.王水:浓HNO3和浓盐酸按体积比为1:3混合即为王水,它的氧化性更强,能溶解Pt、Au等金属。
4.NOeq \\al(-,3)在酸性条件下的强氧化性:NOeq \\al(-,3)在酸性条件下具有强氧化性,往往作为隐含条件出现在试题中,在解题中往往被忽视而形成易错点。常见的隐含形式有:
(1)在离子共存问题中,NOeq \\al(-,3)在酸性条件下不与具有较强还原性的离子如S2-、I-、Fe2+等大量共存。
(2)SOeq \\al(2-,4)的检验中不能用HNO3酸化、不能用Ba(NO3)2作沉淀剂,以防止SOeq \\al(2-,3)的干扰。
(3)向Ba(NO3)2溶液中通入还原性气体SO2可得到BaSO4沉淀。
(4)向Fe(NO3)2溶液中加入非氧化性酸,如盐酸,Fe2+能被氧化为Fe3+。
(5)向过量铜与一定量硝酸反应后的混合物中加入非氧化性酸,铜能继续溶解。
(6)向含还原性离子的酸性溶液中加入硝酸盐,还原性离子可被氧化。
三、氨、铵盐
1.氨的分子结构和物理性质
2.氨的化学性质
(1)氨与水的反应
NH3+H2ONH3·H2ONHeq \\al(+,4)+OH-,氨溶于水得氨水,氨水中含有的粒子有NH3·H2O、NH3、H2O、NHeq \\al(+,4)、OH-、H+。氨水为可溶性一元弱碱,易挥发,不稳定,易分解:NH3·H2Oeq \(=====,\s\up7(△))NH3↑+H2O。
(2)氨与酸的反应:蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为有白烟生成,将浓盐酸改为浓硝酸,也会出现相同的现象。
化学方程式:HCl+NH3===NH4Cl、NH3+HNO3===NH4NO3。
(3)与盐溶液的反应
如过量氨水与AlCl3反应的离子方程式:
Al3++3NH3·H2O===Al(OH)3↓+3NHeq \\al(+,4)。
(4)氨的还原性——氨的催化氧化
化学方程式:4NH3+5O2eq \(=====,\s\up7(催化剂),\s\d5(△))4NO+6H2O。
3.氨的实验室制法
(1)加热固态铵盐和碱的混合物
一般加热NH4Cl和Ca(OH)2的混合物,化学方程式:
2NH4Cl+Ca(OH)2eq \(=====,\s\up7(△))2NH3↑+CaCl2+2H2O。
①装置:“固体+固体eq \(――→,\s\up7(△))气体”(与用KClO3或KMnO4制O2的装置相同)。
②收集:只能用向下排空气法。
③验满方法:a.用湿润的红色石蕊试纸置于试管口,试纸变蓝色;b.将蘸有浓盐酸的玻璃棒置于试管口,现象是有白烟产生。
④尾气处理:收集时,一般在管口塞一团用水或稀硫酸浸湿的棉花球,可减小NH3与空气的对流速度,收集到纯净的NH3,同时也可避免污染空气。
(2)实验室制取氨的其他方法
4.铵盐及NHeq \\al(+,4)的检验
(1)铵盐的物理性质
铵盐都是白色固体,均易溶于水。
(2)铵盐的化学性质
(3)NHeq \\al(+,4)的检验
未知液eq \(――→,\s\up7(OH-))呈碱性eq \(――→,\s\up7(△))湿润的红色石蕊试纸变蓝色,则证明含NHeq \\al(+,4)。
特别提醒:
1.氨是中学阶段所学的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,利用这一点,可以在推断题中作为解题的突破口。
2.NH3、氨水都不是电解质,氨水中的电解质是NH3·H2O。NH3·H2O是中学阶段唯一一个可溶性的弱碱,也是一个化学式中无OH-的碱。
3.当浓硝酸、浓盐酸等挥发性酸与浓氨水或氨气接触时,有白烟生成,可以此来检验或验满氨气。
4.氨水中含有三种分子(H2O、NH3·H2O、NH3)和三种离子(OH-、NHeq \\al(+,4)、H+),其中含量最多的是NH3·H2O,但计算其物质的量浓度和溶质质量分数时,氨水的溶质以NH3代替。
【典题精练】
考点1、考查氮及其的性质和氮的固定
例1.下列有关氮气用途的说法不正确的是( )
A.作焊接金属的保护气
B.制硝酸和化肥的原料
C.食品袋中充氮气来防腐
D.与氧气反应制NO从而制硝酸
考点2、考查NO、NO2对环境的影响及其治理
例2.随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总化学方程式为2NO+O2+4COeq \(=====,\s\up15(催化剂))4CO2+N2
解析:反应过程中NO、O2为氧化剂,N2为还原产物;汽车尾气中的N2不是污染物;NO和O2的反应不需要催化剂;根据题中的图示,可将反应的过程分成如下两步写:2NO+O2===2NO2,2NO2+4CO===N2+4CO2,将两步反应式合并可得总化学方程式为2NO+O2+4COeq \(=====,\s\up15(催化剂))4CO2+N2。
考点3、考查氮的氧化物的简单计算
例3.将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体,则原混合气体中O2的体积和剩余的2 mL气体分别是( )
A.1.2 mL,NO B.2.4 mL,O2 C.3.5 mL,O2D.4 mL,NO
考点4、考查喷泉实验问题分析
例4.如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
考点5、考查NH3、氨水的主要性质及性质探究
例5.关于氨的下列叙述中,错误的是( )
A.氨易液化,因此可用来作制冷剂
B.氨溶解于水显弱碱性,因此可使酚酞溶液变为红色
C.氨气遇到浓盐酸、硫酸都会发生反应,产生白烟现象
D.氨气可被氯气氧化生成N2,同时还可能产生白烟现象
解析:C项,NH3+HCl===NH4Cl,有白烟生成,但与H2SO4反应不会产生白烟;D项,氨气可被氯气氧化生成N2,氯气被还原生成HCl,HCl与NH3化合产生白烟现象。
考点6、考查氨气的实验室制法
例6.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
A.①② B.②③ C.③④D.①③
考点7、考查铵盐的性质及其检验
2.下列说法中正确的是( )
A.所有铵盐受热均可以分解,但产物不一定有NH3
B.加热可除去NH4Cl中的少量NaHCO3
C.在盛有硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的试管中,滴加少量NaOH溶液,在试管口用湿润的红色石蕊试纸检验,试纸变蓝
D.铵盐都易溶于水,其水溶液均呈酸性
考点8、考查硝酸的性质
例8.下列有关硝酸的化学性质的叙述中,正确的是( )
A.浓、稀硝酸都能使蓝色石蕊试纸最终变为红色
B.硝酸能与FeO反应,只表现氧化性
C.硝酸可与Na2S反应制得H2S气体
D.浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色
考点9、考查金属与硝酸反应的计算
1.38.4 g铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4 L(标准状况),反应消耗的硝酸可能是( )
A.1.0 ml B.1.6 ml C.2.2 mlD.2.4 ml
方法归纳:HNO3与金属反应的计算的思维模型{
随堂练习:
一、选择题
1.下列反应属于氮的固定的是( )
A.HCl+NH3===NH4Cl
B.NH4HCO3eq \(=====,\s\up17(△))NH3↑+H2O↑+CO2↑
C.2NH4Cl+Ca(OH)2eq \(=====,\s\up17(△))CaCl2+2H2O+2NH3↑
D.N2+3H22NH3
2.化学与生活密切相关。下列有关说法错误的是( )
A.SO2和NO2是主要的大气污染物
B.大气中的SO2和CO2溶于水形成酸雨
C.以液化石油气代替燃油可减少大气污染
D.用石灰石对煤燃烧后形成的烟气脱硫,可减少环境污染
3.有关氨气的实验较多,下面对这些实验原理的分析中,正确的是( )
A.氨气极易溶于水,可以用来做喷泉实验
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.NH3·H2O不稳定,实验室可用NH4Cl和石灰水制取氨气
D.NH3液化时放出大量的热,因而不能用氨作制冷剂
4.利用如图制取氨气,下列说法正确的是( )
A.用湿润的棉花堵在试管口,防止氨气扩散
B.该装置可用于氯化铵分解制取氨气
C.该装置可用于氯化铵和熟石灰制取氨气
D.用蘸有浓硫酸的玻璃棒置于试管口验满
实验室制氨气时注意的问题
(1)制取NH3时,一般用NH4Cl而不用NH4NO3、
(NH4)2SO4或(NH4)2CO3,原因是:
①NH4NO3受热分解,可能会发生爆炸,不安全;
②(NH4)2SO4与Ca(OH)2反应时生成CaSO4,生成物呈块状,不利于NH3逸出,且反应后试管难清洗;
③(NH4)2CO3受热分解会产生CO2,使收集到的NH3不纯。
(2)实验室制取氨气,一般用熟石灰,不用NaOH或KOH,因为NaOH或KOH易吸水结块,而且对玻璃仪器的腐蚀性较强。
5.如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )
6.将40 mL NO2和NO的混合气体通入倒立于水槽中盛满水的试管里,充分反应后试管中剩余20 mL气体,则原混合气体中NO2和NO的体积比为( )
A.2∶1 B.1∶3
C.3∶1 D.1∶1
氮的氧化物与O2、H2O混合的计算方法
(1)关系式法
①NO、O2、H2O之间的综合反应式是4NO+3O2+2H2O===4HNO3。则:
V(NO)∶V(O2)eq \b\lc\{\rc\ (\a\vs4\al\c1(<4∶3余O2,=4∶3恰好反应,>4∶3余NO))
②NO2、O2、H2O之间的综合反应式是4NO2+O2+2H2O===4HNO3。则:
V(NO2)∶V(O2)eq \b\lc\{\rc\ (\a\vs4\al\c1(<4∶1余O2,=4∶1恰好反应,>4∶1余NO))
(2)得失电子守恒法——NO和NO2转化为硝酸时是氧化还原反应,必然遵循得失电子守恒。
7.如图所示,试管中装有12 mL NO,然后间歇而又缓慢地通入8 mL O2,下列是对最终状态的描述:
①试管内气体呈红棕色 ②试管内气体呈无色 ③试管内液面不变 ④试管内液面上升
⑤试管内气体是O2 ⑥试管内气体是NO
其中正确的是( )
A.①③ B.②④⑤
C.②④⑥ D.②③⑤
8.38.4 mg铜跟适量的浓硝酸反应,铜完全反应后,共收集到22.4 mL气体(已换算成标准状况),反应消耗的HNO3的物质的量可能是( )
A.1.0×10-3 ml B.1.6×10-3 ml
C.2.2×10-3 ml D.2.4×10-3 ml
9.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 ml·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL
C.30 mL D.15 mL
二、非选择题
10.用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH===2NaNO2+H2O、2NO2+2NaOH===NaNO2+NaNO3+H2O。现有V L某NaOH溶液,能完全吸收由n ml NO2和m ml NO组成的大气污染物。
(1)所用烧碱溶液的物质的量浓度至少为________ ml·L-1。
(2)若所得溶液中c(NOeq \\al(-,3))∶c(NOeq \\al(-,2))=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=________。
11.实验室模拟合成氨以及氨的催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液共热反应制取氮气。整个实验过程选用的实验装置如图所示。
(1)从图中选择制取气体的合适装置。
氮气:________(填“a”“b”或“c”,下同),氢气:________。
(2)氮气和氢气需通过甲装置,甲装置除了将气体混合外,还有____________、____________________的作用。
(3)从氨合成器出来经冷却的气体连续通入乙装置的水中,________(填“会”或“不会”)发生倒吸,原因是______________________________。
(4)用乙装置吸收混合气体中的氨,一段时间后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,锥形瓶中可观察到的现象是______________________。
(5)写出乙装置中氨被氧化的化学方程式:________________________。
(6)反应结束后乙装置中锥形瓶内的溶液含有的离子是H+、OH-、________、________。
课后作业:
一、选择题(单选题,每小题3分,共48分)
1、氮的循环在自然界元素的循环中具有重要的意义,有些氮的转化是从氮气转化为含氮的化合物,有的转化发生在含氮的化合物之间。下列过程中,以游离态的氮为原料,最终产生含氮的化合物的是( )
A.汽车尾气中的氮氧化物形成酸雨B.硝化细菌的硝化过程
C.动物尸体腐烂D.豆科植物的根瘤菌固氮
2、.Murad等三位教授关于一氧化氮分子在人体内的独特功能的研究,曾获得诺贝尔医学或生理学奖。关于一氧化氮的下列叙述不正确的是( )
A.一氧化氮是某些含低价氮物质氧化的产物
B.一氧化氮是亚硝酸的酸酐
C.一氧化氮是某些含高价氮物质还原的产物
D.一氧化氮具有还原性,在空气中极易被氧化
3.下列有关环境污染的说法正确的是( )
A.燃煤时加入适量石灰石,可减少废气中二氧化硫的含量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6~7之间的降水通常称为酸雨
D.含磷洗涤剂易于被细菌分解,不会导致水体污染
4下列说法正确的是( )
A.实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气
B.雷雨天气时空气中能生成少量的氮氧化物
C.铵盐易溶于水,化学性质稳定,受热不易分解
D.O2、NO、NO2都能用浓硫酸干燥,且通常情况下能大量共存
5.已知气体的摩尔质量越小,扩散速度越快。如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是( )
A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水
6(2019·杭州高一期末)下列有关浓硫酸、浓盐酸、浓硝酸的认识正确的是( )
A.浓硫酸、浓硝酸与金属反应时,主要是S或N得电子
B.如图,①中为三种酸的一种,②中为浓氨水,则大烧杯中均观察到白烟
C.浓盐酸、浓硫酸都可用来干燥氧气
D.常温下,浓硫酸或浓硝酸中投入Fe片,均会产生大量的气体
7、将SO2气体通入BaCl2溶液无沉淀生成。若再通入气体X,有沉淀生成,则气体X可能是下列四种气体中的( )
①NO2 ②CO2 ③NH3 ④Cl2
A.②③④B.①②④
C.①③④D.①②③
8、氮是动植物生长不可缺少的元素,含氮化合物也是重要的化工原料。自然界中存在如图所示的氮元素的循环过程,下列说法不正确的是( )
A.过程①“雷电作用”中发生的反应是N2+O2eq \(=====,\s\up7(放电))2NO
B.过程③“固氮作用”中,氮气被还原
C.⑤中涉及的反应可能有2NOeq \\al(-,2)+O2===2NOeq \\al(-,3)
D.⑥中涉及的反应可能有2NOeq \\al(-,3)+12H+===N2↑+6H2O
9.下列说法中,正确的是( )
A.可用铝制或铁制容器盛装稀硝酸
B.在0.1ml·L-1的盐酸中,Na+、Fe2+、SOeq \\al(2-,4)、NOeq \\al(-,3)能大量共存
C.56gFe与硝酸发生氧化还原反应时,转移的电子数一定是3ml
D.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定,见光易分解
10.下列关于浓硝酸和浓硫酸说法不正确的是( )
A.浓硝酸和浓硫酸在空气中久置,其浓度都会减小
B.与铜反应中都表现出强氧化性和酸性
C.浓硝酸常保存在棕色试剂瓶中
D.常温下,浓硝酸和浓硫酸都不与铁、铝反应
11. 氮及其化合物的变化关系如下所示。
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气可在足量的氧气中通过一步反应生成NO2
与HNO3溶液恰好完全反应,生成Cu(NO3)2、H2SO4、NO和H2O,则未被还原的HNO3的物质的量是( )
13. 1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下的气体672mL,将盛有该气体的容器倒扣在水中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入氧气的体积是( )
A.168mLB.224mL
C.504mLD.336mL
14.向13.6g由Cu和Cu2O组成的混合物中加入一定浓度的稀硝酸250mL,当固体物质完全溶解后生成Cu(NO3)2和NO气体。在所得溶液中加入0.5ml·L-1的NaOH溶液1.0L,生成沉淀的质量为19.6g,此时溶液呈中性且金属离子已完全沉淀。下列有关说法正确的是( )
A.原固体混合物中Cu和Cu2O的物质的量之比为1∶1
B.原稀硝酸中HNO3的物质的量浓度为1.3ml·L-1
C.产生NO的体积为2.24L
D.Cu、Cu2O与硝酸反应后剩余的HNO3为0.1ml
15.下列各组物质混合后(必要时可提供加热条件),最终只能得到一种气体产物的是( )
A.足量的铜与浓硝酸B.足量的木炭与浓硫酸
C.足量的铜与浓硫酸D.足量的锌与浓硫酸
16. 某企业利用下列流程综合处理工厂排放的含有SO2的烟气,以减少其对环境造成的污染。下列有关说法正确的是( )
A.二氧化硫吸收塔中发生的反应为SO2+SOeq \\al(2-,3)+H2O===2HSOeq \\al(-,3)
B.氨气吸收塔中发生的反应为HSOeq \\al(-,3)+OH-===H2O+SOeq \\al(2-,3)
C.上述流程利用的是氧化还原反应原理
D.上述流程中SO2可循环利用
二、非选择(共52分)
17(14分).下表是部分城市某日空气质量日报:
(1)由上表可知,空气质量日报中涉及的污染物主要是________和可吸入颗粒物(PM10)。
(2)SO2的排放是造成酸雨的主要因素。形成酸雨的原因之一可简单表示如下:
请回答下列问题:
①酸雨的pH________(填“>”“<”或“=”)5.6。
②反应b的化学方程式为__________________________________________________。
③在一段时间内连续不断测定溶液D的pH,发现pH变小,表示该变化的化学方程式是________________________________________________________________________。
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:________________________________________________________________________。
18(12分)在浓硝酸中放入铜片:
(1)反应开始时的化学方程式为_________________________________________________,
实验现象为_________________________________________________________________。
(2)若铜片有剩余,则反应将要结束时的化学方程式为
________________________________________________________________________。
(3)待反应停止后,再加入少量的稀硫酸,这时,铜片上又有气泡产生,原因是
________________________________________________________________________。
(4)若将12.8g铜与一定量的浓硝酸反应,铜消耗完后,共产生气体5.6L(标准状况),则所消耗的硝酸的物质的量是________(气体中不含N2O4)。
19(16分).某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰B.生石灰
C.二氧化硅D.五氧化二磷
E.烧碱
(2)虚线框内应添加必要的除杂装置,请从表格中的备选装置中选择,并将编号填入下列空格:
B________,D________,E________。
(3)通入C装置的两根导管左边较长、右边较短,目的是
________________________________________________________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:__________________________________________________________;
其中氧化剂与还原剂的物质的量之比为________;当aml氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为________ml-1(用含a、b的代数式表示)。
(5)从装置C的出气管口G处逸出的尾气可能含有污染环境的气体,如何处理?
________________________________________________________________________。
20(共14分).某同学看到“利用零价铁还原NOeq \\al(-,3),脱除地下水中硝酸盐”的相关资料后,利用如图装置探究铁粉与KNO3溶液的反应。实验步骤及现象如下:
(1)通入N2并保持后续反应均在N2氛围中进行的实验目的是_________________________。
(2)白色物质是__________,用化学方程式解释其变为红褐色的原因:_________________。
(3)为了探究滤液的成分,该同学进一步设计了下述实验:
(ⅰ)根据以上实验现象,可以判断滤液中存在______________________(填离子符号)。
(ⅱ)步骤②中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因:
________________________________________________________________________。
性质
NO
NO2
色、态、味
无色、无味气体
红棕色、有刺激性气味气体
溶解性
难溶于水
毒性
有毒,大气污染物之一
有毒,大气污染物之一
与水反应
不反应
3NO2+H2O===2HNO3+NO
与氧气反应
NO+O2===2NO2
不反应
对环境的影响
NO与血红蛋白结合使人中毒,NO、NO2导致光化学烟雾、形成酸雨及破坏臭氧层
电子式
密度
气味
水溶性
比空气小
强烈刺激性气味
极易溶于水(1∶700)
方法
化学方程式(或原理)
气体发生装置
加热浓氨水
NH3·H2Oeq \(=====,\s\up7(△))NH3↑+H2O
浓氨水+固体NaOH
NaOH溶于水放热,促使氨水分解。且OH-浓度的增大有利于NH3的生成
浓氨水+固体CaO
CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为NH3·H2O+CaO===NH3↑+Ca(OH)2
选项
实验现象
解释
A
浓盐酸附近产生白烟
NH3与HCl反应产生了微小的NH4Cl晶体
B
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C
氯化物溶液变浑浊
该溶液一定是AlCl3溶液
D
湿润的红色石蕊试纸变蓝
NH3是一种可溶性碱
城市
污染指数
首要污染物
空气质量等级
SO2
NO2
PM10
A
98
23
67
SO2
Ⅱ
B
47
29
35
SO2
Ⅰ
C
62
80
113
PM10
Ⅲ
D
52
76
59
NO2
Ⅰ
实验步骤
实验现象
①打开弹簧夹,缓慢通入N2
②加入pH为2.5的0.01ml·L-1的酸性KNO3溶液100mL
铁粉部分溶解,溶液呈浅绿色;铁粉不再溶解后,剩余铁粉表面附着少量白色物质
③反应停止后,拔掉橡胶塞,将圆底烧瓶取下
烧瓶内气体的颜色没有发生变化
④将剩余固体过滤
表面的白色物质变为红褐色
实验步骤
实验现象
①取部分滤液于试管中,向其中加入KSCN溶液
溶液无变化
②将上述溶液分为两份,一份中滴入氯水,另一份中滴加稀硫酸
两份溶液均变为红色
③另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸
有气体生成,该气体使湿润的红色石蕊试纸变蓝
化学第三节 乙醇与乙酸精品同步测试题: 这是一份化学第三节 乙醇与乙酸精品同步测试题,文件包含高中化学新版必修二第09讲乙醇和乙酸教师满分版docx、高中化学新版必修二第09讲乙醇和乙酸学生满分版docx等2份试卷配套教学资源,其中试卷共57页, 欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物优秀课时训练: 这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物优秀课时训练,文件包含高中化学新版必修二第02讲氮及其化合物教师提升版docx、高中化学新版必修二第02讲氮及其化合物学生提升版docx等2份试卷配套教学资源,其中试卷共54页, 欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物优秀习题: 这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物优秀习题,文件包含高中化学新版必修二第02讲氮及其化合物教师基础版docx、高中化学新版必修二第02讲氮及其化合物学生基础版docx等2份试卷配套教学资源,其中试卷共55页, 欢迎下载使用。