







- 《反应热的计算》课件PPT+教学设计 课件 20 次下载
- 《化学反应速率》第一课时课件PPT+教学设计 课件 25 次下载
- 《化学反应速率》第二课时课件PPT+教学设计 课件 23 次下载
- 《化学反应速率》第三课时课件PPT+教学设计 课件 19 次下载
- 《化学平衡》第一课时课件PPT+教学设计 课件 21 次下载
高中化学人教版 (2019)选择性必修1第一节 反应热优秀教学课件ppt
展开(人教版高中化学选择性必修1)
《反应热》第二课时 教学设计
课题名 | 《反应热》第二课时 |
教材分析 | 热化学方程式的书写建立在正确书写方程式的基础上。上一节课已经讲解了中和热,可用对比的方法学习燃烧热。最后进一步强化热化学方程式的书写。在高考中会考察热化学方程式的书写,判断等内容,属于较简单题型。 |
教学目标 | 宏观辨识与微观探析:热化学方程式书写的要点和步骤 科学探究与创新意识:理解燃烧热的定义,能进行燃烧热的相关计算 |
教学重点 | 热化学方程式书写,燃烧热的定义和相关计算 |
教学难点 | 热化学方程式书写,燃烧热的定义和相关计算 |
教学方法 | 讲解法,举例练习法 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
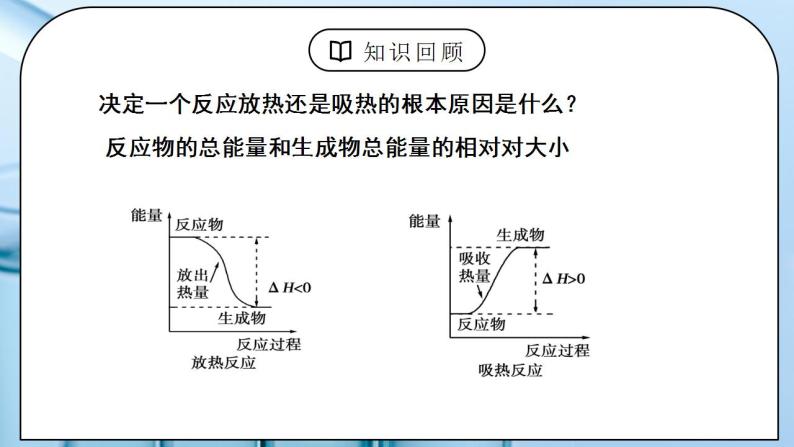
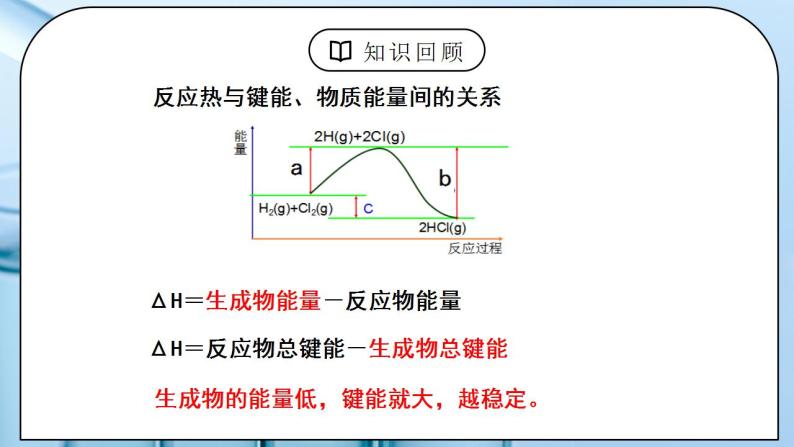
教学过程 | 一、新课导入 1.反应热产生的原因 教师:思考:决定一个反应放热还是吸热的根本原因是什么? 学生:反应物的总能量和生成物总能量的相对对大小 反应热与键能、物质能量间的关系 ΔH=生成物能量-反应物能量 ΔH=反应物总键能-生成物总键能 [设计意图]让学生体会生活中的能量转化形式 二、探究新知 1.一、热化学方程式 教师:讲解 特点:指明了反应时的温度和压强 注明各物质的状态 s(固体)、l(液体)、g(气体)或aq(溶液) 注明了ΔH的正负号、数值及单位 1、定义:表明反应所释放或吸收的热量的化学方程式 2、意义:表示1mol气态H2与1mol气态碘完全反应,生成2mol气态HI时,放出14.9kJ的热量。 3、书写 化学方程式-物质状态-反应热 (1)注明反应的条件,即反应时的温度和压强。若是25 ℃和101 kPa时的数据,可不特别注明 (2)注明反应物和生成物的聚集状态 (3)注明反应热:吸热反应,ΔH>0 ;放热反应,ΔH<0 (4)化学计量数只表示物质的量,因此可以是整数 ,也可以是分数 (5)化学计量数改变,ΔH要相应改变,ΔH必须与化学方程式一一对应 逆反应的ΔH数值与正反应的相等 、符号相反 学生:练习1:当1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6kJ的热量,请写出该反应的热化学方程式。 练习2、已知某温度下的热化学方程式: 2SO2(g) +O2(g) SO3(g) △H=-197kJ/mol 试写出SO3分解的热化学反应方程式。 注意:对于可逆反应, ①当反应逆向进行时,其反应热与正反应的数值相等,符号相反。 ②其反应热是指反应物完全转变成生成物放出或吸收的热量。 练习3、沼气的主要成分是甲烷。0.5 mol CH4完全燃烧生成CO2和水时,放出445 kJ的热量。则下列热化学方程式中正确的是 A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l ) ΔH = + 890 kJ/mol B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol C、CH4 ( g ) + 2O2( g ) = CO2( g ) + 2H2O ( l ) ΔH = – 890 kJ/mol D、 1/2CH4 ( g ) + O2( g ) = 1/2CO2( g ) + H2O ( l ) ΔH = – 890 kJ/mol 练习4、(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量 (2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态), 放出78.5 kJ的热量 (3)1克甲烷在空气中燃烧,恢复常温下测得放出热55.625KJ,试写出热化学方式。 (4)常温下14克CO在足量氧气中充分燃烧,放出141.3KJ热量,写出该热化学方程式。 [设计意图]让学生掌握热化学方程式的书写要点,会书写热化学方程式。 2.二、燃烧热 教师:1、定义:在101 kPa时,1 mol 纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热。 指定产物: C -- CO2 (g) H– H2O(l) S – SO2 (g) N– N2(g) 2、热化学方程式的书写: 燃烧热应以1mol物质为标准来配平其余物质的化学计量数,故在热化学方程式中常出现分数。 例如:H2( g ) +1/2 O2 ( g) = H2O ( l ) ΔH=-285.8kJ/mol CO(g)+ 1/2O2(g)= CO2(g)ΔH=-282.9kJ/mol [例题]在101 kPa时,1 mol CH4 完全燃烧生成CO2和液态H2O,放出890.3 kJ的热量,CH4的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少? 解析:根据题意,在101 kPa时,1 mol CH4完全燃烧的热化学方程式为: CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3 kJ/mol 即CH4的燃烧热为890.3 kJ/mol。 1 000 L CH4(标准状况)的物质的量为:n(CH4)= =44.6 mol 1 mol CH4 完全燃烧放出890.3 kJ的热量,44.6 mol CH4 完全燃烧放出的热量为: 44.6 mol×890.3 kJ/mol=3.97×104 kJ 学生:练习1、 哪一个方程式表示的是H2的燃烧热? H2(g)+½O2(g)=H2O(l) ∆H=-285.8kJ/mol 2H2(g)+O2(g)=2H2O(g) ∆H=-571.6kJ/mol H2(g)+ ½O2(g)=H2O(g) ∆H=-241.8kJ/mol 练习2、以下几个热化学方程式,能表示固态碳和气态氢气燃烧时的燃烧热的热化学方程式是( ) A.C(s)+1/2O2(g)=CO(g) ΔH=-283.0 kJ/mol B.C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol D.H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ/mol [设计意图]让学生掌握燃烧热的定义,能进行有关计算。 |
板书设计 | 一、热化学方程式 1、定义 2、意义 3、书写 二、燃烧热 1、定义:在101 kPa时,1 mol 纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热。 2、热化学方程式的书写: |
课后作业 |
练习册上相应习题 |
教学反思 | 亮点:本课概念讲解细致到位,讲练结合,配置了相应的例题和练习,帮助学生把握好本节课的新知识。 课堂教学建议:本节课难度不大,在学生掌握好燃烧热的定义后结合上节课的中和热的概念进行概念辨析和热化学方程式的书写练习,找出学生的易错点再加强练习。 |
高中化学人教版 (2019)选择性必修1第一节 反应热教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热教学课件ppt,文件包含《反应热》第一课时课件pptx、《反应热》第一课时教学设计docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
化学选择性必修1第一节 反应热公开课教学ppt课件: 这是一份化学选择性必修1第一节 反应热公开课教学ppt课件,文件包含《反应热》第一课时课件pptx、《反应热》第一课时教学设计docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热优质教学ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热优质教学ppt课件,文件包含《反应热》第一课时课件pptx、《反应热》第一课时教学设计docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。














