







高中化学人教版 (2019)选择性必修1第一节 反应热优质教学ppt课件
展开(人教版高中化学选择性必修1)
《反应热》第一课时 教学设计
课题名 | 《反应热》第一课时 |
教材分析 | 在必修第二册已经呈现了化学反应与能量变化的知识,在本课中既要回顾学过的知识又要进行升华,让学生深入理解反应热产生的最本质的原因,从宏观和微观两个角度认识反应热产生的原因。掌握测定中和反应热的实验方法。 |
教学目标 | 宏观辨识与微观探析:从内能的角度理解反应热产生的原因证据推理与模型认知:理解反应热产生的本质原因,能用键能计算反应热 科学探究与创新意识:探究中和反应反应热的测定方法 |
教学重点 | 反应热产生的本质原因,用键能计算反应热,中和热的定义 |
教学难点 | 中和反应反应热的测定方法 |
教学方法 | 讲解法,实验 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
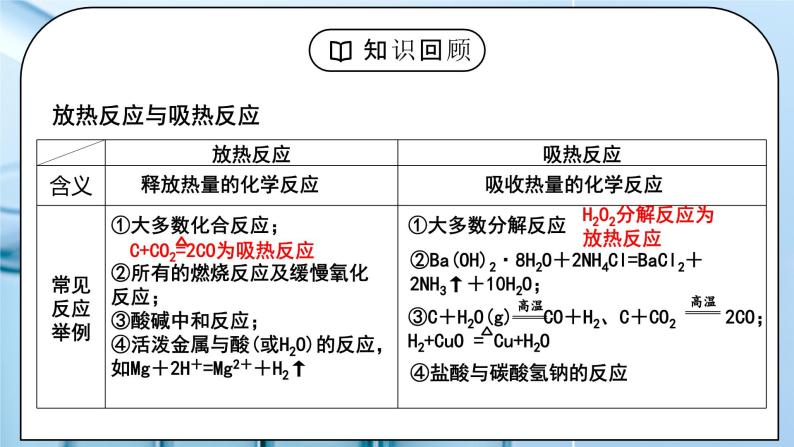
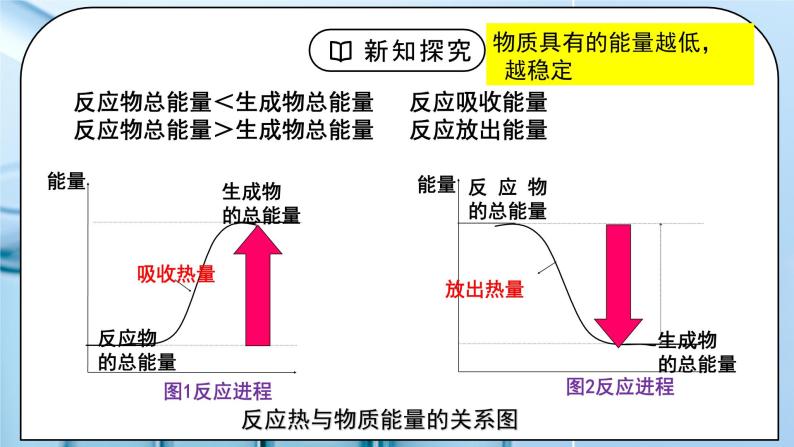
教学过程 | 一、新课导入 1.联系生活实际,体会能量的转化形式 教师:思考:说出下列变化过程中的能量转化形式: 学生:蜡烛燃烧 硅太阳能电池 植物光合作用 干电池 铅酸蓄电池 太阳能热水器 “一拉热”食品 [设计意图]让学生体会生活中的能量转化形式 2.放热反应与吸热反应 教师:回忆放热反应与吸热反应 学生:归纳常见的放热反应与吸热反应 [设计意图]让学生掌握常见的放热反应与吸热反应 二、探究新知 1.一、反应热 焓变 教师:讲解体系与环境 学生:填空:被研究的物质系统称为体系,与体系相互影响的其他部分称为环境。如:将试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系;盛溶液的试管和溶液之外的空气等看作环境。 热量是指因温度不同而在体系与环境之间交换或传递的能量。 [设计意图]理解体系与环境的概念 2.一、反应热 焓变 教师:讲解1、概念: ①焓(H):是一个与内能有关的物理量,用来描述物质所具有的能量 ②反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量。 ③焓变:反应产物的总焓与反应物总焓之差,用△H表示 △H =H生成物-H反应物 反应热和焓变的关系:反应在恒压条件下进行,此反应的反应热等于焓变 2、符号及规定: △H 反应体系吸热时其焓增大△H>0或为“+”吸热 反应体系放热时其焓减小△H<0或为“-”放热 3、单位:kJ∕mol 4、测量方法:量热计 5、产生原因: ①内能(U):一个化学反应是吸热还是放热,由反应物的总能量和生成物的总能量决定 反应物总能量<生成物总能量 反应吸收能量 反应物总能量>生成物总能量 反应放出能量 ②键能: 思考:为什么后的反应放热,有的反应吸热? 化学键与化学反应中能量变化关系 形成1mol化学键时释放的能量或断开1mol化学键所吸收的能量叫做键能 化学键的断裂和形成是化学反应中能量变化的主要原因 当拆开旧键吸收的能量>形成新键放出的能量 吸热 当拆开旧键吸收的能量<形成新键放出的能量 放热 用键能可以粗略计算出化学反应的反应热 △H=∑E反(反应物键能)— ∑E生(生成物键能) 注:△H=∑E生(生成物内能)— ∑E反(反应物内能) 6、影响因素: ①反应的T、P,不说明一般为(101KP、25℃) ②生成物种类 ③反应物和生成物状态 ④反应物的用量 例1、比较热量的大小、 △H1和△H2的大小 2H2(g)+O2(g)=2H2O(l),△H1=-Q1kJ/mol H2(g)+1/2O2(g)=H2O(l),△H2=-Q2kJ/mol 学生:练习:⑴比较热量的大小、 △H1和△H2的大小 S(g)+O2(g)==SO2(g) △H1=- Q1 kJ/mol S(s)+O2(g)==SO2(g) △H2=- Q2 kJ/mol 练习:断开1mol H—H键,吸收436kJ的能量 断开1mol Cl—Cl键,吸收243kJ的能量 形成1mol H—Cl键,放出431kJ的能量 H2(g)+Cl2(g)=2HCl(g) △H= H-H键的键能是436kJ/mol O=O键的键能是496kJ/mol H-O键的键能是463kJ/mol, 则2H2(g)+O2(g)=2H2O(g) ΔH= 练习:乙苯催化脱氢制苯乙烯反应: 根据键能计算反应热 [设计意图]通过讲解让学生掌握反应热的概念和计算方法,从宏观和微观两个角度深入理解反应放热和吸热的原因。设计的练习题让学生深入思考体会反应热的影响因素。 3.二、中和反应 教师:讲解1、中和热概念:在 ___溶液中,强酸跟强碱发生中和反应生成_______液态水时的反应热。
①必须是稀溶液 ②强酸和强碱反应 ③标准:生成1molH2O(l)放出的热量 4、数值:中和热为57.3kJ/mol或△H= -57.3kJ/mol 学生:练习:下列反应,表示△H=-57.3kJ/mol的方程式有( ) [设计意图]理解中和反应的定义 4.二、中和反应反应热的测定 教师:探究实验: (1)测定原理:环境温度不变时,根据测得的体系的温度变化和有关物质的比热容等来计算反应热。 Q = mc△t (2)实验步骤: ①组装仪器: 各部分仪器的作用 a玻璃搅拌器的作用 。 b.隔热层的作用是 。 c.温度计的作用是测定反应前后反应体系的温度。 ②用一个量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒中,改善杯盖,插入温度计,测量并记录盐酸的温度。然后把温度计上的酸用水冲洗干净,擦干备用。 ③用另一个量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用温度计测量NaOH溶液的温度,记录数据。 ④打开杯盖,把量筒中的NaOH溶液一次倒入量热计的内筒中,盖好杯盖,插入温度计,用搅拌器迅速搅拌。密切关注温度变化,测量混合溶液的_________,记录数据。 ⑤重复实验骤三次,取_______计算。 (4)实验数据处理:生成 1mol H2O时的反应热 问题探究 1.实验中用50mL0.5mol/L稀盐酸和50mL0.55mol/LNaOH溶液,物质的量比为何不是1∶1而是NaOH过量? 2.用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?若用稀硫酸和稀Ba(OH)2溶液测定中和反应反应热,对结果会产生什么影响? 3.酸、碱混合时,为何要把量筒中的NaOH溶液一次性很快倒入小烧杯而不能缓缓倒入? 4.温度计上的酸为何要用水将温度计冲洗干净?冲洗后的溶液能否倒入小烧杯中? 5.中和反应反应热的测定实验中的玻璃搅拌器能不能换成铜质搅拌器? 学生:学习中和反应热测定的实验思考问题得出答案 [设计意图]让学生掌握中和热测定的方法 |
板书设计 | 一、反应热 焓变 1、概念: ①焓(H) ②反应热 ③焓变 2、符号及规定 3、单位 4、测量方法 5、产生原因 ①内能(U) ②键能 △H=∑E反(反应物键能)— ∑E生(生成物键能) 6、影响因素: 二、中和反应反应热的测定 1、中和热概念 2、探究实验:中和反应反应热的测定 |
课后作业 |
练习册上相应习题 |
教学反思 | 亮点:本课概念讲解充分,用图帮助学生从宏观和微观两个角度理解反应热产生的原因。中和反应热的测定实验步骤清晰,问题探讨到位。 课堂教学建议:在本课的讲解中应做适当复习,用图帮助学生从宏观和微观两个角度理解反应热产生的原因。本课概念较多,应通过例题和练习题加以强化。 |
高中化学人教版 (2019)选择性必修1第一节 反应热教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热教学课件ppt,文件包含《反应热》第一课时课件pptx、《反应热》第一课时教学设计docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
化学选择性必修1第一节 反应热公开课教学ppt课件: 这是一份化学选择性必修1第一节 反应热公开课教学ppt课件,文件包含《反应热》第一课时课件pptx、《反应热》第一课时教学设计docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
高中人教版 (2019)第二节 电解池优秀教学ppt课件: 这是一份高中人教版 (2019)第二节 电解池优秀教学ppt课件,文件包含《电解池》第一课时课件pptx、《电解池》第一课时教学设计docx等2份课件配套教学资源,其中PPT共23页, 欢迎下载使用。













