






第八章 常见的酸、碱、盐 8.2 常见的酸和碱 第2课时 稀酸的化学性质 课件+教案+素材
展开第2课时 稀酸的化学性质
【教学目标】
1.知识与技能
初步掌握稀硫酸的化学性质以及有关化学方程式。
2.过程与方法
通过演示实验和学生分组实验,培养学生的观察能力、逻辑思维能力和实验操作能力以及记录实验的能力。
3.情感、态度与价值观
树立事物间的共性与个性的辩证唯物观。
【教学重点】
酸的相似的化学性质。
【教学难点】
有关化学反应。
【教学准备】
仪器:烧杯、胶头滴管、点滴板、镊子、玻璃片、短玻璃管等。
药品:食醋、稀盐酸、稀硝酸、稀硫酸、食盐水、紫色石蕊试液、无色酚酞试液、生锈的铁钉、铜铁镁锌、变黑的铜丝、蒸馏水等。
一、导入新课
[教师]同学们,上节课我们学习了浓盐酸和浓硫酸的物理性质和用途,现在老师手中拿的就是这两种酸,它们的标签都被遮挡住了。那么,在不看标签的情况下,你能够用哪些方法来区分二者?请同学们思考。
[学生]积极思考,回忆所学知识,回答问题。
[教师]那么,稀酸都具有哪些通性呢?各自又有哪些“脾气”和“性质”呢?这就是我们今天主要的学习内容。
二、推进新课活动
1认识稀酸的化学性质
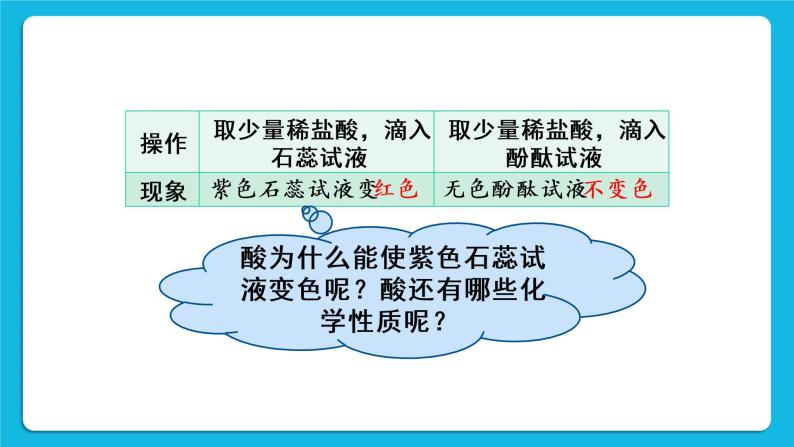
[提问]试管中的紫色石蕊试液,在不借助任何化学药品的情况下,能否使之变成红色?
[学生演示](向试管中吹气,紫色石蕊试液变成红色)
[追问]为什么会变色?
[学生回答]二氧化碳与水反应生成碳酸。碳酸使紫色石蕊试液变成红色。(请学生写出该反应的化学方程式)
[提问]除了碳酸,还有其他物质能使紫色石蕊试液变色吗?
[学生活动1]分别在稀盐酸和稀硫酸中滴加紫色石蕊试液。
[实验现象交流]与碳酸的现象相似,试液变红。
[板书] 三、稀酸的化学性质
- 酸溶液与酸碱指示剂作用
pH<7溶液呈酸性,性质1 使紫色石蕊试液变红,不能使无色酚酞试液变色。
[过渡]稀盐酸、稀硫酸都能使紫色石蕊试液变红色,它们还有其他的共性吗?
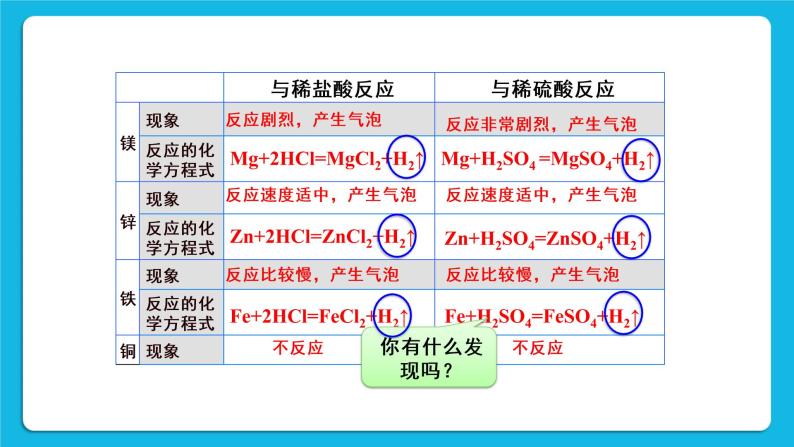
[知识回顾]铁跟稀硫酸发生置换反应:Fe+H2SO4=FeSO4+H2↑;铁跟稀盐酸发生置换反应:Fe+2HCl2=FeCl2+H2↑。
[交流]都有氢气;另一生成物都是由金属离子和酸根离子组成的化合物叫做盐。
[板书]2.由金属离子和酸根离子组成的化合物通称为盐。
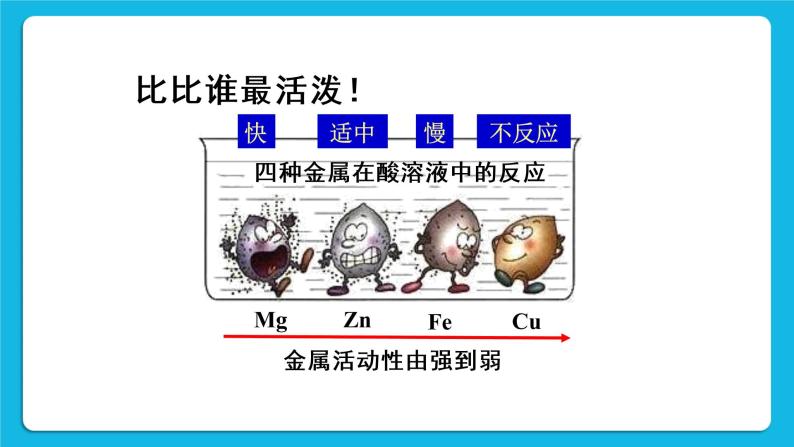
[学生实验活动2]拓展[实验8-7][演示]选用金属活动性排在氢前面的金属(如Mg、Al、Zn、Fe等)与稀盐酸进行反应。
[投影](学生实验8-7完成后投影)
[板书]性质2 较活泼金属+酸→盐+氢气
知识回顾[第1章1.3]稀盐酸滴进氧化铜中,加热振荡,生成蓝绿色的溶液:CuO+2HCl==CuCl2+H2O
[学生活动3]拓展[实验8-8][演示]实验“盐酸与生锈的铁钉反应”,回答现象并写出化学反应方程式。
[投影]
[提问]利用上面的反应除去金属表面的锈,除锈时能否长时间将金属制品浸在酸中?为什么?
[交流]不能;因为在除去锈之后,酸会与金属继续反应,造成对金属的腐蚀。
[提问]上面反应的生成物有什么共同之处?
[板书]性质3 酸+金属氧化物→盐+水
[知识回顾][第5章5.3]实验室用稀盐酸与石灰石反应制取二氧化碳的原理是:CaCO3+2HCl==CaCl2+H2O+CO2↑
[学生活动4]拓展[实验8-9]稀盐酸与硝酸银溶液的反应
[投影]
[板书]性质4 盐+酸→新盐+新酸
[归纳]盐酸或可溶性的氯化物与AgNO3反应生成不溶于稀HNO3的白色AgCl沉淀。利用此反应检验盐酸和可溶性的氯化物。
[提问]请同学们回忆,酸(如盐酸、硫酸等),除上述反应外,还能和什么物质反应?
[投影交流]酸的化学性质
[应用]通过上面的学习,我们就可以解决课前的问题:
现有两支试管,分别盛有稀盐酸和稀硫酸,请设计实验鉴别二者。
分析:方法一,分别加入少量氯化钡溶液,有白色沉淀产生的是稀硫酸,无变化的则是稀盐酸;方法二,分别加入少量的硝酸银溶液,有白色沉淀产生的则是稀盐酸,无变化的则是稀硫酸。
[课堂练习]教材P231“检查站”。
三、典例剖析
例 (广东茂名中考)小明同学的自行车锁生锈了(铁锈的主要成分是Fe2O3),他怎样也开不了,于是他把锁拿到修理店请师傅帮他解决。老师傅很快拿出一瓶喷剂,叫小明往锁孔里轻轻喷一下,一会儿后,锁终于用钥匙打开了,小明感到很惊奇,问老师傅是什么原因,老师傅只会使用但不会解释。小明决定用所学的化学知识弄明白,他仔细看了喷剂瓶上的说明,原来它主要成分是盐酸,小明顿时恍然大悟…请你用化学方程式解释其原因: 。
小明思考了一会,谦谦有礼地对老师傅说,以后使用这种喷剂不能过量使用,否则会损坏铁质锁,老师傅笑着点点头。请你再用化学方程式解释其原因 :。
【解析】铁锈的主要成分是氧化铁,能和稀盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl==2FeCl3+3H2O;铁能和稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl==FeCl2+H2↑。
【答案】Fe2O3+6HCl==2FeCl3+3H2O Fe+2HCl==FeCl2+H2↑
四、课堂检测
教师引导学生做《状元导练》P35“当堂训练”中的题目,并有针对性地讲解。
五、课堂小结
[小结]本节课重点学习了酸的化学性质,知道了酸溶液可以与指示剂作用,酸能和活泼金属反应,也能和金属氧化物反应。同时也认识到盐酸和硫酸与一些金属化合物的反应。这部分的内容很重要,请同学们在课后一定要好好复习复习。
今天虽然学习了酸的不少化学性质,但是还有一点非常重要的化学性质我们没有讲到,那就是酸和碱的反应,这部分太重要了,以至于我们本节课没有时间来讨论它,而在后续学习中重点讨论它。
六、布置作业
1.《状元导练》P36“课后作业”练习,并提醒学生预习后续内容,试着做《状元导练》P37“课前预习”。
2.课本P234~P235习题第3、8题。
8.2 常见的酸和碱
第2课时 稀酸的化学性质
三、稀酸的化学性质
1.酸溶液与酸碱指示剂作用
性质1:酸使紫色石蕊试液变红;使无色酚酞不变色
性质2:较活泼金属+酸→盐+氢气
性质3:酸+金属氧化物→盐+水
性质4:盐+酸→新盐+新酸
- 由金属离子和酸根离子组成的化合物通称为盐
这节课的教学按教材的设计思想进行,采取以学生为主体的化学探究实验教学。让学生以实验探究的方式来总结酸的化学性质。学生是探究实验教学的主体,有效地实施探究化学实验教学,增强了学生的主体意识,充分发挥他们的主观能动性。为学生提供更多的机会,通过回忆、问题、实验、启发、讨论等方式引导学生积极思考,通过实验探究得出结论并进行评价和反思,从而完成教学目标,并进一步激发学生的求知欲和学习兴趣。









