








- 《化学反应的速率与限度》第一课时课件PPT+教学设计 课件 64 次下载
- 《化学反应的速率与限度》第二课时课件PPT+教学设计 课件 69 次下载
- 《认识有机化合物》第一课时课件PPT+教学设计 课件 68 次下载
- 《认识有机化合物》第二课时课件PPT+教学设计 课件 67 次下载
- 《乙烯与有机高分子材料》第一课时课件PPT+教学设计 课件 65 次下载
人教版 (2019)必修 第二册第二节 化学反应的速率与限度教学ppt课件
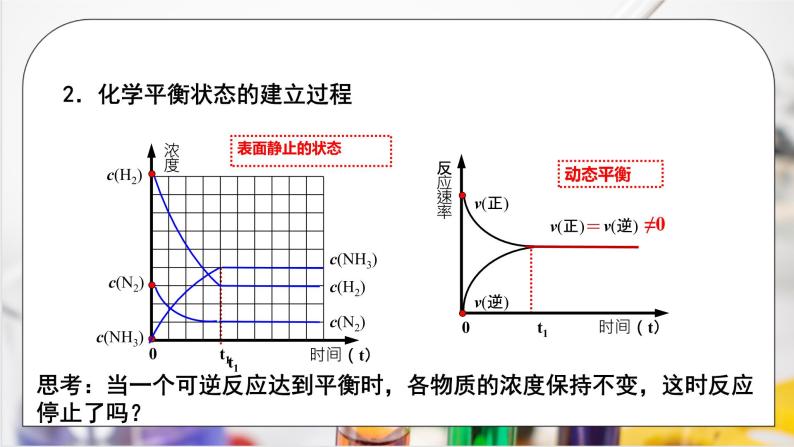
展开人教版高中化学必修二第六章 化学反应与能量第二节 化学反应速率和限度 第三课时学习目标1.掌握可逆反应的定义和表示方法。2.掌握化学平衡状态建立的过程。3.掌握化学平衡状态的定义,特征和标志。重点:化学平衡状态建立的过程,化学平衡状态的定义,特征和标志。难点:化学平衡状态的标志。炼铁高炉尾气之谜 开始,炼铁工程师们认为是CO与铁矿石接触不充分造成的,于是设法增加高炉的高度。然而,令人吃惊的是,高炉增高后,高炉尾气中的CO比例竟然没有改变。 炼制1 t 生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,从高炉炉顶出来的气体中总是含有未利用的CO气体。高炉炼铁原理:可逆反应,在一定条件下建立化学平衡。高炉炼铁原理:为什么增加炼铁高炉的高度不能改变高炉尾气中的CO比例呢? 直到19世纪下半叶,法国化学家勒夏特列经过深入的研究,才将这一谜底揭开。新知探究、定义:在同一条件下,既能向正反应方向,又能向逆反应方向进行的反应,叫做可逆反应。1、可逆反应注意:可逆反应总是不能进行到底,得到的总是反应物与生成物的混合物,反应会达到一定的限度。三、化学反应的限度例1、对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2足够长时间后,18O原子( )A、只存在于O2中B、只存在于O2和SO3中C、只存在于SO2和O2中D、存在于SO2、O2和SO3D【思考】可逆反应在一定条件下所能达到的或完成的最大程度是什么?⑤根据上述分析画出N2和H2反应过程中, v正 、v逆 随时间变化的关系图。①当反应刚开始时,反应物和生成物的浓度哪个大?②当反应刚开始时,正反应和逆反应哪个反应速率大?③ 随着反应的进行,反应物和生成物浓度如何变化?④ 随着反应的进行,v(正)、 v(逆)怎样变化?思考:当一个可逆反应达到平衡时,各物质的浓度保持不变,这时反应停止了吗?v(正)v(逆)t1=v(正)v(逆)动态平衡≠02.化学平衡状态的建立过程t1c(H2)c(N2)c(NH3)t1c(H2)c(N2)c(NH3)表面静止的状态3、化学平衡状态:.定义:化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。前提条件:可逆反应实质:正反应速率=逆反应速率标志:反应混合物中各组分的浓度保持不变强调三点②.化学平衡状态的特征(3)动:动态平衡(正逆反应仍在进行)(5)变:条件改变,原平衡被破坏,在新的条件下建立新的平衡(2)等:正反应速率=逆反应速率≠0(4)定:反应混合物中各组分的浓度保持不变,各组分的含量一定(1)逆:可逆反应意义:可逆反应在一定条件下所能达到的或完成的最大程度,即反应限度.可逆反应达到化学平衡状态的标志(1)直接标志: a.正反应速率等于逆反应速率 可为同一物质,也可为不同物质(其比值不一定为1) b.各组分的量不随时间改变而改变浓度或含量(物质的量分数、质量分数、体积分数)注意:用同一种物质来表示反应速率时,当反应达到化学平衡状态时,该物质的生成速率与消耗速率相等,即单位时间内生成与消耗某物质的物质的量相等。 例2、对于反应 2SO2 + O2 2SO3 ,达到化学平衡状态时,试推断 a.单位时间内有2 mol SO2消耗,同时有2 mol SO2 ; b.单位时间内有2 mol SO3生成,同时有 SO3消耗;2 mol生成例3、一定条件下,可逆反应同一物质② 单位时间内,有2 mol NH3生成,同时有__________消耗③ 单位时间内,有1 mol H2生成,同时有__________消耗1 mol H2① 单位时间内,有1 mol N2反应掉,同时有_______生成不同物质 ① 单位时间内,有1 mol N2反应掉,同时有__________生成,___________反应掉。3 mol H22 mol NH3例4.在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y 气体,发生如下反应:X(g)+ 2Y(g) 2 Z(g),不能作为 反应达到化学平衡状态标志的是( ) A.单位时间内生成和消耗的X的物质的量相等 B.容器内各物质的浓度不随时间变化 C.容器内X、Y、Z的浓度之比为1∶2∶2 D.单位时间消耗0.1 mol X的同时消耗0.2 mol Z C反应物和生成物的浓度都不再改变(注意不是相等)【小结】对于不同类型的可逆反应,某一物理量不变是否可作为平衡已到达的标志,取决于该物理量在平衡到达前后(反应过程中)是否发生变化,若是,则可以作为依据;否则,不行。(2)间接标志: a.各物质的物质的量不随时间改变而改变 b.体系的压强不随时间改变而改变 c.气体的颜色不随时间改变而改变 d.气体的密度或平均相对分子质量不随时间改变而改变如:对于反应前后的气体物质的分子总数不相等的可逆反应来说,如:2SO2+O2 2SO3 可利用混合气体的总压、总体积、总物质的量是否随着时间的改变而改变来判断是否达到平衡。 对于反应前后气体物质的分子数相等的可逆反应,如: H2+I2(g) 2HI 不能用气体的总压、总体积、总物质的量不变来作为判断反应是否达到平衡的标志,因为在此反应过程中,气体的总压、总体积、总物质的量都不随时间的改变而改变。【例5】 下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态 的是( ) A. 反应容器内压强不随时间变化 B. P和S的生成速率相等 C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间而变化B①混合气体的颜色不再改变②混合气体的平均相对分子质量不变③混合气体的密度不变④混合气体的压强不变⑤单位时间内消耗2nmolNO2的同时生成2nmolO2⑥O2气体的物质的量浓度不变 例6.在固定体积的的密闭容器中发生反应: 2NO2 2NO + O2该反应达到平衡的标志是: ① ② ④ ⑥ 例7.在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(固)+3B(气) 2C(气)+D(气) 已达平衡状态的是 ( ) A. 混合气体的压强 B. 混合气体的密度 C. B的物质的量浓度 D. 气体的总物质的量B C例8.下列说法可以证明反应 N2+3H2 2NH3 已达平衡状态的是( )A.1个N≡N键断裂的同时,有3个H-H键形成B.1个N≡N键断裂的同时,有3个H-H键断裂C.1个N≡N键断裂的同时,有6个N-H键断裂D.1个N≡N键断裂的同时,有6个N-H键形成AC例9.在一定温度下,下列叙述不是可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是 ①C的生成 速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB ③A、B、C的浓度不再变化 ④A、B、C的分压强不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化 ⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2②⑧四、化学反应条件的控制1.化学反应条件控制的目的2. 考虑因素:化工生产中调控反应条件时,需要考虑控制反应条件的成本和实际可能性。3.“提高煤的燃烧效率”的研究(1)燃料燃烧的条件①燃料与空气或氧气接触;②温度达到燃料的着火点。 (2)影响煤燃烧效率的条件粉末状(接触面积足够大) 燃料状态:空气用量:足够的空气(适当的量)注意: 空气的通入量要适当,否则过量的空气会带走部分热量,同样会造成浪费。炉膛材料:烟道废气中的热能:保温隔热材料(防止热量散失)循环利用(3)提高燃料燃烧效率的措施①尽可能使燃料完全燃烧,提高能量的转化率。关键是燃料与空气或氧气尽可能充分接触,且空气要过量。②尽可能充分地利用燃料燃烧所释放出的热能,提高能源利用率。(1)速率:ν正= ν逆①同一物质: ν生成(A) = ν消耗(A)) 直接标志(2) 各组分的浓度保持不变间接标志——各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。②不同物质v正(A):v逆(B)=化学计量数之比 (根据具体情况分析)判断标志定义特征逆、动、等、定、变化学平衡状态可逆反应化学反应的限度化学平衡状态的建立过程在同一条件下,既能向正反应方向,又能向逆反应方向进行的反应。指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。课堂小结课程结束
高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度完整版ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度完整版ppt课件,共11页。PPT课件主要包含了本节整理提升等内容,欢迎下载使用。
高中化学第二节 化学反应的速率与限度获奖课件ppt: 这是一份高中化学第二节 化学反应的速率与限度获奖课件ppt,共60页。PPT课件主要包含了化学反应的限度,微判断,尝试解答,微训练,研习化学平衡等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度精品ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度精品ppt课件,共60页。PPT课件主要包含了化学反应速率,微判断,尝试解答等内容,欢迎下载使用。














