









- 《化学反应与能量变化》第二课时课件PPT+教学设计 课件 67 次下载
- 《化学反应与能量变化》第三课时课件PPT+教学设计 课件 66 次下载
- 《化学反应的速率与限度》第二课时课件PPT+教学设计 课件 69 次下载
- 《化学反应的速率与限度》第三课时课件PPT+教学设计 课件 63 次下载
- 《认识有机化合物》第一课时课件PPT+教学设计 课件 68 次下载
人教版 (2019)必修 第二册第六章 化学反应与能量第二节 化学反应的速率与限度教学课件ppt
展开人教版高中化学必修二
《化学反应的速率与限度》第一课时 教学设计
课题名 | 《化学反应的速率与限度》第一课时 |
教学目标 | 1.掌握化学反应速率的概念和表示方法。 2.能够进行化学反应速率的简单计算 |
教学重点 | 化学反应速率的概念和表示方法。 |
教学难点 | 化学反应速率的简单计算。 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
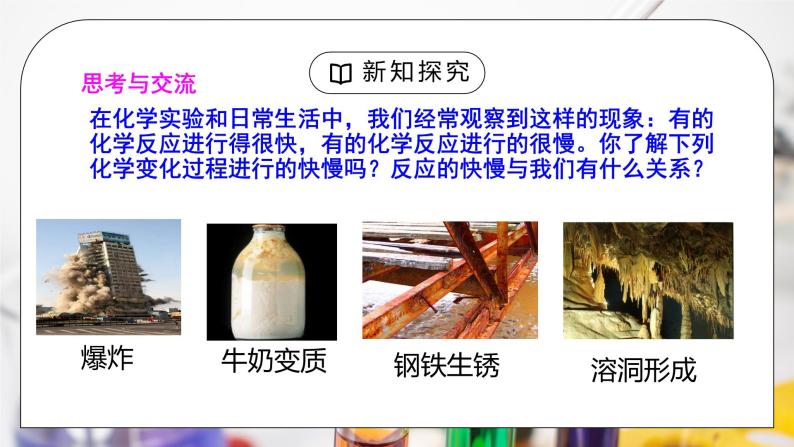
教学过程 | 新课导入 思考与交流:在化学实验和日常生活中,我们经常观察到这样的现象:有的化学反应进行得很快,有的化学反应进行的很慢。你了解下列化学变化过程进行的快慢吗?反应的快慢与我们有什么关系? 化学反应的快慢是相对的! 如何判断一个化学反应的速率呢? 学科连接:在物理中我们是如何定量地判断一个物体移动速度快慢的? 用速度来描述:单位时间内物体移动的距离的大小 【设计意图】 从日常生活中的常见现象引入速率的学习,联系物理知识,加深学生印象。 新课讲授 一、化学反应的速率: 1.定义:用单位时间内反应物或生成物浓度的变化来表示。在容积不变的反应容器中,通常用反应物浓度的减少或生成物浓度的增加来表示。 2.表达式: 3.单位:mol/(L·s)或mol/(L·min) 注意:① 反应速率都是正值。 ② 化学反应速率是一段时间内的平均速率,而不是指瞬时速率。 ③浓度仅指溶液或气体的。一般不用固体或纯液体(其浓度是常数)表示化学反应速率。 例1:在18 L容积的容器中,5 h内产生180 mol物质;在另一容器为12 L的容器中,10 h内产生60 mol物质,问哪个反应速率快? 例2.在2L密闭容器中,在一定条件下进行合成氨的反应 3H2+N2 2NH3,先加入 H2和N2 各 2 mol,反应经 2 min钟后,测得N2的物质的量浓度为0.8 mol/L。求此反应的化学反应速率是多少? 解: 3H2 + N2 2NH3 起始量 1mol/L 1mol/L 0 t=2min 0.4mol/L 0.8mol/L 0.4mol/L 变化量 0.6mol/L 0.2mol/L 0.4mol/L “三段式”法 在应用化学方程式进行有关化学反应速率的计算时,一定弄清三个量:起始浓度(或起始量)、变化浓度(或变化量)、某时刻后的浓度(或某时刻后的量),其中:变化量之比等于化学计量数之比。 认真观察分析:上述化学反应速率的比值与它们在方程式中的化学计量数的比值之间有什么关系? 化学反应速率之比等于它们的计量数之比 注意:同一反应各物质的反应速率之比一定等于其化学计量数之比。 对反应: mA + nB = pY + qZ v (A) ︰v(B)︰v(Y)︰v(Z) = m︰n︰p︰q 同一体系,V相同,△t相同时, △ n物质的量之比等于速率之比也等于化学计量数之比 练习1:合成氨反应:3H2+N2 2NH3,其反应速率可分别为V(H2),V(N2),V(NH3)[用mol/(L·s)表示],则正确的关系( C ) 练习2: 设有以下的气态反应:A + 2 B 2 C,起始浓度c(A)=1 mol/L、c(B) = 1 mol/L、c(C)= 0,1 min后的浓度c(A)= 0.8 mol/L、c(B)= 0.6 mol/L、c(C)= 0.4 mol/L,试分别用A、B、C物质浓度的变化来表示这个反应的速率。 解析: A + 2 B 2 C 起始浓度(mol/L) 1 1 0 变化浓度(mol/L) 1-0.8 1-0.6 0.4-0 终时浓度(mol/L) 0.8 0.6 0.4 V(A)= 0.2 mol/(L•min) V(B)= 0.4 mol/(L•min) V(C)= 0.4 mol/(L•min) 小结:①化学反应速率是标量,反应速率都为正数。 ②一段时间内的平均速率,而不是指瞬时速率。 ③一般不用固体或纯液体(其浓度是常数)表示化学反应速率。 ④用不同物质表示的化学反应速率之比等于化学计量数之比 反应:mA + nB == pC + qD v(A): v(B): v(C): v(D)==m:n:p:q ⑤用不同物质表示的化学反应速率,其值不一定相同,但其表示反应的快慢程度相同——指明具体物质v(A) 练习3.根据化学反应CO+H2O CO2+H2,填写下表中的空白: 练习4.在4个不同的容器中,在不同的条件下进行合成氨反应,根 据在相同时间内测定的结果判断,生成氨的速率最快的是( B ) A.V(H2)= 0.1 mol/L·min B.V(N2)= 0.2 mol/L·min C.V(NH3)= 0.15 mol/L·min D.V(H2)= 0.3 mol/L·min 注:此类题均换算为同一物质的速率为标准比较 对于反应:aA+bB==dD+eE,用不同的物质表示速率满足关系: v(A)∶v(B)∶v(D)∶v(E)=a∶b∶d∶e 即 方法指导:归一法:先统一单位,换算成同一物质表示的反应速率,再比较数值的大小。 比值法:比较化学反应速率与化学计量数的比值,比值越大化学反应速率越大。 想一想:反应 A(g) + 3B(g) = 2C(g) + 2D (g) 在四种不同情况下的反应速率为:①v(A)=0.45mol·L-1·min-1 ②v(B)=0.6mol·L-1·s-1 ③v(C)=0.4mol·L-1·s-1 ④v(D)=0.45mol·L-1·s-1 则该反应速率的快慢顺序为:④>③=②>① 练习5.把0.6molX气体的0.4molY气体混合于2L容器中,使它们发生如下反应:3X+Y= nZ+2W。2min末已生成0.2molW,若测知V(z)=0.1mol/(L·min),则 ⑴上述反应中Z气体的计量数n的值是( ) A.1 B.2 C.3 D.4 ⑵上述反应在2min末时,已消耗的Y占原来的百分比是( ) A.20% B.25% C.33% D.50% 练习6.某温度时,在2 L容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线图,由图中数据分析,该反应的化学方程式为?反应开始至2 min,Z的平均反应速率? 解:由图知,2 min内X、Y、Z物质的量的变化为0.3 mol、0.1 mol、0.2 mol比值为3∶1∶2,可知3 X + Y 2 Z 小结:化学反应速率的计算 (1)定义式法 利用公式v= 计算化学反应速率, 也可利用该公式计算浓度变化量或时间。 (2)关系式法 化学反应速率之比=物质的量浓度变化之比=物质的量变化之比=化学计量数之比。 反应速率大小比较的两种方法 同一化学反应速率用不同物质表示时数值可能不同,比较化学反应速率的快慢不能只看数值大小,还要进行一定的换算。 (1)方法一:换算成同一物质、同一单位表示,再比较数值大小。 (2)方法二:比较化学反应速率与化学计量数的比值。 课堂小结 一、化学反应的速率: 1.定义: 2.表达式: 3.单位:mol/(L·s)或mol/(L·min) 注意事项: 有关化学反应的速率的计算: |
布置作业 |
练习册上相应习题 |
板书设计 | 一、化学反应的速率: 1.定义: 2.表达式: 3.单位:mol/(L·s)或mol/(L·min) 注意事项: 有关化学反应的速率的计算: |
教学反思 |
本节课理论性较强,要求学生掌握有关化学反应的速率的简单计算。教师可以通过多举例让学生掌握知识。 |
高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度完整版ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度完整版ppt课件,共11页。PPT课件主要包含了本节整理提升等内容,欢迎下载使用。
高中化学第二节 化学反应的速率与限度获奖课件ppt: 这是一份高中化学第二节 化学反应的速率与限度获奖课件ppt,共60页。PPT课件主要包含了化学反应的限度,微判断,尝试解答,微训练,研习化学平衡等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度精品ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度精品ppt课件,共60页。PPT课件主要包含了化学反应速率,微判断,尝试解答等内容,欢迎下载使用。














