

- 新高三化学暑假特训卷含答案1 试卷 1 次下载
- 新高三化学暑假特训卷含答案2 试卷 1 次下载
- 新高三化学暑假特训卷含答案3 试卷 1 次下载
- 新高三化学暑假特训卷含答案4 试卷 1 次下载
新高三化学暑假特训卷含答案5
展开1.化学与人类生产、生活密切相关,下列说法正确的是( )
A.减少SO2的排放,可以从根本上消除雾霾
B.硅酸多孔、吸水能力强,常用作袋装食品的干燥
C.绿色化学的核心是利用化学原理对环境污染进行治理
D.医用消毒酒精中乙醇的浓度为95%
2.常温下,下列有关溶液组成的描述合理的是( )
A. 水电离的c (H+)=1×10-13溶液中可能大量存在Al3+、NH4+、Cl-、S2-
B. Kw/ c (H+)= 1×10-13溶液中可能大量存在Na+、ClO-、SO42-、I-
C. pH=8的溶液中可能大量存在Na+、K+、Cl-、HCO3-
D. pH=7 的溶液中可能大量存在Fe3+、K+、Cl-、SO42-
3.W、X、Y、Z为原子序数依次增大的短周期主族元素。W的原子半径是周期表中最小的;X2-与Y+的电子层结构相同;Z的最高正价与最低负价的代数和为4。下列说法正确的是( )
A.原子半径:Z
D.Y与Z位于同一周期,且它们在自然界中均能以游离态的形式存在
4.下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
5.用NaOH固体配制一定物质的量浓度的NaOH溶液。下列操作中正确的是( )
A. 将固体氢氧化钠直接放在托盘天平左盘上称量
B. 将烧杯中溶解固体氢氧化钠所得溶液,冷却到室温后转移至容量瓶中
C. 定容时,如果加水超过刻度线,用胶头滴管直接吸出多余的部分
D. 定容、摇匀后,发现液体体积低于刻度线,再补加少量蒸馏水至刻度线
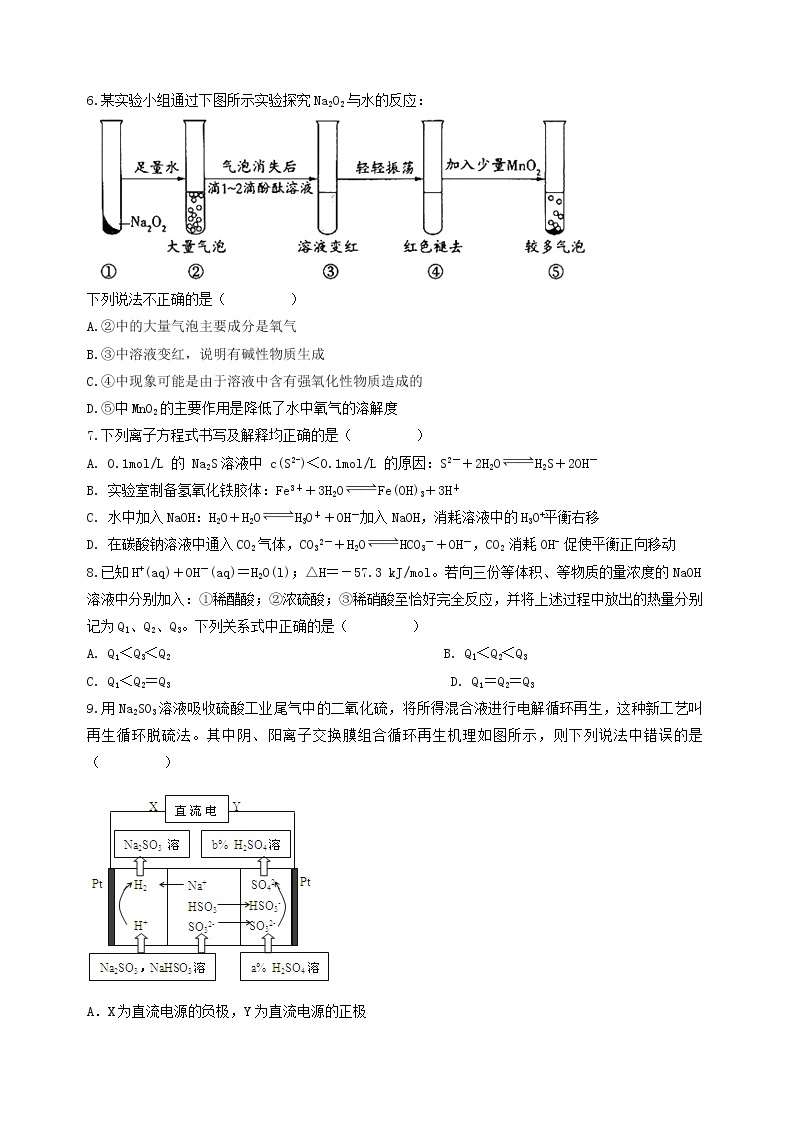
6.某实验小组通过下图所示实验探究Na2O2与水的反应:
下列说法不正确的是( )
A.②中的大量气泡主要成分是氧气
B.③中溶液变红,说明有碱性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
7.下列离子方程式书写及解释均正确的是( )
A. 0.1ml/L 的 Na2S溶液中 c(S2-)<0.1ml/L 的原因:S2-+2H2OH2S+2OH-
B. 实验室制备氢氧化铁胶体:Fe3++3H2OFe(OH)3+3H+
C. 水中加入NaOH:H2O+H2OH3O++OH-加入NaOH,消耗溶液中的H3O+平衡右移
D. 在碳酸钠溶液中通入CO2气体,CO32-+H2OHCO3-+OH-,CO2 消耗OH- 促使平衡正向移动
8.已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/ml。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是( )
A. Q1<Q3<Q2 B. Ql<Q2<Q3
C. Q1<Q2=Q3 D. Q1=Q2=Q3
9.用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列说法中错误的是( )
A.X为直流电源的负极,Y为直流电源的正极
B.图中两处硫酸的质量分数b>a
C.该过程中的产品主要为H2SO4和H2
D.阳极区pH增大
10.下列图示与对应的叙述相符的是( )
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•ml﹣1
B.图2表示压强对可逆反应2A(g)+2 B(g)⇌3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
11.在t℃时,AgBr在水中的沉淀溶解平衡曲线如下图所示,下列说法不正确的是( )
A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,往AgBr饱和溶液加入KI固体,会产生黄色沉淀
12.设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14g乙烯和丙烯混合气体中的氢原子数为2NA
B. 27g铝中加入1ml/L的NaOH溶液,转移电子数是3NA
C. 1 mlFe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,44. 8LNO与22. 4LO2反应后的分子数是2NA
13.准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.1000 ml·L-1 NaOH溶液滴定,下列说法正确的是( )
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
C. 用25 mL酸式滴定管量取20.00mL待测HCl溶液于锥形瓶中
D. 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
14.下图是几种常见有机物之间的转化关系,有关说法正确的是( )
A.有机物a只能是淀粉
B.反应①、②、③均为取代反应
C.有机物c可以使酸性高锰酸钾溶液褪色
D.有机物d的羧酸类同分异构体只有1种
15.下列实验装置或操作能达到实验目的的是 ( )
A. 分离乙醇和乙酸 B. 制取乙酸乙酯
C. 石油的蒸馏 D. 甲烷与氯气反应
16.有机物M 的结构简式如下:下列有关M 叙述不正确的是( )
A.M的分子式为C11H12O3
B.能使溴的四氯化碳溶液褪色
C.一定条件下,M能生成高分子化合物
D.能发生加成反应不能发生取代反应
二、非选择题
17.X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)W的电子式是 。
(2)X与Y在溶液中反应的离子方程式是 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
①装置Ⅰ中反应的化学方程式是 ,
装置Ⅱ中物质的化学式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 。
(从上图选择必要装置,填写编号)
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 。
18.某校化学探究小组同学为探究乙酸乙酯的制备与水解情况,甲、乙同学分别使用图1、图2装置制备乙酸乙酯。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。②相关有机物的沸点:
(1)甲同学在制得乙酸乙酯后,分离乙酸乙酯与饱和碳酸钠溶液的操作是_______________。
(2)试管中装有饱和Na2CO3溶液,其作用是________(填序号)。
A.吸收乙醇 B.除去乙酸
C.乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)甲同学分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出______________;再加入____________(填序号);然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,乙同学利用图2所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管B,再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________ml·L-1。
②分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。
19.如图是用0.1000ml/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
(1)仪器A的名称是__________________;
(2)盐酸的体积读数:滴定前读数为_____mL,滴定后读数为______mL;
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是________________;(保留四位有效数字)
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)_____________;
(5)判断到达滴定终点的实验现象是________________________________。
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是_________;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失._________;
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是___________;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是___________.
参考答案
1.B 2.C 3.C 4.D 5.B 6.D 7.D 8.A 9.D 10.C 11.B 12.A 13.C 14.C 15.D 16.D
17.(1)
(2)HCO3-+OH-=CO2-+H2O
(3)①Na2CO3+H2SO4=Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O Na2O2 ②H2O2 Ⅰ、Ⅳ、Ⅴ
(4)2Na2CO3+Cl2+H2O=NaClO+NaCl+2NaHCO3
18. 分液 ABC 乙醇 C 6 6 AC
19. 酸式滴定管 0.80 22.80 0.1100ml·L﹣1 BDCEAF 当溶液颜色由粉红色变为无色,且半分钟内不变色 偏高 偏低 无影响 偏低
选项
叙述Ⅰ
叙述Ⅱ
A
KNO3的溶解度大
用重结晶法除去KNO3中的NaCl
B
Na2CO3溶液呈碱性
Na2CO3可制成胃药抗酸剂
C
NH3能使酚酞溶液变红
NH3可用于设计喷泉实验
D
BaSO4难溶于酸
用盐酸和BaCl2溶液检验SO42-
试剂
乙醚
乙醇
乙酸
乙酸乙酯
沸点(℃)
34.7
78.5
117.9
77
实验
编号
待测NaOH溶液的体积(mL)
滴定前盐酸的
体积读数mL)
滴定后盐酸的
体积读数(mL)
1
20.00
1.20
23.22
2
20.00
2.21
24.21
3
20.00
1.50
23.48
高考化学三轮冲刺分层专题特训卷基础知识练5 (含解析): 这是一份高考化学三轮冲刺分层专题特训卷基础知识练5 (含解析),共9页。试卷主要包含了根据图判断,下列说法正确的是等内容,欢迎下载使用。
高考化学三轮冲刺分层专题特训卷“7+3”小卷信息练5 (含解析): 这是一份高考化学三轮冲刺分层专题特训卷“7+3”小卷信息练5 (含解析),共10页。试卷主要包含了可能用到的相对原子质量,化学与生活密切相关,下列关于有机物的说法中错误的是等内容,欢迎下载使用。
2023届河北省衡水中学、泰华中学高三 决胜新高考 化学暑假必刷密卷第5套(PDF版): 这是一份2023届河北省衡水中学、泰华中学高三 决胜新高考 化学暑假必刷密卷第5套(PDF版),共13页。












