
湖北省襄阳市襄州二中2022届高三化学高考备考二轮复习化学能与热能专项训练
展开一、选择题(15题)
1.硫元素广泛分布于自然界,其相图(用于描述不同温度、压强下硫单质的转化及存在状态的平衡图像)如图。已知正交硫和单斜硫是硫元素的两种常见单质,且燃烧的热化学方程式为:S(正交,s)+O2(g)=SO2(g) ΔH1;S(单斜,s)+O2(g)=SO2(g) ΔH2。则下列有关说法正确的是
A.正交硫和单斜硫互为同分异构体
B.温度低于95.5℃且压强大于0.1Pa,正交硫发生升华现象
C.图中M→N过程为固态硫的液化,该过程只发生物理变化
D.由上述信息可判断:ΔH1>ΔH2
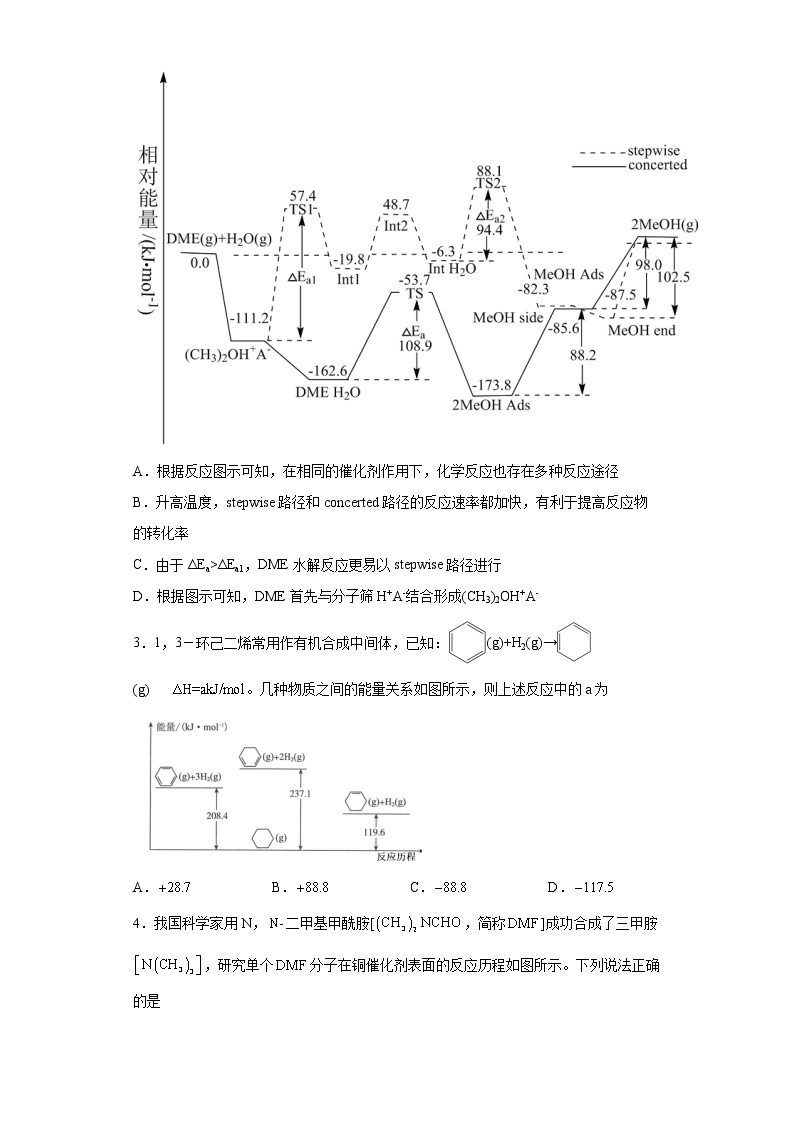
2.科学家研究二甲醚(DME)在H-ZSM-5分子筛(用H+A-表示)上的水解反应,其反应进程中能量变化如图所示。下列说法正确的是
A.根据反应图示可知,在相同的催化剂作用下,化学反应也存在多种反应途径
B.升高温度,stepwise路径和concerted路径的反应速率都加快,有利于提高反应物的转化率
C.由于ΔEa>ΔEa1,DME水解反应更易以stepwise路径进行
D.根据图示可知,DME首先与分子筛H+A-结合形成(CH3)2OH+A-
3.1,3-环己二烯常用作有机合成中间体,已知:(g)+H2(g)→(g) 。几种物质之间的能量关系如图所示,则上述反应中的a为
A. B. C. D.
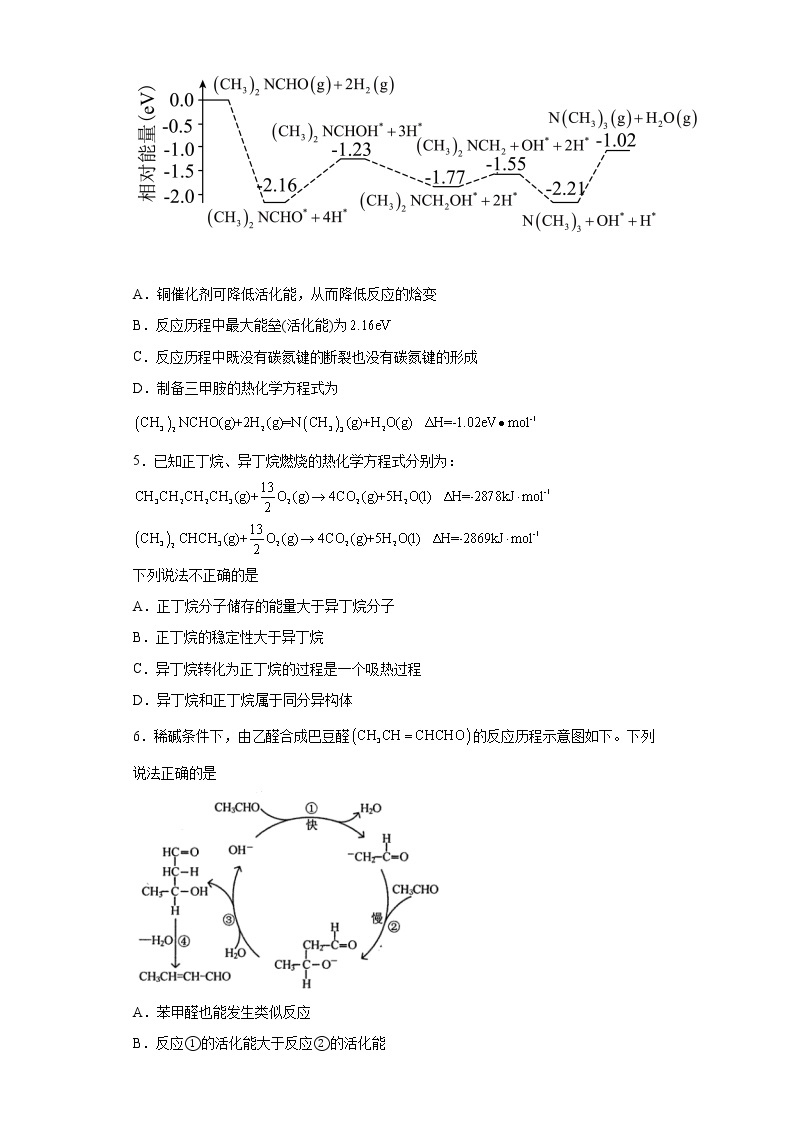
4.我国科学家用N,二甲基甲酰胺[,简称]成功合成了三甲胺,研究单个分子在铜催化剂表面的反应历程如图所示。下列说法正确的是
A.铜催化剂可降低活化能,从而降低反应的焓变
B.反应历程中最大能垒(活化能)为
C.反应历程中既没有碳氮键的断裂也没有碳氮键的形成
D.制备三甲胺的热化学方程式为
5.已知正丁烷、异丁烷燃烧的热化学方程式分别为:
下列说法不正确的是
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个吸热过程
D.异丁烷和正丁烷属于同分异构体
6.稀碱条件下,由乙醛合成巴豆醛的反应历程示意图如下。下列说法正确的是
A.苯甲醛也能发生类似反应
B.反应①的活化能大于反应②的活化能
C.反应中,均为反应催化剂
D.由上述历程可知醛基的酸性强于醇羟基
7.肼()在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。
已知200℃时:反应Ⅰ:
反应Ⅱ:
下列说法不正确的是
A.图1所示过程①、②都是放热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开中的化学键吸收的能量小于形成和中的化学键释放的能量
D.200℃时,肼分解生成和的热化学方程式为
8.利用CH3OH、CO2与H2合成CH3CH2OH的反应主要历程如图所示。下列说法错误的是
A.合成过程涉及C-C键和C-O键形成
B.CO是合成乙醇的中间体
C.第3步的反应式为CH3I+CO+2H2→CH3CH2OH+HI
D.若用CH3OD替代CH3OH,则可生成CH3CH2OD
9.二维锑片(Sb)是一种新型的CO2电化学还原催化剂。酸性条件下人工固碳装置中CO2气体在Sb表面发生三种催化竞争反应,其反应历程如下图所示(*表示吸附态中间体)。下列说法不正确的是
A.生成HCOOH吸收的能量最多
B.使用Sb改变了反应的路径
C.Sb电极表面生成CO的反应为:*CO2+2e-+H2O = CO+2OH-
D.Sb对三种催化竞争反应的选择效果为HCOOH>H2>CO
10.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,如图为该历程示意图。下列说法错误的是
A.①→②放出能量并形成了C―C键
B.催化剂可提高反应物的平衡转化率
C.生成CH3COOH总反应的原子利用率为100%
D.CH4→CH3COOH过程中,有C―H键发生断裂
11.活泼自由基与氧气的反应一直是关注的热点。HNO自由基与O2反应过程的能量变化如图所示,下列说法正确的是
A.参与反应的反应物总键能大于生成物的总键能
B.产物P1与P2的分子式、氧元素的化合价均相同
C.相同条件下,Z转化为产物的速率:v(P1)>v(P2)
D.该历程中最大正反应的活化能E正=186.19kJ
12.某反应过程的能量变化如图所示。下列说法正确的是
A.反应过程a有催化剂参与
B.该反应为吸热反应,反应热为△H
C.活化分子之间的碰撞一定是有效碰撞
D.加入适宜的催化剂,可使反应物分子中活化分子的百分数增大,因而增大化学反应速率
13.烷烃中的氢原子被卤原子取代的反应是一个自由基反应。例如:甲烷与氯气光照得到一氯甲烷的反应分为两步,反应过程中的能量变化示意图如下:
下列说法不正确的是
A.CH3∙(甲基)的电子式为
B.第二步反应的活化能为
C.Cl∙浓度大小对生成的反应速率有较大影响
D.
14.已知:顺-2-丁烯()与反-2-丁烯()互为顺反异构体,其加成氢气制备丁烷的能量变化图如下。下列说法正确的是
A.稳定性:顺-2-丁烯>反-2-丁烯
B.
C.顺-2-丁烯转化为反-2-丁烯的过程属于物理变化
D.完全燃烧等质量和,前者放热多
15.如图为氟利昂()破坏臭氧层的反应过程示意图,下列说法不正确的是
A.过程Ⅰ中断裂共价键C-Cl键
B.过程Ⅱ可表示为
C.过程Ⅲ中是吸热过程
D.上述过程说明氟利昂中氯原子是破坏的催化剂
二、工业流程题(4大题)
16.丙烯在有机化工中用途广泛,除了制备聚丙烯,还可制备1,2-二氯丙烷、丙烯醛、丙烯酸等。回答下列问题:
(1)用加成法制备1,2-二氯丙烷,主、副反应依次为:
已知中逆反应的活化能为164,则正反应的活化能为___________。
(2)丙烷无氧脱氢法制备丙烯反应如下:
①某温度下,在刚性密闭容器中充入(g),起始压强为10kPa,平衡时总压为14kPa,则的平衡转化率为_________,该反应的压强平衡常数_________kPa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
②分别在总压为100kPa、10kPa时发生该反应,平衡体系中(g)和(g)的物质的量分数随温度的变化关系如图所示,其中代表压强为100kPa时的曲线是_________(填曲线标号)。
(3)丙烷氧化脱氢制备丙烯,还发生副反应生成CO、等,其主反应如下: ,相同时间内,在某催化剂作用下(g)的转化率和(g)的产率随温度的变化关系如图所示。
①图中的转化率随温度升高而增大的原因是___________。
②575℃时,的选择性为___________ [的选择性],能提高其选择性的措施为___________。
17.氢气最早于16世纪被人工制取出来,氢气是一种清洁能源。
(1)利用光伏电池电解水制H2是氢能的重要来源。
已知:H—H键、O=O键、H—O键的键能依次为436kJ·mol-1、495kJ·mol-1、463kJ·mol-1。则2H2O(g)=2H2(g)+O2(g) △H=____kJ·mol-1。
(2)T1℃时,向5L恒容密闭容器中充人0.5molCH4,只发生反应2CH4(g)C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为____;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则0~25s内v(C2H4)=____mol·L-1·s-1。
(3)CH4分解时几种气体的平衡分压(ρPa)的对数值lgρ与温度的关系如图所示。
①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H2(g)和H2(g),只发生反应2CH4(g)C2H2(g)+3H2(g) △H,△H____(填“>”或“<”)0,此时的平衡常数Kp=____(用平衡分压代替浓度进行计算)Pa2。
②若只改变一个反应条件使Kp变大,则该条件是____(填标号)。
A.减小C2H2的浓度 B.升高温度 C.增大压强 D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为____,一段时间后阴、阳两极收集到的气体质量之比为____。
18.将CH4和CO2两种引发温室效应气体转化为合成气(H2和CO),可以实现能量综合利用,对环境保护具有十分重要的意义。
(1)利用CH4、CO2在一定条件下重整的技术可得到富含CO的气体,此技术在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示。
已知:i.CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH1=+206kJ·mol-1
ii.CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ΔH2=+165kJ·mol-1
①过程I反应的化学方程式为___________。
②该技术总反应的热化学方程式为___________。
③反应i甲烷含量随温度变化如图1,图中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示2MPa的是___________。
(2)甲烷的水蒸汽重整涉及以下反应
I.CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH1=+206kJ·mol-1
II.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41kJ·mol-1
在一密闭体积可变容器中,通入1molCH4和3molH2O(g)发生甲烷的水蒸汽重整反应。
①反应II平衡常数K(500℃)___________K(700℃)(填“>”“<”或“=”)。
②压强为P0kPa时,分别在加CaO和不加CaO时,平衡体系H2的物质的量随温度变化如图2所示。温度低于700℃时,加入CaO可明显提高混合气中H2的量,原因是___________。
③500℃时,反应相同时间后测得CH4的转化率随压强的变化如图3所示。则图2中E点和G点CH4的浓度大小关系为c(G)___________c(E)((填“>”“<”或“=”);结合的图2、图3,计算500℃、P0kPa下反应II的分压平衡常数Kp(用分压代替浓度,分压等于总压×物质的量分数)为___________。
19.将二氧化碳转化为高附加值碳基燃料可有效减少碳排放。二氧化碳催化加氢制甲醇[CO2(g)+3H2(g)CH3OH(g)+H2O(g)]引起了科学界和工业界的极大兴趣。回答下列问题:
(1)相关的化学键键能数据如表所示。
化学键
H—H
C=O
H—O
C—H
C—O
E(kJ/mol)
436
745
465
413
351
写出二氧化碳催化加氢制甲醇的热化学方程式____。
(2)采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原CO2制备甲醇,该反应历程如图所示。
①该过程容易产生副产物____。
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:____。
Ⅱ.工业中,CO2和H2在催化剂作用下可发生两个平行反应,分别生成CH3OH和CO。
反应a:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1;
反应b:CO2(g)+H2(g)CO(g)+H2O(g) △H2>0。
在传统的催化固定反应床(CFBR)中,CO2转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(MR)用于CO2催化加氢制备甲醇,极大地改善了该问题,原理如图所示。
保持压强为5MPa,向密闭容器中投入一定量CO2和H2,不同反应模式下CO2的平衡转化率和甲醇选择性的相关实验数据如表所示。
实验组
反应模式
压强/MPa
温度/℃
CO2转化率
CH3OH选择性
①
CFBR
3
5
250
25.6
61.3
②
CFBR
3
5
230
20.0
70.0
③
CMR
3
3
260
36.1
100
已知CH3OH选择性:转化的CO2中生成CH3OH的百分比。
(3)CFBR模式时,投料比=3一定温度下发生反应,下列说法能作为反应a达到平衡状态的判据是____(填选项字母)。
A.气体压强不再变化
B.CO的体积分数不再变化
C.气体平均相对分子质量不再变化
D.不再变化
E.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
(4)由表中数据可知CMR模式下,CO2的转化率显著提高,结合具体反应分析可能的原因:____。
(5)压力平衡常数Kp是指用平衡分压代替平衡浓度进行计算的平衡常数,平衡分压=p总×物质的量分数。根据表中数据计算温度为230℃时,反应a的Kp值为____(无需计算,写表达式)。
参考答案:
1.D
A.正交硫和单斜硫均是硫元素组成的单质,二者互为同素异形体,A项错误;
B.温度低于95.5℃且压强大于0.1Pa,正交硫是固态,需要降压才能升华为气态,B项错误;
C.图中M→N过程为固态硫的液化,该过程先由正交硫经过转化为单斜硫再变成液体,中间发生了化学变化,C项错误;
D.在同压条件下,升温由正交硫转化为单斜硫,说明单斜硫能量高,单斜硫燃烧热高,ΔH均为负值,则ΔH1>ΔH2,D项正确;
故选D。
2.D
A.根据反应图示可知,在相同的催化剂作用下,化学反应存在一种反应途径,A错误;
B.升高温度,stepwise路径和concerted路径的反应速率都加快,不改变其它,平衡不改变,转化率不变,B错误;
C.由于ΔEa<ΔEa1,活化能越大,反应速率越慢,DME水解反应更易以concerted路径进行,C错误;
D.根据图示信息可知,DME首先与分子筛H+ A-结合形成(CH3)2OH+ A-,D正确;
故选D。
3.A
①(g)+3H2(g) (g) ;
②(g)+ 2H2(g) (g) ;由盖斯定律可得目标方程等于①+②,则,综上所述A符合题意,故选A;
答案选A。
4.C
A. 催化剂可以降低活化能,而反应的焓变与反应物质的始态和终态有关,加入催化剂反应的始态、终态相同,则焓变相同,选项A错误;
B.从图中可以看出,正向进行的三个反应中,其能垒分别为-1.23eV-(-2.16eV)=0.93eV,-1.55eV-(-1.77eV)=0.22eV,-1.02eV-(-2.21eV)=1.19eV,故最大能垒为1.19eV,选项B错误;
C.反应历程中没有C-N键断裂也没有C-N键生成,选项C正确;
D.制备三甲胺的热化学方程式为,选项D错误;
答案选C。
5.B
①CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) ∆H=-2878kJ·mol-1
②(CH3)2CHCH3(g)+O2(g)→4CO2(g)+5H2O(l) ∆H=-2869kJ·mol-1
由①-②可得CH3CH2CH2CH3(g)→(CH3)2CHCH3(g),∆H=-2878kJ•mol-1+2869kJ•mol-1=-9kJ•mol-1。
【详解】
A.从正丁烷转化成异丁烷是放热过程,说明正丁烷分子储存的能量大于异丁烷分子,故A不符合题意;
B.CH3CH2CH2CH3(g)→(CH3)2CHCH3(g),∆H<0,能量越低物质越稳定,因此异丙烷比正丁烷稳定,故B符合题意;
C.正丁烷转化成异丁烷CH3CH2CH2CH3(g)→(CH3)2CHCH3(g),∆H<0,是放热过程,则反过来异丁烷转化为正丁烷的过程是一个吸热过程,故C不符合题意;
D.异丁烷和正丁烷是同分异构体,故D不符合题意;
故选B。
6.D
A.苯甲醛无,不能发生类似反应,故A错误;
B.反应①较快,反应②较慢,反应越慢活化能越大,故B错误;
C.由图中可知,OH-为反应的催化剂,H2O为反应的中间产物,故C错误;
D.由上述历程可知,CH3CHO可制得,故可知醛基的酸性强于醇羟基,故D正确;
故选D。
7.A
A.由已知信息“反应Ⅰ”知,过程①为放热反应;根据盖斯定律:Ⅰ-2×Ⅱ得N2H4(g)=N2(g)+2H2(g) ΔH=-32.9kJ/mol-2×(-41.8kJ/mol)=+50.7kJ/mol,过程②为吸热反应,故A错误;
B.反应Ⅱ为放热反应,反应物能量高于生成物能量,故B正确;
C.由反应Ⅰ知,断开3molN2H4(g)中的化学键吸收的能量小于形成1molN2(g)和4molNH3(g)中的化学键释放的能量,故C正确;
D.根据盖斯定律:Ⅰ-2×Ⅱ得N2H4(g)=N2(g)+2H2(g) ΔH=-32.9kJ/mol-2×(-41.8kJ/mol)=+50.7kJ/mol,过程②为吸热反应,D正确;
故选A。
8.D
A.根据图示可知:在反应3中有C-C键和C-O键形成,A正确;
B.根据图示可知:在反应开始时无CO,在反应结束时生成物中无CO,因此CO是合成乙醇的中间体,B正确;
C.根据图示可知第3步反应的反应物是CH3I、CO、H2,生成物是CH3CH2OH及HI,则该反应的化学方程式为:CH3I+CO+2H2→CH3CH2OH+HI,C正确;
D.根据反应3可知反应产生乙醇中的-OH上H原子种类取决于H2中的H原子的种类,而与CH3OH上的H原子种类无关,所以若用CH3OD替代CH3OH,生成的乙醇仍然是CH3CH2OH ,而不会是CH3CH2OD,D错误;
故合理选项是D。
9.C
A.生成三种产物中HCOOH的能量最大,故吸收的能量最多,A正确;
B.从图中看,催化剂Sb改变了反应的路径,B正确;
C.反应条件为酸性,所以不可能生成OH-,C错误;
D.活化能越小,反应越容易进行,生成HCOOH的活能量最小,生成CO的活能量最大,生成H2的活能量居中,D正确。
答案选C。
10.B
A.从图中可知,①的能量高于②,从生成,放出能量并形成了C―C键,A正确;
B.催化剂可提高反应的速率,不能影响平衡的移动,不会提高平衡转化率,B错误;
C.综合分析该历程,CO2+ CH4→CH3COOH,总反应的原子利用率为100%,C正确;
D.CH4→CH3COOH过程中,CH4的C―H键发生断裂,D正确;
故选B。
11.C
A.从图中可以看出,反应物所具有的能量之和比生成物所具有的能量之和高,总反应是放热反应,参与反应的反应物总键能小于生成物的总键能,故A说法错误;
B.产物P1与P2的分子式相同,但P1中有过氧键,有两个O化合价是-1价,1个氧是-2价,P2中氧化合价是-2价,故B说法错误;
C.由图示可知,由Z到产物P1所需的活化能低于由Z到产物P2所需的活化能,则由中间产物Z转化为产物的速率:v(P1)>v(P2),故C说法正确;
D.由图示可知中间产物Z到过渡态Ⅳ所需的活化能最大,则E=-18.92kJ·mol-1-(-205.11kJ·mol-1)=186.19kJ·mol-1,单位错误,故D说法错误;
答案为C。
12.D
A.从图可以看出,a是没有催化剂参与的反应,选项A错误;
B.从图看出,反应物的能量高于生成物的能量,反应为放热反应,选项B错误;
C.活化分子之间的碰撞不一定是有效碰撞,选项C错误;
D.加入适宜的催化剂,可使反应物分子中活化分子的百分数增大,因而增大化学反应速率,选项D正确。
答案选D。
13.A
A.CH3∙(甲基)的电子式为,故A错误;
B.第二步反应的活化能为258.5kJ/mol-250.2kJ/mol=,故B正确;
C.Cl∙为反应的催化剂,催化剂影响反应速率,故C正确;
D.由图像的始态和末态可知,,故D正确;
故选A。
14.D
A.能量越低越稳定,由图可知,反-2-丁烯()能量更低,A错误;
B.①(g)+H2(g)=CH3CH2CH2CH3(g)△H=-119.7kJ/mol,②(g)+H2(g)=CH3CH2CH2CH3(g)△H=-115.5kJ/mol根据盖斯定律①-②可知 ,B错误;
C.顺-2-丁烯转化为反-2-丁烯的过程属于化学变化有新物质生成,C错误;
D.完全燃烧等质量,前者放热多,因为前者能量更高,D正确;
答案选D。
15.C
A.过程Ⅰ中CFCl3转化为CFCl2和氯原子,断裂极性键C-Cl键,A正确;
B.根据图示信息可知,过程Ⅱ可表示为:O3+Cl=ClO+O2,B正确;
C.O+O=O2为原子结合成分子的过程即化学键的形成过程,为放热过程,C错误;
D.上述过程说明,氟利昂中氯原子在反应前后不变,是破坏O3的催化剂,D正确;
故答案为:C。
16.(1)132
(2) 40% 2.67 x
(3) 温度升高,反应速率加快,温度升高,催化剂活性增大 0.5 选择相对较低的温度
【解析】
(1)
①
②
根据盖斯定律①-②得,焓变=正反应活化能-逆反应活化能,逆反应的活化能为164,则正反应的活化能为132。
(2)
①某温度下,在刚性密闭容器中充入(g),起始压强为10kPa,平衡时总压为14kPa,
10-x+2x=14,x=4;则的平衡转化率为,该反应的压强平衡常数=2.67kPa。
②分别在总压为100kPa、10kPa时发生该反应,正反应吸热,升高温度平衡正向移动,(g)含量减小,增大压强,平衡逆向移动,(g)含量增大,所以代表压强为100kPa时的曲线是x。
(3)
①温度升高,反应速率加快,温度升高,催化剂活性增大,所以的转化率随温度升高而增大。
②575℃时,的选择性为=0.5,根据图像,选择相对较低的温度能提高其选择性。
17.(1)+485
(2) 80% 0.001
(3) > 105 B
(4) 6NH-6e-=N2↑+4NH3(l) 3:14
【解析】
(1)
△H=反应物总键能-生成物总键能=(4463-2436-495)kJ/mol=+485kJ/mol。
(2)
设平衡时c(C2H4)为xmol/L,依据方程式可知,消耗c(CH4)为2xmol/L,平衡时c(H2)为2xmol/L,平衡时c(CH4)为(0.1-2x)mol/L,而达到平衡时,测得c(C2H4)=2c(CH4),则有x=2(0.1-2x),解得x=0.04,CH4的转化率为;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则有0.1-2x=2x,解得x=0.025,v(C2H4)==0.001mol·L-1·s-1。
(3)
①题中图从右向左观察,随着温度升高,lgp(CH4)减小,则甲烷平衡分压减小,甲烷平衡转化率增大,说明温度升高,平衡正向移动,则正反应为吸热反应,焓变△H>0,此时的平衡常数==。
②平衡常数只与温度有关,温度不变平衡常数不变,该反应为吸热反应,升高温度,平衡正向移动,平衡常数增大,因此若只改变一个反应条件使Kp变大,则该条件是升高温度,答案选B。
(4)
电解液氨的总反应为2NH33H2↑+N2↑,阳极氨气失电子得到氮气和氢离子,生成的氢离子又与NH结合生成氨气,因此阳极电极反应式为:6NH-6e-=N2↑+4NH3(l);阳极收集到氮气、阴极收集到氢气,依据总反应可知,一段时间后阴、阳两极收集到的气体物质的量之比为3:1,则质量之比为6:28=3:14。
18.(1) CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+247.4kJ/mol CH4(g)+ 3CO2(g) ⇌4CO(g)+ 2H2O(g) △H=+329.8kJ/mol a
(2) > 加入CaO的体系与二氧化碳反应,使反应I、II的化学平衡正向移动,氢气含量增大 > 1
【解析】
【分析】
根据盖斯定律,由已知热化学方程式求出所求热化学方程式;由题中图示可知,过程II的反应分两步,依据各步反应可判断;根据催化剂只影响化学反应速率,不影响化学平衡移动,则使用不同的催化剂,达平衡时CH4转化率是一样的予以判断;根据化学平衡“三段式”计算CO2的分压,v(CO),Kp的值。
(1)
①由题图可知,过程I发生CH4+CO2 2CO+2H2反应,根据I.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ/mol ;II.CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH2=-165kJ/mol;根据盖斯定律,则I×2+II得:Ⅲ.CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH3=2ΔH1+ ΔH2=2×206.2kJ/mol+(-165kJ/mol)=+247.4kJ/mol;答案为CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247.4kJ/mol;
②由题图可知,该技术总反应的化学方程式为CH4(g)+ 3CO2(g) ⇌4CO(g)+ 2H2O(g) 根据盖斯定律,由Ⅲ×2+ II得反应CH4(g)+ 3CO2(g) ⇌4CO(g)+ 2H2O(g) ΔH= ΔH3×2+ ΔH2=+329.8kJ/mol;
③对于吸热反应,压强一定时,升高温度,平衡正向移动,甲烷含量应减少,故排除曲线c、d;温度一定时,增大压强,平衡逆向移动,甲烷含量将增加,故曲线b表示2MPa时的甲烷含量曲线;
(2)
①反应II是放热反应,升高温度平衡逆向移动,平衡常数减小,故平衡常数K(500℃) >K(700℃);
②CaO为碱性氧化物,加入CaO的体系与二氧化碳反应,使反应II的化学平衡正向移动,CO浓度降低,反应Ⅰ的平衡也正向移动,使氢气含量增大,故答案为:加入CaO的体系与二氧化碳反应,使反应I、II的化学平衡正向移动,氢气含量增大;
③500°C时, E点压强低于G点压强,G点甲烷浓度大。根据题中图像分析,500°C时, 压强为P0,氢气含量为2.1mol,甲烷转化率为0.6,所以反应I中消耗1mol×0.6 = 0.6molCH4,同时消耗0.6molH2O、生成0.6molCO、生成1.8molH2, 反应Ⅱ生成2.1mol-1.8mol = 0.3molH2,同时消耗0.3molH2O、消耗0.3molCO、生成0.3molCO2,平衡时,CO、H2O、CO2、H2、CH4别为0.3mol、2.1mol、 0.3mol、 2.1mol、0.4mol, 平衡分压分别为P0、P0、P0、P0,所以Kp=,答案为>;1。
19.(1)CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-187kJ/mol
(2) CO和CH2O *CO+*OH→*CO+*H2O
(3)BCD
(4)CMR模式下,只发生反应a,双功能分子筛催化膜反应器能及时分离出产物水蒸气,使平衡右移,二氧化碳的产率增大
(5)
【解析】
(1)
该反应断裂2molC=O、3molH−H,形成、3molC−H、1molC−O、3molH−O, ,则其热化学方程式为:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-187kJ/mol;
(2)
①由图可知,该过程中有副产物和产生;
②反应慢的步骤决定整体反应速率,据图可知合成甲醇的过程中的活化能最大,反应速率最慢,所以需要主要降低该步骤中的能量变化;
(3)
A.气体压强不再变化由题意可知,反应容器压强为不变,反应a和反应b在CFBR模式下反应达到平衡状态时,气体压强不变,故压强不变不能证明反应达到平衡,A错误;
B.反应b生成一氧化碳,其体积分数不断增加,CO的体积分数不再变化,可以证明反应达到平衡,B正确;
C.这两个反应中,所有的反应物,产物都是气体,故总质量不变,但是反应a前后气体计量系数不同,故气体总物质的量是不断变化的,因此气体平均相对分子质量不再变化可以证明反应达到平衡,C正确;
D.反应a中两种物质的投料比和系数比相等,反应b中两种物质的投料比和系数比不相等,是不断变化的,故不再变化可以证明反应达到平衡,D正确;
E.反应中各种物质的物质的量之比是无法确定的,故CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1,无法确定反应达到平衡,E错误;
故选BCD;
(4)
CMR模式下,只发生,双功能分子筛催化膜反应器能及时分离出产物水蒸气占主导因素,平衡右移,二氧化碳的产率增大,故答案为:CMR模式下,只发生反应a,双功能分子筛催化膜反应器能及时分离出产物水蒸气,使平衡右移,二氧化碳的产率增大;
(5)
设和起始投料分别为1mol和3mol。由表中数据知时二氧化碳的平衡转化率为,得知平衡时的物质的量为0.8mol。参与反应a生成甲醇的选择性是,参与反应的选择性则是。存在两个平衡体系,分别写出三段式如下:
反应:;反应: ,(注:三段式表达反应a的和平衡时的物质的量时,要考虑反应中的变化量。平衡时反应消耗为,生成为)平衡体系五种气体总物质的量为。平衡时,反应中、、、四种气体的物质的量分数分别为:、、、;。








