
高中化学第二节 化学反应的速率与限度导学案
展开1.“变量控制法”的简介
科学研究中,对于多因素(多变量)的问题,常常采用只改变其中的某一个因素,控制其他因素不变的研究方法,使多因素的问题变成几个单因素的问题,分别加以研究,最后再将几个单因素问题的研究结果加以综合。这种变量控制的方法是科学探究中常用的方法。例如,探究温度对化学反应速率的影响时,控制浓度和其他影响因素相同;而比较不同浓度对化学反应速率的影响时,则控制温度和其他影响因素相同;最后综合得出影响化学反应速率的多种因素。
2.常见考查形式
(1)以表格的形式给出多组实验数据,让同学们找出每组数据的变化对化学反应速率的影响。
(2)给出影响化学反应速率的几种因素,让同学们设计实验并分析各因素对化学反应速率的影响。
3.解题策略
(1)确定变量:解答这类题目时首先要认真审题,找出影响实验探究结果的因素。
(2)定多变一:在探究时,应先控制其他的因素不变,只改变一种因素,探究这种因素与所探究问题的关系,然后按此方法依次分析其他因素与所探究问题的关系。
(3)数据有效:解答时注意选择的数据(或设置的实验)要有效,且变量统一,否则无法作出正确判断。
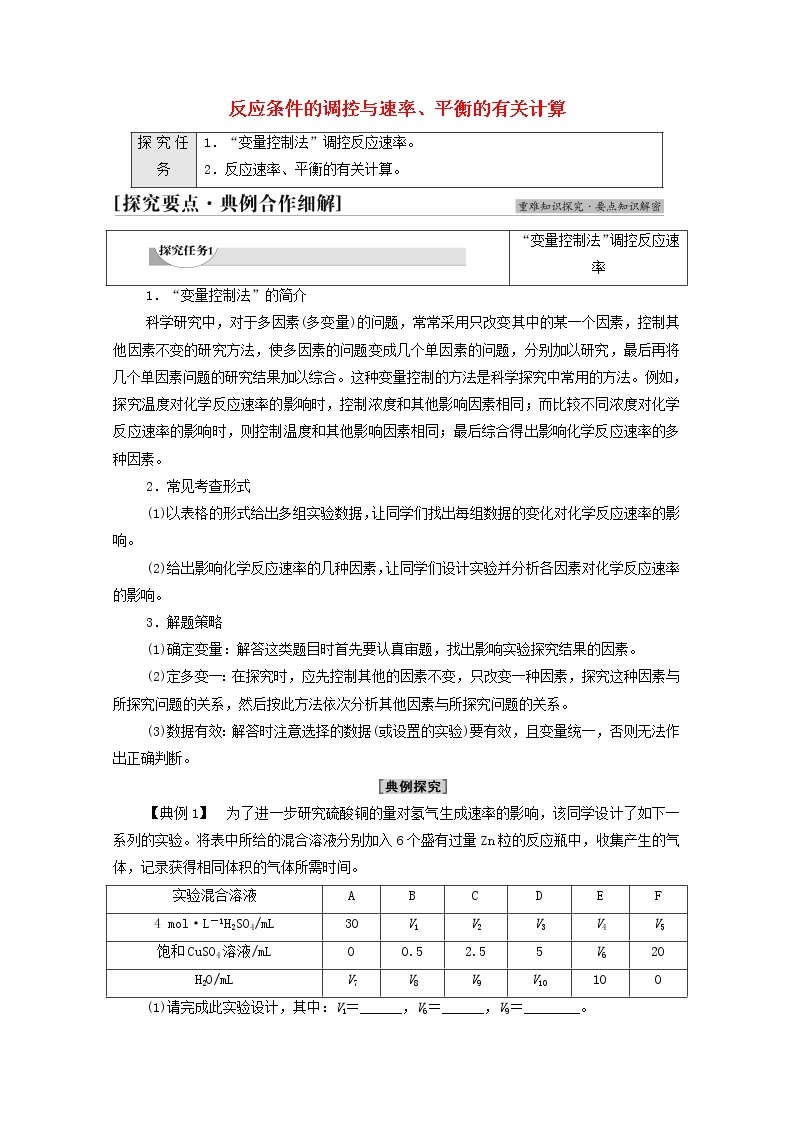
【典例1】 为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
(1)请完成此实验设计,其中:V1=______,V6=______,V9=________。
(2)该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:___________________________。
[解析] (1)为了进一步研究硫酸铜的量对氢气生成速率的影响,则硫酸的浓度应该是相同的,因此最终溶液的体积必需相等,A组中硫酸为30 mL,那其他组硫酸也为30 mL,根据表中数据可知总体积是50 mL,则V1=30,V6=50-10-30=10,V9=50-30-2.5=17.5。
(2)当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积,且H2SO4溶液的浓度变得较小,因此反应速率会减小。
[答案] (1)30 10 17.5
(2)当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积,且H2SO4溶液的浓度变得较小
1.不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测得的实验数据如图所示。下列分析或推测不合理的是( )
A.一定时间内,Fe2+的氧化率随时间延长而逐渐增大
B.由②和③可知,pH越大,Fe2+氧化速率越快
C.由①和③可知,温度越高,Fe2+氧化速率越快
D.氧化过程的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O
B [由图像可知,一定时间内,Fe2+的氧化率随时间延长而逐渐增大,故A正确;由②和③可知,当温度相同而pH不同时,pH越大,Fe2+的氧化速率越慢,故B错误;由①和③可知,当pH相同而温度不同时,温度越高,Fe2+的氧化速率越快,故C正确;在酸性条件下,Fe2+和氧气、氢离子反应生成Fe3+和H2O,反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O,故D正确。]
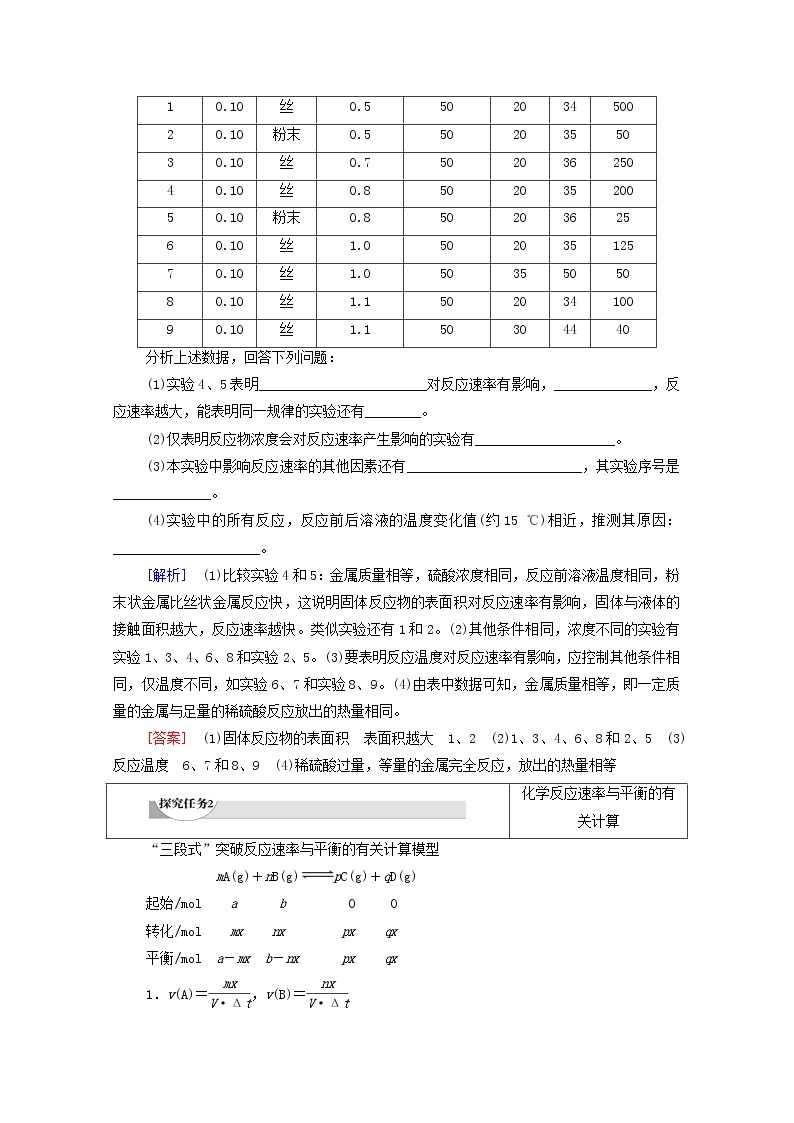
2.下表是稀硫酸与某金属反应的实验数据。
分析上述数据,回答下列问题:
(1)实验4、5表明________________________对反应速率有影响,______________,反应速率越大,能表明同一规律的实验还有________。
(2)仅表明反应物浓度会对反应速率产生影响的实验有____________________。
(3)本实验中影响反应速率的其他因素还有_________________________,其实验序号是______________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:_____________________。
[解析] (1)比较实验4和5:金属质量相等,硫酸浓度相同,反应前溶液温度相同,粉末状金属比丝状金属反应快,这说明固体反应物的表面积对反应速率有影响,固体与液体的接触面积越大,反应速率越快。类似实验还有1和2。(2)其他条件相同,浓度不同的实验有实验1、3、4、6、8和实验2、5。(3)要表明反应温度对反应速率有影响,应控制其他条件相同,仅温度不同,如实验6、7和实验8、9。(4)由表中数据可知,金属质量相等,即一定质量的金属与足量的稀硫酸反应放出的热量相同。
[答案] (1)固体反应物的表面积 表面积越大 1、2 (2)1、3、4、6、8和2、5 (3)反应温度 6、7和8、9 (4)稀硫酸过量,等量的金属完全反应,放出的热量相等
“三段式”突破反应速率与平衡的有关计算模型
mA(g)+nB(g)pC(g)+qD(g)
起始/ml a b 0 0
转化/ml mx nx px qx
平衡/ml a-mx b-nx px qx
1.v(A)=eq \f(mx,V·Δt),v(B)=eq \f(nx,V·Δt)
2.平衡转化率:α(A)=eq \f(mx,a)×100%
α(B)=eq \f(nx,b)×100%
3.气体体积分数(物质的量分数)
φ(A)=eq \f(a-mx,a+b+px+qx-mx-nx)×100%,
φ(D)=eq \f(qx,a+b+px+qx-mx-nx)×100%。
【典例2】 在一定温度下,发生反应:N2(g)+3H2(g)2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 ml和6.0 ml,10 min达到平衡,平衡时生成NH3的物质的量是2.4 ml。已知容器的容积为5.0 L,试求:
(1)达到平衡时,v(H2)=________________。
(2)H2的转化率是________。
(3)平衡时混合气体中N2的体积分数是________(保留一位小数)。
[解析] N2(g) + 3H2(g) 2NH3(g)
起始 3.0 ml 6.0 ml 0 ml
转化 1.2 ml 3.6 ml 2.4 ml
平衡 1.8 ml 2.4 ml 2.4 ml
(1)v(H2)=eq \f(3.6 ml,5.0 L×10 min)=0.072 ml/(L·min)
(2)H2的转化率=eq \f(3.6 ml,6.0 ml)×100%=60%。
(3)N2的体积分数=eq \f(1.8 ml,1.8+2.4+2.4ml)×100%≈27.3%。
[答案] (1)0.072 ml/(L·min) (2)60% (3)27.3%
3.在10 L密闭容器中,1 ml A和3 ml B在一定条件下反应:A(g)+xB(g)2C(g),2 min后反应达到平衡时,测得混合气体共3.4 ml,生成0.4 ml C,则下列计算结果正确的是( )
A.平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B.x等于3
C.A的转化率为20%
D.B的平均反应速率为0.4 ml·L-1·min-1
C [ A(g)+xB(g)2C(g)
起始物质的量/ml 1 3 0
转化物质的量/ml 0.2 0.2x 0.4
平衡物质的量/ml 0.8 3-0.2x 0.4
则0.8 ml+(3-0.2x) ml+0.4 ml=3.4 ml,解得x=4,B错;平衡时,物质的量之比为0.8∶(3-0.8)∶0.4=4∶11∶2,A错;A的转化率为eq \f(0.2 ml,1 ml)×100%=20%,C正确;v(B)=eq \f(0.8 ml,10 L)÷2 min=0.04 ml·L-1·min-1,D错。]
4.已知反应:2X(g)+Y(g)2Z(g),某研究小组将4 ml X和2 ml Y置于一恒容的密闭容器中,测定不同时段内X的转化率,得到的数据如表所示,下列说法正确的是( )
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5 min时,v正(X)=v逆(Z)
C.6 min时,容器中剩余1.4 ml Y
D.其他条件不变时,将X的物质的量改为10 ml,则可得4 ml Z
B [反应过程中气体的总质量和总体积均不变,则随着反应的进行,混合气体的密度始终不变,A项错误;转化率不变时反应达到平衡状态,则反应在5.5 min时,v正(X)=v逆(Z),B项正确;6 min时消耗X的物质的量为4 ml×70%=2.8 ml,根据化学方程式可知消耗Y的物质的量为1.4 ml,容器中剩余0.6 ml Y,C项错误;其他条件不变时,将X的物质的量改为10 ml,Y只有2 ml,若Y完全反应,则生成4 ml Z,又该反应是可逆反应,故不可能得到4 ml Z,D项错误。]
1.把下列四种X溶液分别加入四个盛有10 mL 2 ml·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10 ℃ 20 mL 3 ml·L-1的X溶液
B.20 ℃ 30 mL 2 ml·L-1的X溶液
C.20 ℃ 10 mL 4 ml·L-1的X溶液
D.10 ℃ 10 mL 2 ml·L-1的X溶液
B [计算出稀释后的四种溶液中X的物质的量,由于最后溶液的体积都为50 mL,则X的物质的量越大,X的浓度越大,而一般情况下,浓度越大、温度越高,反应速率越快。A溶液中X的物质的量为0.02 L×3 ml·L-1=0.06 ml;B溶液中X的物质的量为0.03 L×2 ml·L-1=0.06 ml;C溶液中X的物质的量为0.01 L×4 ml·L-1=0.04 ml;D溶液中X的物质的量为0.01 L×2 ml·L-1=0.02 ml。显然四种情况下,X的浓度:A=B>C>D,而温度:B=C>A=D,故B的反应速率最快。]
2.X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生反应:X(g)+2Y(g)2Z(g),达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.66%
D [假设X和Y起始物质的量均为1 ml,达平衡时消耗Y物质的量为n ml,则:
X(g) + 2Y(g)2Z(g)
起始量/ml: 1 1 0
变化量/ml: 0.5n n n
平衡量/ml: 1-0.5n 1-n n
平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则(1-0.5n+1-n)∶n=3∶2,解得n=eq \f(2,3),Y的转化率=eq \f(\f(2,3) ml,1 ml)×100%≈67%。]
3.等质量的碳酸钙与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生的气体体积(V)如图所示,根据图示分析实验条件,下列说法一定不正确的是( )
A.第4组实验的反应最慢
B.第1组实验中盐酸的浓度可能大于2.5 ml·L-1
C.第2组实验中盐酸的浓度可能等于2.5 ml·L-1
D.第3组实验的反应温度低于30 ℃
D [由题图可知,第4组实验的反应最慢,故A项正确;第1组实验的反应比第4组的快,第1、4组实验相比,温度相同,第1组固体反应物的表面积更大,故第1组实验中盐酸的浓度可能等于或大于2.5 ml·L-1,甚至可以小于2.5 ml·L-1,故B项正确;第2组实验的反应比第4组的快,第2、4组实验相比,温度相同,第2组固体反应物的表面积更大,故第2组实验中盐酸的浓度可能等于或大于2.5 ml·L-1,甚至可以小于2.5 ml·L-1,故C项正确;第3组实验的反应比第4组的快,第3、4组实验相比,浓度、固体反应物的表面积相同,温度越高,反应越快,则第3组实验的反应温度高于30 ℃,故D项错误。]
4.在容积可变的密闭容器中,2 ml N2和8 ml H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于( )
A.5% B.10% C.15% D.20%
C [达到平衡时,H2转化的物质的量为8 ml×25%=2 ml。在一定条件下,N2与H2发生反应:
N2(g)+3H2(g)2NH3(g)
起始物质的量/ml 2 8 0
转化物质的量/ml eq \f(2,3) 2 eq \f(4,3)
平衡物质的量/ml eq \f(4,3) 6 eq \f(4,3)
同温同压下,气体的体积比等于其物质的量之比,故平衡时氮气的体积分数为eq \f(\f(4,3) ml,\f(4,3) ml+6 ml+\f(4,3) ml)×100%≈15%。]
5.(素养题)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察_________________,定性比较得出结论;甲图中用0.05 ml·L-1 Fe2(SO4)3和0.1 ml·L-1 CuSO4的目的是________________________。
(2)定量分析:用图乙所示装置做对照实验,实验时均以3 min为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是______________________,所需仪器为________。
[解析] (1)如图甲可通过观察溶液中产生气泡的速率,定性比较得出结论。(2)用图乙所示装置做对照实验,实验时均以3 min为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数据是在同温同压下,反应3 min收集的气体体积。所需仪器为计时仪器,可以是秒表或计时器。
[答案] (1)溶液中产生气泡的速率 保证c(Fe3+)和c(Cu2+)相同 (2)在同温同压下,反应3 min收集的气体体积 秒表(或计时器)探 究 任 务
1.“变量控制法”调控反应速率。
2.反应速率、平衡的有关计算。
“变量控制法”调控反应速率
实验混合溶液
A
B
C
D
E
F
4 ml·L-1H2SO4/mL
30
V1
V2
V3
V4
V5
饱和CuSO4溶液/mL
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
10
0
实验
序号
金属质量/g
金属状态
c(H2SO4)
/(ml·L-1)
V(H2SO4)
/mL
溶液温度/℃
金属
消失
的时
间/s
反
应
前
反
应
后
1
0.10
丝
0.5
50
20
34
500
2
0.10
粉末
0.5
50
20
35
50
3
0.10
丝
0.7
50
20
36
250
4
0.10
丝
0.8
50
20
35
200
5
0.10
粉末
0.8
50
20
36
25
6
0.10
丝
1.0
50
20
35
125
7
0.10
丝
1.0
50
35
50
50
8
0.10
丝
1.1
50
20
34
100
9
0.10
丝
1.1
50
30
44
40
化学反应速率与平衡的有关计算
t/min
2
4.5
5
6
X转化率
30%
40%
70%
70%
组别
对应
曲线
c(HCl)/
(ml·L-1)
反应温度/℃
碳酸钙的状态
1
a
30
粉末状
2
b
30
粉末状
3
c
2.5
块状
4
d
2.5
30
块状
高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度第2课时导学案及答案: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度第2课时导学案及答案,共12页。学案主要包含了化学反应的限度,化学反应条件的控制等内容,欢迎下载使用。
高中化学第二节 化学反应的速率与限度第1课时导学案: 这是一份高中化学第二节 化学反应的速率与限度第1课时导学案,共14页。学案主要包含了化学反应速率,影响化学反应速率的因素等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 化学平衡学案: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡学案,共6页。