- 福建专用2021_2022学年高中化学第1章认识化学科学第3节第2课时气体摩尔体积学案鲁科版必修1 学案 6 次下载
- 福建专用2021_2022学年高中化学第1章认识化学科学第3节第3课时物质的量浓度课件鲁科版必修1 课件 3 次下载
- 福建专用2021_2022学年高中化学第1章认识化学科学第3节第4课时与物质的量相关概念的转化阿伏加德罗常数常见陷阱提升课时课件鲁科版必修1 课件 3 次下载
- 福建专用2021_2022学年高中化学第1章认识化学科学第3节第4课时与物质的量相关概念的转化阿伏加德罗常数常见陷阱提升课时学案鲁科版必修1 学案 5 次下载
- 福建专用2021_2022学年高中化学第1章认识化学科学阶段素养提升课课件鲁科版必修1 课件 2 次下载
鲁科版 (2019)必修 第一册第1章 认识化学科学第3节 化学中常用的物理量——物质的量第3课时学案
展开一、物质的量浓度
二、配制一定物质的量浓度的溶液
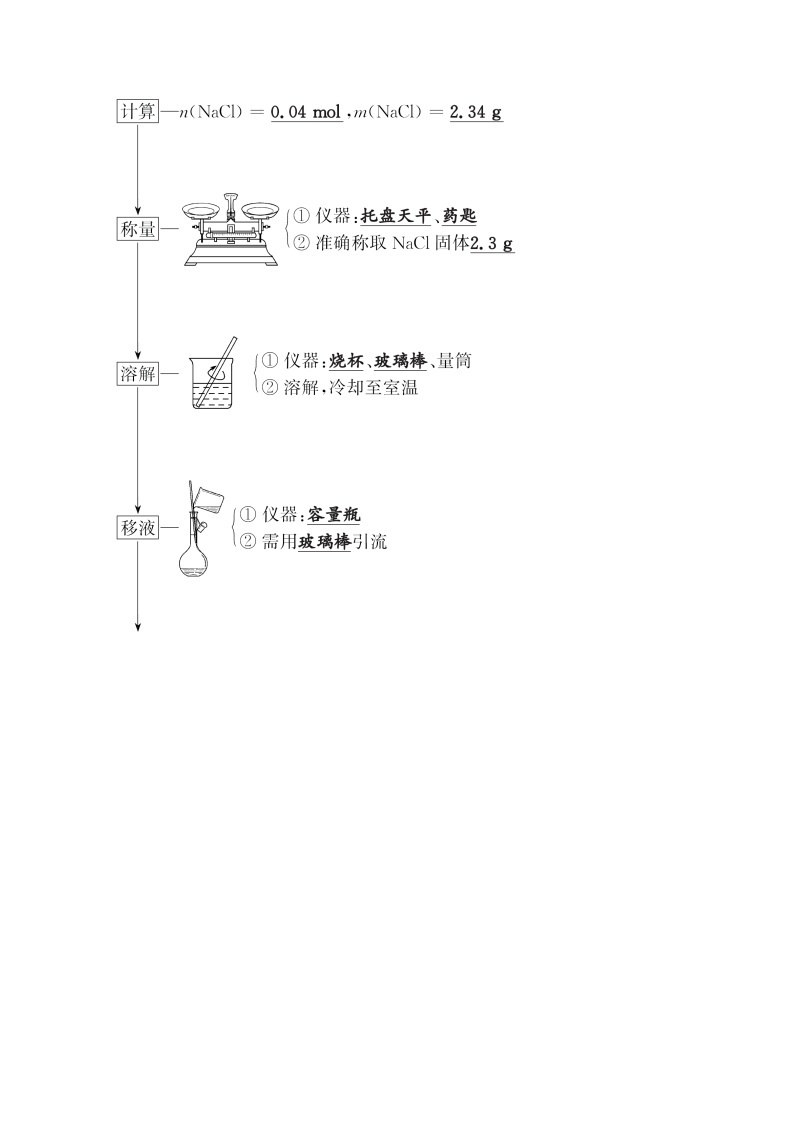
1.实验目的:配制100 mL 0.4 ml·L-1的NaCl溶液。
2.实验原理:cB= eq \f(nB,V) = eq \f(mB,MB·V) 。
3.实验仪器与步骤
(1)仪器:容量瓶
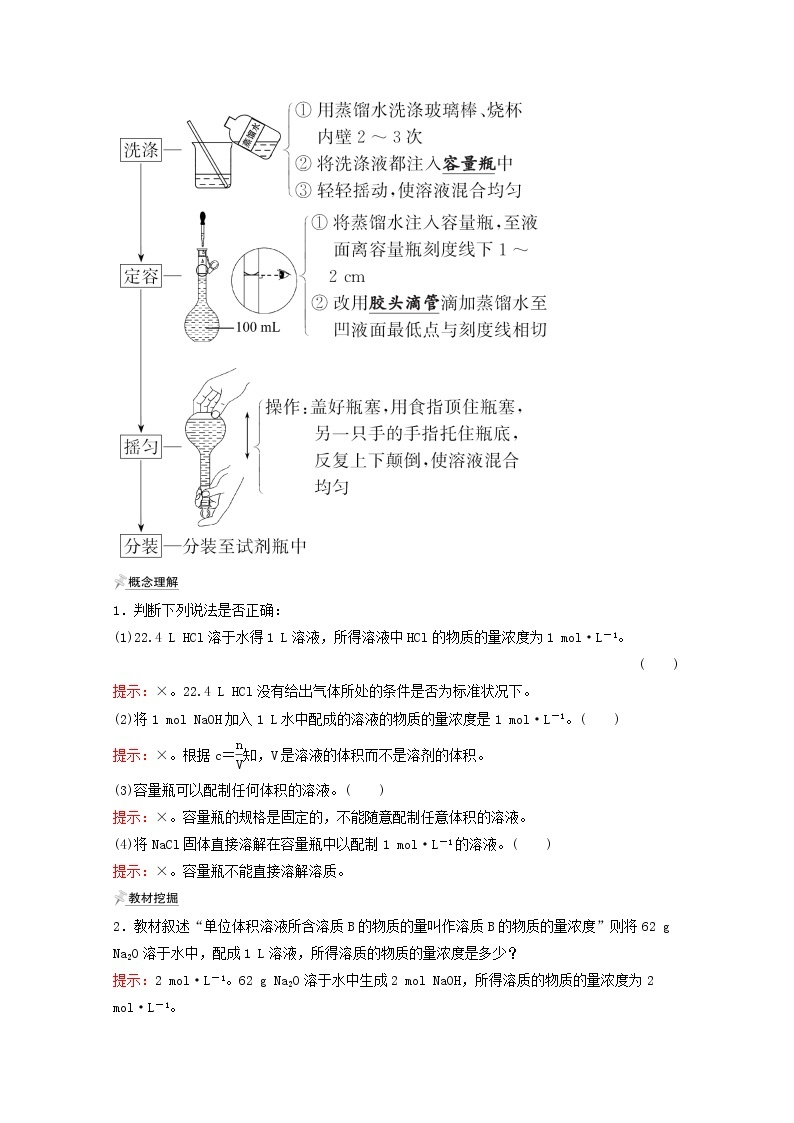
(2)步骤
1.判断下列说法是否正确:
(1)22.4 L HCl溶于水得1 L溶液,所得溶液中HCl的物质的量浓度为1 ml·L-1。
( )
提示:×。22.4 L HCl没有给出气体所处的条件是否为标准状况下。
(2)将1 ml NaOH加入1 L水中配成的溶液的物质的量浓度是1 ml·L-1。( )
提示:×。根据c= eq \f(n,V) 知,V是溶液的体积而不是溶剂的体积。
(3)容量瓶可以配制任何体积的溶液。( )
提示:×。容量瓶的规格是固定的,不能随意配制任意体积的溶液。
(4)将NaCl固体直接溶解在容量瓶中以配制1 ml·L-1的溶液。( )
提示:×。容量瓶不能直接溶解溶质。
2.教材叙述“单位体积溶液所含溶质B的物质的量叫作溶质B的物质的量浓度”则将62 g Na2O溶于水中,配成1 L溶液,所得溶质的物质的量浓度是多少?
提示:2 ml·L-1。62 g Na2O溶于水中生成2 ml NaOH,所得溶质的物质的量浓度为2 ml·L-1。
3.要配制1 L 0.1 ml·L-1 CuSO4溶液,需要CuSO4粉末或CuSO4·5H2O的质量一样吗?
提示:不一样。1 L 0.1 ml·L-1 CuSO4溶液,溶质CuSO4的物质的量n=1 L×0.1 ml·L-1=0.1 ml,则需要CuSO4粉末质量:0.1 ml×160 g·ml-1=16 g,CuSO4·5H2O的质量:0.1 ml×250 g·ml-1=25 g。
有关物质的量浓度的计算
表示溶液组成的方法有两种:①溶质的质量分数;②物质的量浓度。图示为实验室浓硫酸的试剂瓶上的标签。
物质的量浓度的含义
(1)98 g H2SO4溶于1 L水中配成溶液,就能得到1 ml·L-1的H2SO4溶液吗?为什么?
提示:不能。单位体积溶液强调的是溶液的体积,不是溶剂的体积。将98 g H2SO4(即1 ml)溶于1 L水后,得到的溶液体积不再为1 L,故H2SO4的物质的量浓度不是1 ml·L-1。
(2)在1 ml·L-1H2SO4溶液中H+和SO eq \\al(\s\up1(2-),\s\d1(4)) 的浓度各是多少?
提示:设溶液的体积为1 L,H2SO4的物质的量为1 ml·L-1×1 L=1 ml,含有的H+的物质的量为2 ml,SO eq \\al(\s\up1(2-),\s\d1(4)) 的物质的量为1ml,故H+的浓度为2 ml÷1 L=2 ml·L-1;SO eq \\al(\s\up1(2-),\s\d1(4)) 的浓度为1 ml÷1 L=1 ml·L-1。
(3)从1 L的1 ml·L-1稀硫酸中取出100 mL,则取出溶液中H+的物质的量浓度是多少?
提示:由于溶液的均一性,使得溶液内部浓度处处相等,因此取出的100 mL溶液中,H+的物质的量浓度仍为2 ml·L-1。
物质的量浓度的相关计算
(1)计算密度为1.84 g·cm-3、质量分数为98%的浓硫酸的物质的量浓度。试归纳溶质的质量分数和物质的量浓度的关系式。
提示:1 L这种的浓硫酸中所含硫酸溶质的质量:
1 000 cm3×1.84 g·cm-3×98%=18.4×98 g。
物质的量: eq \f(18.4×98 g,98 g·ml-1) =18.4 ml。
该浓硫酸的物质的量浓度为 eq \f(18.4 ml,1 L) =18.4 ml·L-1。
质量分数和物质的量浓度的关系式为c= eq \f(1 000ρw,M) (ρ单位:g·cm-3)。
(2)将1 L 1 ml·L-1的H2SO4溶液稀释至2 L,此时H2SO4溶液的物质的量浓度是多少?
提示: eq \f(1 L×1 ml·L-1,2 L) =0.5 ml·L-1。
(3)将1 L 1 ml·L-1的H2SO4溶液和3 L 0.5 ml·L-1的H2SO4溶液混合,加水至5L,此时硫酸溶液的浓度是多少?
提示: eq \f(1 L×1 ml·L-1+3 L×0.5 ml·L-1,5 L) =0.5 ml·L-1。
1.根据定义式计算:
2.溶液稀释和混合的计算:
(1)溶液稀释的有关计算:稀释前后溶质的物质的量和质量都保持不变。
c(浓)·V(浓)=c(稀)·V(稀),
m(浓)·w(浓)=m(稀)·w(稀)。
(2)溶液混合的计算:混合前后溶质的物质的量或质量不变。
c1·V1+c2·V2=c(混)·V(混),
m1·w1+m2·w2=m(混)·w(混)。
【易错提醒】无特别指明时,V(混)≠V1+V2;V(混)= eq \f(m(混),ρ(混)) ,但溶液的质量守恒:m(混)=m1+m2。
【思考讨论】
(1)10.6 g Na2CO3溶于水配成1 L溶液,其物质的量浓度是多少?
提示:n= eq \f(10.6 g,106 g·ml-1) =0.1 ml,c= eq \f(n,V) = eq \f(0.1 ml,1 L) =0.1 ml·L-1。
(2)将3 ml·L-1的NaCl溶液稀释到原来的3倍,稀释后的溶液的浓度是多少?
提示:1 ml·L-1。稀释过程溶质的物质的量不变,溶液体积扩大3倍,浓度变为原来的三分之一。
(3)(情境思考)5%的葡萄糖(分子式为C6H12O6)溶液(密度近似认为1 g·mL-1)在医院中常用来输液。
请你计算5%的葡萄糖溶液的物质的量浓度是多少?
提示:假设体积为1 L的5%的葡萄糖溶液,则质量为1 000 g,含有溶质(葡萄糖)为50 g,葡萄糖的物质的量约为0.278 ml,所以5%的葡萄糖溶液的物质的量浓度是0.278 ml·L-1。
【典例】(2021·邳州高一检测)下列说法正确的是( )。
A.将1.17 g氯化钠溶于水,配制成50 mL溶液,得到溶液的浓度为0.4 ml·L-1
B.将1.12 L氯化氢气体溶于水,配制成200 mL的盐酸,得到溶液的浓度为0.25 ml·L-1
C.20 mL的H2SO4溶液中,溶有19.6 g H2SO4,此溶液的浓度为1 ml·L-1
D.将40 g氢氧化钠溶于2 L水中,得到溶液的浓度为0.5 ml·L-1
【解题指南】解答本题时应注意以下几点:
(1)注意计算物质的量浓度时用的是溶液的体积;
(2)进行相关的计算时注意单位的换算;
(3)注意气体所处的条件是否为标准状况。
【解析】选A。1.17 g氯化钠的物质的量为 eq \f(1.17 g,58.5 g·ml-1) =0.02 ml,根据c= eq \f(n,V) 易知,配制成50 mL 溶液后得到溶液的浓度为 eq \f(0.02 ml,0.05 L) =0.4 ml·L-1,A项正确;没指明温度和压强,无法计算1.12 L氯化氢的物质的量,B项错误;H2SO4的物质的量为 eq \f(19.6 g,98 g·ml-1) =0.2 ml,则此溶液的浓度为 eq \f(0.2 ml,0.02 L) =10 ml·L-1,C项错误;根据c= eq \f(n,V) 计算物质的量浓度时,V是指溶液的体积,将40 g氢氧化钠溶于2 L水中,不知溶液的体积,无法计算溶液的浓度,D项错误。
(1)将A选项中的溶液取出10 mL,加水稀释至100 mL,则所得溶液的物质的量浓度是多少?
提示:0.04 ml·L-1。10 mL溶液加水稀释至100 mL,即稀释了10倍,因此浓度变为原来的 eq \f(1,10) 。
(2)D选项中的溶液要计算其物质的量浓度,需要得知什么物理量?
提示:溶液的密度。知道溶液密度可以根据溶液的质量计算得到溶液的体积,从而可以得到溶质的物质的量浓度。
【备选例题】
(2021·威海高一检测)(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为________ ml·L-1。
(2)若从中取出50 mL,其物质的量浓度为________ ml·L-1;溶质的质量为__________g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为__________ml·L-1,SO eq \\al(\s\up1(2-),\s\d1(4)) 的物质的量浓度为____________ ml·L-1。
【解题指南】解答本题需注意以下两点:
(1)熟记并灵活运用相关计算公式;
(2)注意同一溶液中的离子间浓度的关系。
【解析】(1)n(Na2SO4)= eq \f(14.2 g,142 g·ml-1) =0.1 ml,c(Na2SO4)= eq \f(0.1 ml,0.5 L) =0.2 ml·L-1。
(2)从中取出50 mL溶液,浓度仍为0.2 ml·L-1,溶质的质量为m=n·M=c·V·M=0.2 ml·L-1×0.05 L×142 g·ml-1=1.42 g。
(3)50 mL溶液用水稀释到100 mL,据c(浓)·V(浓)=c(稀)·V(稀),Na2SO4的浓度变为原来的 eq \f(1,2) ,即0.1 ml·L-1,故Na+浓度为0.2 ml·L-1,SO eq \\al(\s\up1(2-),\s\d1(4)) 浓度为0.1 ml·L-1。
答案:(1)0.2 (2)0.2 1.42 (3)0.2 0.1
1.(2021·厦门高一检测)关于0.1 ml·L-1 H2SO4溶液的叙述错误的是( )
A.1 L该溶液中含有H2SO4的质量为9.8 g
B.0.5 L该溶液中氢离子的物质的量浓度为0.2 ml·L-1
C.从1 L该溶液中取出100 mL,则取出溶液中H2SO4的物质的量浓度为0.01 ml·L-1
D.取该溶液10 mL,加水稀释至100 mL后H2SO4的物质的量浓度为0.01 ml·L-1
【解析】选C。1 L 0.1 ml·L-1的H2SO4溶液中含溶质的质量m=n·M=V·c·M=1 L×0.1 ml·L-1×98 g·ml-1=9.8 g,A正确;0.1 ml·L-1 H2SO4溶液中H+浓度为0.2 ml·L-1,B正确;溶液是均一、稳定的混合物,故取出的100 mL溶液的浓度仍然是0.1 ml·L-1,C错误;10 mL溶液加水稀释至100 mL,体积增大10倍,浓度变为原来的 eq \f(1,10) ,即0.01 ml·L-1,D正确。
2.(2021·潍坊高一检测)将a mL 5 ml·L-1的Mg(NO3)2溶液稀释至b mL,稀释后溶液中NO eq \\al(\s\up1(-),\s\d1(3)) 的物质的量浓度为( )
A. eq \f(5a,b) ml·L-1 B. eq \f(10a,b) ml·L-1
C. eq \f(b,5a) ml·L-1 D. eq \f(a,b) ml·L-1
【解析】选B。根据稀释时NO eq \\al(\s\up1(-),\s\d1(3)) 的物质的量守恒可知:
5 ml·L-1×a mL×10-3L·mL-1×2=b mL×10-3L·mL-1×c(NO eq \\al(\s\up1(-),\s\d1(3)) ),则c(NO eq \\al(\s\up1(-),\s\d1(3)) )= eq \f(10a,b) ml·L-1。
【拔高题组】
1.(2021·马鞍山高一检测)向1 000 g蒸馏水中通入标准状况下的HCl气体a L,得到盐酸的密度为b g·cm-3,则该盐酸的物质的量浓度为( )
A. eq \f(a,22.4) ml·L-1
B. eq \f(ab,22 400) ml·L-1
C. eq \f(ab,22 400+36.5a) ml·L-1
D. eq \f(1 000ab,22 400+36.5a) ml·L-1
【解析】选D。题中溶质的物质的量n(HCl)= eq \f(a L,22.4 L·ml-1) = eq \f(a,22.4) ml,溶液的体积V= eq \f(\f(a,22.4)ml×36.5 g·ml-1+1 000 g,1 000×b g·L-1) = eq \f(\f(a,22.4)×36.5+1 000,1 000b) L,则c(HCl)= eq \f(n(HCl),V) = eq \f(1 000ab,22 400+36.5a) ml·L-1。
2.(2021·南昌高一检测)若30 g密度为d g·cm-3的AlCl3溶液中含有0.9 g Al3+,则Cl-的物质的量浓度为( )
A. eq \f(10,3) d ml·L-1B. eq \f(10,9) d ml·L-1
C. eq \f(10,6) d ml·L-1 D. eq \f(10,3d) ml·L-1
【解析】选A。0.9 g Al3+的物质的量是n(Al3+)= eq \f(0.9 g,27 g·ml-1) = eq \f(1,30) ml,则n(Cl-)=3n(Al3+)= eq \f(1,10) ml,溶液的体积是V= eq \f(m,ρ) = eq \f(30 g,d g·cm-3) = eq \f(30,d) ×10-3L,所以c(Cl-)= eq \f(n,V) = eq \f(\f(1,10)ml,\f(30,d)×10-3 L) = eq \f(10d,3) ml·L-1。
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
(1)计算该注射液中葡萄糖的质量分数;
(2)计算该注射液中葡萄糖的物质的量浓度;(保留两位小数)
(3)检测人的血液中葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mml·L-1”和“mg·dL-1”(1 L=10 dL)。以“mml·L-1”表示时,人的血糖正常值在3.61~6.11 mml·L-1之间。如果以“mg·dL-1”表示,血糖正常值范围是多少?
【解析】
(1)由标签所提供的信息可知该注射液中葡萄糖的质量分数为5%;
(2)溶质的质量为25 g,n= eq \f(25 g,180 g·ml-1) ≈0.139 ml,
则c= eq \f(0.139 ml,0.5 L) ≈0.28 ml·L-1;
(3)以“mml·L-1”表示时人的血糖正常值在3.61~6.11 mml·L-1之间,则以“mg·dL-1”表示的血糖正常值范围为 eq \f(3.61×180,10) ~ eq \f(6.11×180,10) mg·dL-1,即为64.98~109.98 mg·dL-1。
答案:(1)5% (2)0.28 ml·L-1
(3)64.98~109.98 mg·dL-1
配制一定物质的量浓度的溶液及误差分析
如图为实验室用固体配制一定物质的量浓度溶液的操作过程:
探究实验过程产生的误差
(1)在图示操作中,向容量瓶中转移溶液时玻璃棒的作用是什么?玻璃棒的下端为什么应靠在容量瓶刻度线以下的内壁上?
提示:向容量瓶中转移溶液时玻璃棒的作用是引流,以防止溶液外洒而造成损失。如果玻璃棒下端靠在容量瓶刻度线以上的内壁上,刻度线以上的内壁上附着的液体不能及时流下,定容后造成溶液体积偏大,所以玻璃棒的下端应靠在容量瓶刻度线以下的内壁上。
(2)定容后,颠倒摇匀,为什么液面会低于刻度线?能否再加水?
提示:容量瓶属于容纳式玻璃仪器。颠倒摇匀后液面低,是因为极少量溶液在润湿磨口处损耗了。刻度是以容纳量为依据,所以不能再加水至刻度线,否则,溶液浓度偏低。
(3)定容加蒸馏水时不慎超过了刻度线或向容量瓶转移溶液时不慎有液滴滴在容量瓶外,应如何处理?
提示:无法进行弥补处理,应重新配制。
(4)配制一定物质的量浓度的NaOH溶液时,称量NaOH固体时间过长,对配制结果有影响吗?
提示:称量时间过长,会使NaOH变质而使配制溶液的浓度偏低。
误差的分析方法
根据cB= eq \f(nB,V) = eq \f(mB,MBV) 可知,配制100 mL 1.00 ml·L-1 氯化钠溶液常出现的误差
【特别提醒】
在配制一定物质的量浓度溶液的过程中往往因一些操作不慎而引起误差,在分析误差时,一般依据实验原理,对实验结果的数学表达式进行分析(属于公式法),又cB=nB/V可分析实验误差。
【思考讨论】
(1)用量筒量取5.8 mL浓硫酸倒入100 mL容量瓶,然后加水定容,配制一定浓度的硫酸溶液,这样操作可以吗?
提示:不可以。不能直接在容量瓶中稀释浓溶液,应在烧杯中进行,且应先在烧杯中加入一定量水,再缓慢倒入浓硫酸。
(2)假如配制一定浓度的氢氧化钠溶液,应怎样称量氢氧化钠固体?氢氧化钠在烧杯中刚好溶解,即把溶液转移到容量瓶,这样可以吗?若不可以,这样所配溶液的浓度如何变化?
提示:氢氧化钠在空气中易吸水,且具有较强的腐蚀性,因此称量时应放在小烧杯中称量;不可以;溶液未冷却,液体膨胀,故向容量瓶中所加的水偏少,这样所配溶液浓度偏高。
(3)配制溶液过程中,为什么要将玻璃棒和烧杯的洗涤液转移到容量瓶中?若不洗涤或洗涤液不转移到容量瓶中,会产生怎样影响?
提示:保证溶质完全转移到容量瓶中。所配溶液浓度偏低。
(4)(情境应用)如图是配制一定物质的量浓度溶液的示意图,配制溶液过程中,溶液转移至容量瓶前为什么要恢复至室温?哪些物质溶解时会使溶液温度发生较大变化?
提示:容量瓶上标有的容积是指室温下的容积,溶液温度过高,液体体积偏大,冷却后液体体积变小,所配溶液浓度偏大;反之溶液温度过低,所配溶液浓度偏小。NaOH固体溶解、浓H2SO4稀释会使溶液温度上升,铵盐溶解会使溶液温度下降。
【典例】(2021·清远高一检测)下列配制的溶液浓度偏高的是( )
A.配制盐酸用量筒量取盐酸时俯视刻度线
B.配制盐酸定容时,仰视容量瓶刻度线
C.配制烧碱溶液时,没有洗涤溶解烧碱的烧杯和玻璃棒
D.配制烧碱溶液时,烧碱溶解后未经冷却即注入容量瓶至刻度线
【思维建模】配制一定物质的量浓度溶液的误差分析思路如下:
【解析】选D。A项,俯视刻度线,将会使量得的盐酸体积小于计算值,导致浓度偏低;B项,定容时仰视容量瓶刻度线,导致加水量增多,溶液浓度偏低;C项,未洗涤烧杯、玻璃棒,导致溶质减少,溶液浓度偏低;D项,溶液在容量瓶中冷却后液面低于刻度线,溶液体积减小,溶液浓度偏高。
【备选例题】
实验室欲配制500 mL 0.5 ml·L-1的NaOH溶液,请按要求完成下列填空:
(1)完成本实验时,下列仪器中一定不需要的是________________(填字母,下同)。
(2)通过计算可知,需NaOH固体的质量为________g。
(3)配制过程一般可分为以下几个步骤:①称量
②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容
⑧振荡,正确的操作顺序为________(填序号)。
小明认为还缺少一个步骤,此步骤的名称是________________。
(4)实验结束后,发现所配溶液浓度偏大,可能的原因是________(填代号)。
A.所用NaOH已潮解
B.定容时俯视观察液面
C.未洗涤烧杯
D.称量时砝码与NaOH的位置颠倒
【解析】(1)该实验一定不需要分液漏斗。(2)需NaOH固体的质量m(NaOH)=0.5 L×0.5 ml·L-1×40 g·ml-1=10.0 g。(3)氢氧化钠溶于水放热,需要冷却后才能转移至容量瓶中。(4)若所用NaOH已潮解,则固体中NaOH的质量偏低,溶液浓度偏小,A项错误;若定容时俯视观察液面,定容时溶液体积偏小,所配溶液浓度偏大,B项正确;未洗涤烧杯会使部分溶质损失,造成所配溶液浓度偏小,C项错误;因为该实验中称量氢氧化钠的质量时用不到游码,所以称量时砝码与NaOH的位置颠倒,对实验结果无影响,D项错误。
答案:(1)D (2)10.0 (3)②①③⑤⑥⑧⑦④ 冷却 (4)B
(2021·绍兴高一检测)利用浓硫酸配制一定体积的0.10 ml·L-1稀硫酸,涉及的相关操作正确的是( )
【解析】选A。量取浓硫酸应选用量筒,倾倒液体沿着量筒壁,操作正确,故A正确;稀释浓硫酸正确操作:将浓硫酸沿着烧杯壁缓缓注入水中,同时用玻璃棒不断搅拌,故B错误;移液操作应用玻璃棒引流,故C错误;定容时,胶头滴管应垂直容量瓶上方,不能深入容量瓶内,故D错误。
【拔高题组】
1.(2021·海口高一检测)为了配制100 mL 1 ml·L-1的NaOH溶液,其中有下列几个操作:
①NaOH固体放在纸片上称量;
②选刚用蒸馏水洗净的100 mL容量瓶进行配制;
③NaOH在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中;
④用蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液也转入容量瓶中;
⑤使蒸馏水沿玻璃棒注入容量瓶,直到溶液的凹液面恰好与刻度线相切。
其中操作错误的是( )
A.①②③ B.③④⑤C.②③⑤ D.①③⑤
【解析】选D。①NaOH固体不能放在纸片上称量,可放在小烧杯中称量;③溶解后应冷却至室温后再把溶液转移到容量瓶中;⑤最后定容时应改用胶头滴管向容量瓶中滴加蒸馏水。
2.(2021·安庆高一检测)下列有关实验操作或结论的描述正确的是( )
A.称量硫酸铜粉末16.0 g,溶解于100 mL蒸馏水中配成100 mL 1 ml·L-1的CuSO4溶液
B.配制一定物质的量浓度的NaOH溶液时,若所用NaOH已经潮解,则造成所配溶液浓度偏高
C.配制溶液时,摇匀后发现溶液液面低于刻度线,加水使液面达到刻度线
D.用蒸馏水洗涤后的容量瓶,可直接用于溶液的配制
【解析】选D。配制溶液时,溶液的体积不等于溶剂的体积,A项错误;所用NaOH已经潮解,造成所取用的溶质偏少,所配溶液的浓度偏低,B项错误;摇匀后再加水,导致溶液浓度降低,C项错误;使用蒸馏水洗涤后的容量瓶不影响溶液的浓度,D项正确。
1.(水平1)用物质的量浓度来表示溶液的组成对生产和科学研究都有重要的意义。下表是某人体检表上的部分信息,其中是用物质的量浓度来表示的是( )
A.谷丙转氨酶 B.球蛋白
C.乳酸脱氢酶 D.葡萄糖
【解析】选D。看清物理量的单位即可,物质的量浓度的单位通常为ml·L-1,此处为mml·L-1。
2.(水平1)从1 L 1 ml·L-1的KOH溶液中取出100 mL,下面关于这100 mL溶液的叙述错误的是( )
A.物质的量浓度为0.1 ml·L-1
B.密度与原溶液相同
C.含有KOH的物质的量为0.1 ml
D.溶质的质量分数与原溶液相同
【解析】选A。溶液具有均一性,从1 L 1 ml·L-1的KOH溶液中取出100 mL,物质的量浓度、溶质质量分数及密度均不变。取出的100 mL溶液中含有KOH的物质的量为1 ml·L-1×0.1 L=0.1 ml。
3.(水平1)配制一定物质的量浓度的Na2CO3溶液的操作过程示意图如图所示,下列说法中错误的是( )
A.“操作1”需将溶解的Na2CO3溶液及烧杯洗涤液全部转移到容量瓶中
B.“操作2”中玻璃棒起引流作用
C.“操作4”定容时俯视刻度线会造成所配溶液浓度偏低
D.所配制的Na2CO3溶液中c(Na+)为2.0 ml·L-1
【解析】选C。溶解得到的溶液及洗涤烧杯2~3次的洗涤液均需转移到容量瓶中,A说法正确;向容量瓶中转移溶液时,用玻璃棒引流,B说法正确;定容时若俯视刻度线,水的量不足,溶液体积减小,造成所配溶液浓度偏大,C说法错误;碳酸钠的质量为10.6 g,物质的量为0.1 ml,容量瓶规格为100 mL,Na2CO3溶液的物质的量浓度为1 ml·L-1,c(Na+)=2c(Na2CO3)=2 ml·L-1,D说法正确。
【补偿训练】
用氢氧化钠固体配制1.0 ml·L-1的溶液220 mL,下列说法正确的是( )
A.需先称取氢氧化钠固体8.8 g
B.氢氧化钠在烧杯中溶解后,要立即转移至容量瓶
C.溶液转移到容量瓶后,烧杯及玻璃棒用蒸馏水洗涤2~3次,并将洗涤液转移至容量瓶
D.定容后将溶液振荡摇匀,静置时发现液面低于刻度线,于是又加水至刻度线
【解析】选C。根据“大而近”的原则,应选用250 mL容量瓶进行配制,需要称取10.0 g氢氧化钠固体;氢氧化钠溶解时放热,要冷却后再转移至容量瓶。
4.(水平1)配制500 mL 0.1 ml·L-1的NaCl溶液,下列说法或操作正确的是( )
A.准确称量2.9 g NaCl固体溶于500 mL蒸馏水中
B.用托盘天平准确称量干燥的NaCl固体2.925 g
C.在500 mL容量瓶中溶解氯化钠固体,然后加蒸馏水至刻度线
D.准确称量2.9 g混有KCl的NaCl固体,其他操作均正确,配好后的溶液中c(Cl-)偏低
【解析】选D。用500 mL蒸馏水配制NaCl溶液得到的溶液的体积不是500 mL,A错误;托盘天平的精确度是0.1 g,则用托盘天平不能准确称量干燥的NaCl固体2.925 g,B错误;溶解NaCl固体应该在烧杯中进行,不能使用容量瓶溶解,C错误;由于M(KCl)>M(NaCl),所以准确称量2.9 g混有KCl的NaCl固体,其他操作均正确,Cl-的物质的量偏少,由于溶液的体积不变,则配好后的溶液中c(Cl-)偏低,D正确。
5.(水平2)(2021·苏州高一检测)配制一定体积、一定物质的量浓度的溶液时,下列情况可能使溶液浓度偏低的是( )
A.容量瓶原有少量蒸馏水
B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C.定容时观察液面俯视
D.定容加水时,有少量水滴到容量瓶外
【解析】选B。容量瓶中原有少量蒸馏水对溶质的物质的量和溶液的体积都无影响,所以对配制溶液的物质的量浓度无影响,故A错误;没有洗涤烧杯会导致溶质的物质的量偏小,导致配制溶液的物质的量浓度偏小,故B正确;定容时俯视液面导致溶液的体积偏小,所配制溶液的物质的量浓度偏大,故C错误;滴管加水时,有少量水滴到容量瓶外,对溶质的物质的量和溶液的体积无影响,所以对配制溶液的物质的量浓度无影响,故D错误。
6.(水平2)图示为实验室某试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该NaOH溶液的物质的量浓度为______ml·L-1。
(2)现在要配制该浓度的NaOH溶液100 mL,需称量________g氢氧化钠固体。溶液配制所需的基本步骤如图:
(3)将上述实验步骤A到F按实验过程先后次序排列(不重复)________________。
(4)上述实验步骤A、B、E、F都用到的仪器名称为________________。
(5)下列操作对NaOH溶液的物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①摇匀后发现液面低于刻度线再加水________;
②容量瓶中原有少量蒸馏水________;
③定容时俯视刻度线________。
【解析】(1)该NaOH溶液的物质的量浓度为c(NaOH)= eq \f(1 000 cm3·L-1ρw(NaOH),M(NaOH)) =
eq \f(1 000 cm3·L-1×1.2 g·cm-3×20%,40 g·ml-1) =6 ml·L-1。(2)现在要配制该浓度的NaOH溶液100 mL,需称量6 ml·L-1×0.1 L×40 g·ml-1=24.0 g氢氧化钠固体。(3)配制溶液时,首先溶解溶质,再转移、洗涤溶液,之后是定容,摇匀,所以上述实验步骤的先后次序为CFDBAE。(4)上述实验步骤A、B、E、F都用到的仪器名称为100 mL容量瓶。(5)①溶液被稀释,浓度偏低;②对浓度无影响;③溶液体积变小,浓度偏高。
答案:(1)6 (2)24.0 (3)CFDBAE (4)100 mL容量瓶 (5)①偏低 ②无影响 ③偏高实验操作
n
V
c
①称量时物砝放反
偏小
不变
偏小
②砝码生锈(没有脱落)
偏大
不变
偏大
③少量氯化钠沾在滤纸上
偏小
不变
偏小
④有少量液体溅出
偏小
不变
偏小
⑤容量瓶内有少量水
不变
不变
不变
⑥未洗涤或洗涤液未注入容量瓶
偏小
不变
偏小
⑦定容时仰视刻度线
不变
偏大
偏小
⑧超过刻度线,吸出一部分水
偏小
不变
偏小
⑨摇匀后液面下降,补充水
不变
偏大
偏小
鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量导学案: 这是一份鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量导学案,共13页。学案主要包含了物质的量浓度,配制一定物质的量浓度的溶液等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量第3课时学案: 这是一份高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量第3课时学案,共17页。
高中化学鲁科版必修1第1章 认识化学科学第3节 化学中常用的物理量-物质的量第3课时学案: 这是一份高中化学鲁科版必修1第1章 认识化学科学第3节 化学中常用的物理量-物质的量第3课时学案,共17页。学案主要包含了物质的量浓度,配制一定物质的量浓度的溶液等内容,欢迎下载使用。