




高中苏教版第三单元 盐类的水解复习ppt课件
展开高考中的必考题,以水溶液中的电离平衡、水解平衡以及酸碱中和滴定的相关知识为载体,能力层面上通过对图像的观察及题给信息,考查运用分析、综合的方法解决问题的能力。 常涉及溶液酸碱性、酸碱中和以及电解质溶液(一种溶质或多种溶质)的平衡(电离平衡、水解平衡、沉淀溶解平衡)移动;电解质溶液的“三个守恒式”(电荷守恒、物料守恒和质子守恒);离子浓度的大小比较。
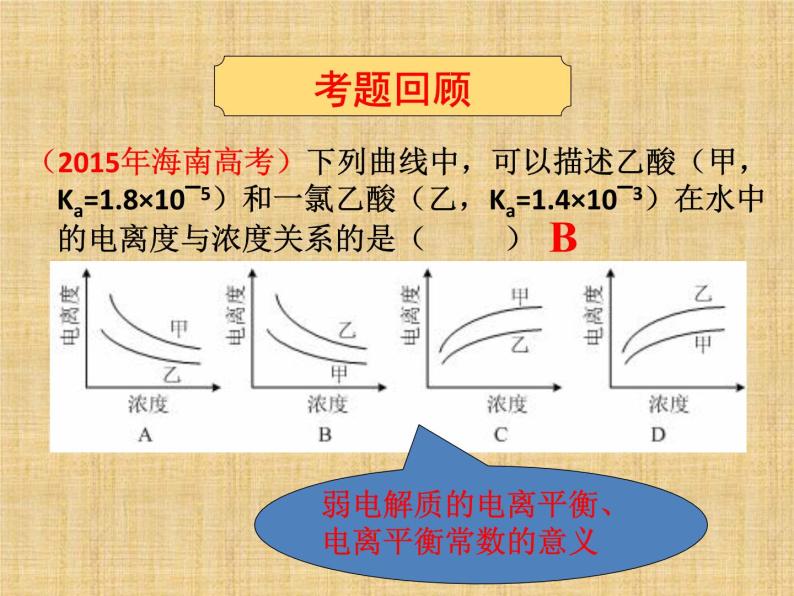
(2015年海南高考)下列曲线中,可以描述乙酸(甲,Ka=1.8×10‾5)和一氯乙酸(乙,Ka=1.4×10‾3)在水中的电离度与浓度关系的是( )
弱电解质的电离平衡、电离平衡常数的意义
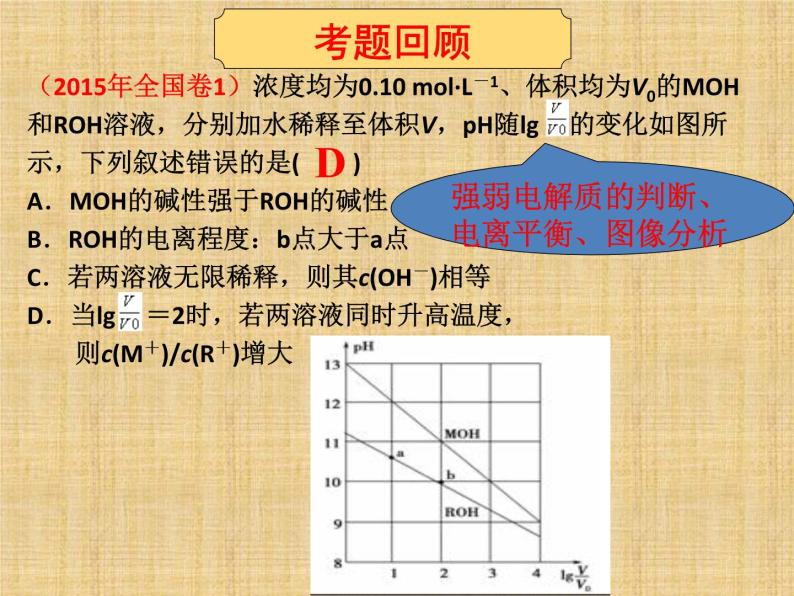
(2015年全国卷1)浓度均为0.10 ml·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg 的变化如图所示,下列叙述错误的是( )A.MOH的碱性强于ROH的碱性B.ROH的电离程度:b点大于a点C.若两溶液无限稀释,则其c(OH-)相等D.当lg =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大
强弱电解质的判断、电离平衡、图像分析
已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 ml·L-1 CH3COOH溶液中逐滴加入0.1 ml·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是( )
Kw、Ka、酸碱中和、 盐类水解、溶液稀释、 离子浓度大小比较、 图像分析
1、运用好两个守恒关系
电荷守恒关系和物料守恒关系,决定了溶液中离子间等式关系成立的基础。
2、一种电解质溶液中离子浓度大小的比较
(1)强酸弱碱盐溶液:主抓弱碱离子水解平衡; (2)强碱弱酸盐溶液:主抓弱酸根离子水解平衡; (3)弱酸溶液:主抓弱酸的电离平衡; (4)弱碱溶液:主抓弱碱的电离平衡; (5)强碱弱酸溶液的酸式盐溶液:主抓酸式酸根离子的电离和水解两种平衡。
3、两种电解质溶液混合后离子浓度大小的比较:
强酸与弱碱混合(或强碱与弱酸混合): (1)恰好反应时,主抓两溶液混合生成强酸弱碱盐的 水解情况; (2)当弱碱(或弱酸)剩余时,溶液的酸碱性由强酸 弱碱盐(或强碱弱酸盐)水解和弱碱(或弱酸) 的电离相对大小决定。
常温下,用0.10 ml·L-1 NaOH溶液滴定20.00 mL 0.10 ml·L-1 CH3COOH溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是( ) A.点①所示溶液中: c(CH3COO-)+c(OH—)= c(CH3COOH) +c(H+) B.点②所示溶液中:c(Na+)= c(CH3COO-)+ c(CH3COOH) C.点③所示溶液中:c(Na+)>c(OH—)> c(CH3COO-) >c(H+) D.滴定过程可能出现 c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH—)
电解质溶液中微粒浓度大小比较的类型 ——酸碱中和型
方法:巧抓“四点”,突破微粒浓度关系
(1)抓反应“一半”点,判断是什么溶质的等量混合
(3)抓“恰好”反应点,生成什么物质,溶液呈什么性, 是什么因 素造成
(2)抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足
(4)抓反应“过量”点,溶质是什么,判断谁多,谁少,还是等量
2、比较下列几种溶液混合后各离子浓度的大小(1)CH3COOH和NaOH等浓度等体积混合;(2) NaOH和CH3COOH等浓度按1:2体积比混合后PH<7;(3)PH=2的CH3COOH与PH=12的NaOH等体积混合。
1、25℃时相同物质的量浓度的下列溶液中:(1)NH4Cl (2)CH3COONH4 (3)NH4HSO4 (4)(NH4)2SO4 (5)(NH4)2Fe(SO4)2其中 c(NH4+)由大到小的顺序为:
(2014.海南高考)室温下,用0.100ml·L-1 NaOH溶液分别滴定·L-1 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )A、Ⅱ 表示的是滴定醋酸的曲线 B、PH=7时,滴定醋酸消耗V(NaOH)小于20mLC、V(NaOH) =20mL时,两份溶液中C(Cl—)== C(CH3COO—)D、V(NaOH) =10mL时,醋酸溶液中: C(Na+ )> C(CH3COO—) > C(H+ )> C(OH—)
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 ml·L-1 NH3·H2O溶液滴定10.00 mL浓度均为0.100 ml·L-1盐酸和CH3COOH溶液的混合溶液,所得曲线如图所示。下列说法正确的是( )A.①点溶液中c(H+)为0.200 ml·L-1B.溶液温度高低为①>③>②C.③点溶液中有c(Cl-)>c(CH3COO-)D.③点后因离子数目减少使溶液电导率略降低
(2016年天津高考)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1ml·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )A.三种酸的电离常数关系:KHA>KHB>KHDB.滴定至P点时,溶液中: c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)D.当中和百分数达100%时,将三种溶液混合后: c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
苏教版 (2019)选择性必修1第三单元 盐类的水解教案配套ppt课件: 这是一份苏教版 (2019)选择性必修1第三单元 盐类的水解教案配套ppt课件,共35页。
苏教版选修4 化学反应原理第一节 弱电解质的电离平衡教案配套课件ppt: 这是一份苏教版选修4 化学反应原理第一节 弱电解质的电离平衡教案配套课件ppt,共29页。PPT课件主要包含了强电解质,弱电解质,③④⑨,课堂练习,②③⑥⑦⑧⑨⑩,②③⑥⑧⑩,④酸式盐的电离,习题9,习题10,思考与交流等内容,欢迎下载使用。
高中化学苏教版选修4 化学反应原理第三单元 盐类的水解教案配套ppt课件: 这是一份高中化学苏教版选修4 化学反应原理第三单元 盐类的水解教案配套ppt课件,共19页。PPT课件主要包含了电荷守恒,你会了吗,会用才是硬道理,余H+,HCO3-,H2CO3等内容,欢迎下载使用。













